硫酸锂碳化—还原制备硫化锂
陈 格 田 欢 徐 川 邓红云 杨 柳 何 霞 杨艳辉 周 复
(1.天齐锂业(射洪)有限公司,四川 射洪 629200;2.锂资源与锂材料四川省重点实验室,四川 射洪 629200)
近年来,随着新能源汽车产业的迅猛发展,全固态锂电池因其优异的性能被认为是未来高比能、高安全的新一代锂离子二次电池。多家世界著名汽车企业相继宣布,2020—2025年全固态锂电池将有望量产上车。相关研究者和企业认为,相对于锂硫电池、锂空气电池、铝电池和镁电池,全固态金属锂电池是可替代现有高能量密度锂离子电池最具潜力的电池。其能量密度有望达到现有锂离子电池的2~5倍,循环性和服役寿命更长,倍率性能更高,而且,具有较高的安全性,良好的热稳定性和电化学稳定性能[1,2]。
固态电解质是全固态锂电池的核心,通常可分为氧化物类和硫化物类电解质[3],但由于氧化物类电解质苛刻的制备工艺、较低的室温电导率和难处理的相界而限制了其在工业上的应用[4]。硫系电解质由于其独一无二的三维晶体结构,具有可以与液态电解质相媲美的电导率和易加工性而受到广泛研究[5]。
硫化锂作为硫基固态电解质合成的所需原料,其纯度对电解质材料及电池性能的提升起着关键性作用。目前合成硫化锂的方法主要有球磨法[6]、溶剂法[7-10]、高温高压法[11-13]和直接碳还原法[14-16]。球磨法因原料成本高(氢化锂)、反应时间长、转化率较低等原因局限了其工业化应用。溶剂法虽反应充分完全且产品提纯容易,但有机溶剂易燃、易爆、易挥发,环境污染严重且不易回收。高温高压法有效避免了有害溶剂泄漏,大幅度缩短了制备流程,但对设备选型要求高,工况不易控制。因此,开发一种新型的高纯硫化锂制备技术,对于解决硫基固态电解质合成受限,提升电解质材料及电池的性能具有重要的现实意义。基于此,本文研究采用硫酸锂碳化还原制备硫化锂,不局限于以往的化学性能研究,着力于实现硫基锂材料产业化的基础研究,从化学反应热力学及动力学角度分析反应颗粒表面与界面性质,从而探索一套切实有效、简单可行的硫化锂制备方案。
1 实验
1.1 实验试剂及设备
硫酸锂为AR级,纯度≥99.5%;蔗糖和无水乙醇均为AR级,纯度99.5%;氩气纯度为99.95%。
设备主要有OTF-1200X管式炉、TG209F3 热重分析仪、HTY-CT1000M实验室型总有机碳检测仪。
1.2 实验方法
称取理论量质量过量5%的蔗糖,将其与硫酸锂混合并研磨充分,然后将研磨后的粉体压片后放置于瓷坩埚中。将瓷舟放置于管式炉内,通过最少三次抽真空通氩气方式排尽管式炉内空气,维持氩气压力为0.1 MPa。按照从常温0.5 h 升温至220 ℃,保温1 h,然后经1 h升温至250 ℃,保温5 h进行碳化包覆反应。碳化结束后继续升温至675 ℃并恒温9 h进行氧化还原反应。
2 结果与讨论
2.1 热力学分析
高温热解法是一种较为理想的硫化锂制备工艺,主要指在高温条件下还原热分解含锂硫酸盐,得到硫化锂。与溶剂法相比,高温热解法具有工艺流程简单、无有害溶剂泄露、可大大缩短制备流程等优势。高温热解法的缺点在于反应不充分,可能存在H2S、CO等有毒气体的排放。
高温热解法制备过程发生的主要反应见式1~7。
硫酸锂与碳的主反应:
Li2SO4+2C=Li2S+2CO2(g)
(1)
Li2SO4+4C=Li2S+4CO(g)
(2)
硫酸锂与碳的副反应:
Li2SO4+3C=S(g)+3CO(g)+Li2O
(3)
Li2SO4+3CO(g)=S+3CO2(g)+Li2O
(4)
产物Li2S与碳的副反应:
2Li2S+3O2(g)=2 Li2O+2SO2(g)
(5)
Li2S+CO2(g)+H2O(g)=Li2CO3+H2S(g)
(6)
其他副反应:
CO2(g)+C=2CO(g)
(7)
四种反应的吉布斯自由能变化ΔG与温度T的关系如图1所示。图1a主反应表明,温度大于320 ℃时,反应开始进行,温度在560 ℃时,反应比较彻底,因此主反应温度选大于560 ℃为宜。图1b中,硫酸锂与碳的副反应在温度大于700 ℃时自发进行,且随温度的升高反应较为彻底。而硫酸锂与一氧化碳的副反应低于920 ℃时均可自发进行,但反应程度随温度的上升有所下降,因此,为抑制硫酸锂副反应的发生,煅烧温度选700 ℃以下为宜。图1c中两种副反应的ΔG与lgK曲线的趋势大致相同,高温有利于抑制该副反应的发生。图1d表明,升温有利于式7副反应的正向进行。
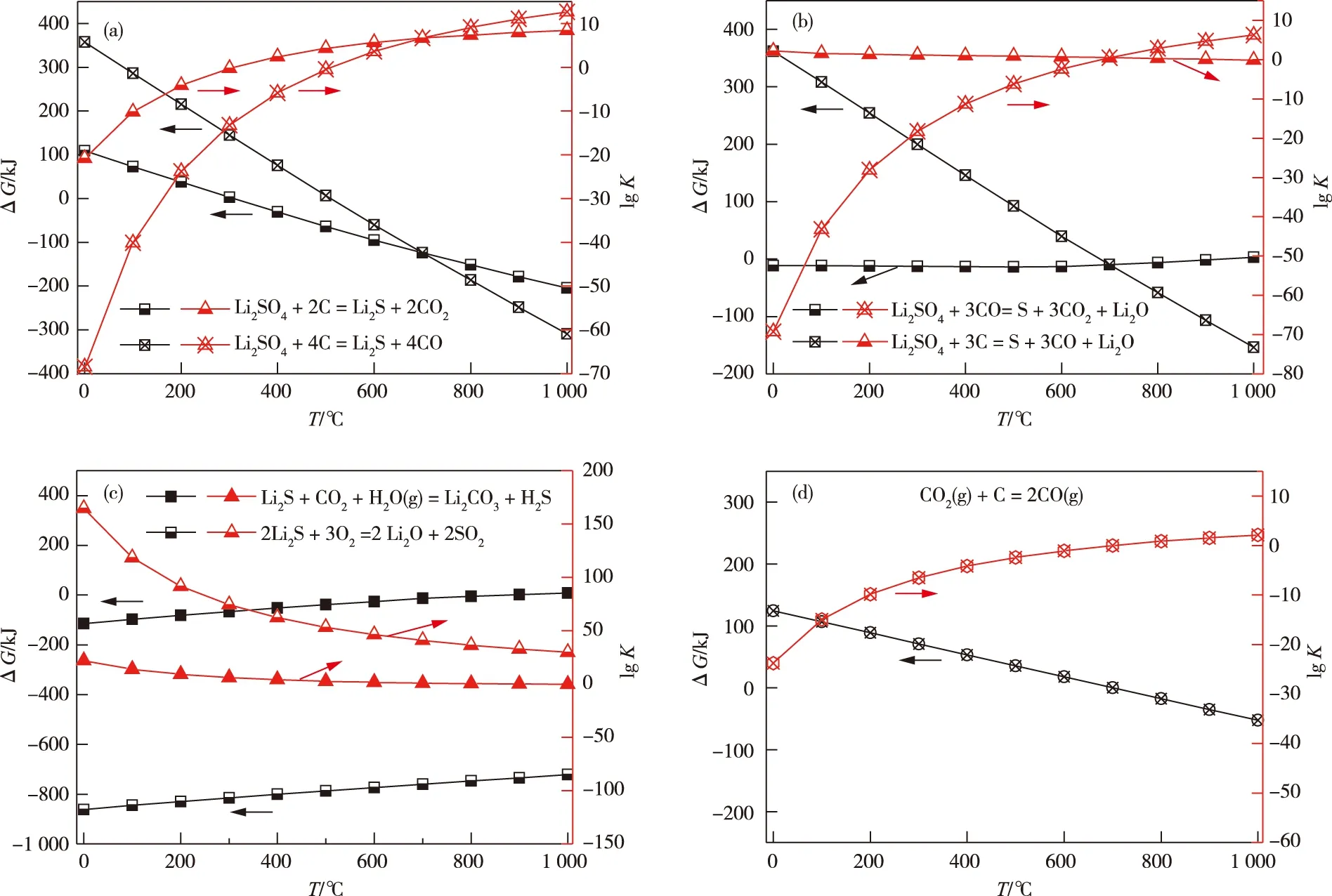
图1 各类反应的吉布斯自由能变 ΔG 与温度 T 的关系Fig.1 Relationship between Gibbs free energy variation of various reactions ΔG and temperature T
以上热力学计算结果表明,欲使硫化锂主反应发生且反应相对彻底,反应温度宜在660 ℃以上。由于生成的硫化锂和水、氧在常温下反应非常彻底,若使副反应不发生,必须全程避免反应时接触H2O和O2,同时反应温度不宜超过700 ℃。
2.2 还原剂选择
作者在探索实验时发现,采用乙炔黑作为还原剂,需要在825 ℃左右反应才较为充分,并且产物与瓷坩埚结块严重,不利于取料。采用葡萄糖作为还原剂时,由于葡萄糖是单糖,在碳化后体积膨胀较小,碳化料呈龟裂状,没有在界面形成致密保护膜,很难将硫酸锂粉末包裹,不利于后续煅烧还原。而选用蔗糖作为还原剂能达到很好的碳化包覆效果,并且产物蓬松易刮取。因此,本文实验用还原剂选择蔗糖。
2.3 蔗糖硫酸锂热重—差热分析
由图2的TG-DCS曲线可知,硫酸锂与蔗糖混合料在250 ℃之前是一个脱自由水过程及蔗糖熔融过程,之后逐渐开始碳化,至693.04 ℃与硫酸锂还原煅烧反应加剧。
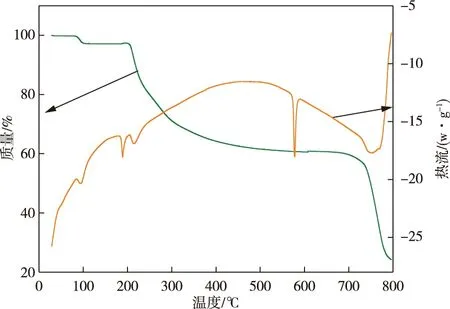
图2 硫酸锂与蔗糖(等摩尔量)TG-DCS图Fig.2 TG-DCS diagram of lithium sulfate and sucrose(equimolar amount)
2.4 煅烧温度和时间对Li2S含量的影响
由图3可知,延长煅烧时间对产品Li2S主含量的提升有一定正向影响。当煅烧时间延长至9 h时,产品Li2S含量达到最高值99.8%,这是由于适当延长煅烧时间可使得硫酸锂与碳反应更为彻底。同时,可观察到产物中有碳酸根的存在,并且含量在1.7%~3.0%波动。

图3 不同煅烧时间高温煅烧样品的Li2S含量(675 ℃)Fig.3 Li2S content of high temperature calcined samples with different calcination time(675 ℃)
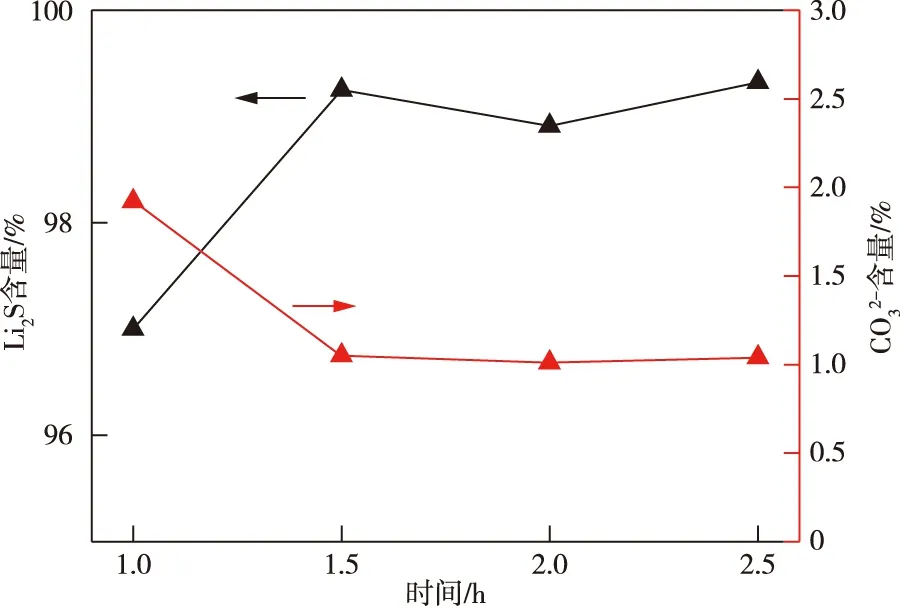
图4 不同煅烧时间高温煅烧样品的Li2S 含量(775 ℃)Fig.4 Li2S content of high temperature calcined samples with different calcination time(775 ℃)
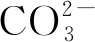
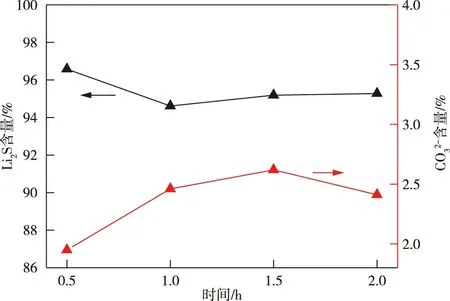
图5 不同煅烧时间高温煅烧样品的Li2S含量(800 ℃)Fig.5 Li2S content of high temperature calcined samples with different calcination time(800 ℃)
综上,在675 ℃下反应9 h和775℃下反应1.5 h均可得到主含量99%以上的硫化锂产品,且操作稳定性较高、数据重现性好,合适的煅烧温度和煅烧时间是一个综合效益平衡点。
3 结论
1)通过对硫酸锂与碳的热解反应进行热力学计算分析,生成硫化锂的主反应发生在煅烧温度高于660 ℃。同时对副反应进行热力学分析的结果表明,煅烧温度高于700 ℃时,会有生成Li2O、Li2CO3的副反应发生。
2)采用蔗糖作为还原剂,在惰性气体保护条件下先进行碳化包覆,再进行高温煅烧还原、675 ℃下反应9 h和775 ℃下反应1.5 h均可得到主含量99%以上的硫化锂产品.
3)采用硫酸锂碳化还原制备硫化锂方法制备硫化锂,安全简单,硫化锂产品质量稳定可靠,有利于扩大化规模生产。

