离子液体在萃取分离中的应用现状与发展趋势
唐 悦 叶国华 胡渝杰 陶媛媛
(昆明理工大学 国土资源工程学院,昆明 650093)
金属离子的萃取分离在湿法冶金行业中的应用较为普遍,而传统的萃取分离过程中会使用到数量较多、易挥发、有毒的有机溶剂,这些有机溶剂的使用会污染环境[1]。因此,制备出一些对环境无毒、无害、无污染的“绿色溶剂”很有必要,并且高效、低成本等因素也是选择合适分离溶剂的关键[2]。有机阳离子和有机阴离子,或者有机阳离子与无机阴离子构成的液态物质就是离子液体(Ionic liquids)。离子液体具有许多优势,如液态范围较宽、难挥发、易设计、热熔大、导电率高等,为湿法冶金提供了新思路和新路线[3]。在萃取分离过程中,传统有机溶剂和无机盐溶液无法与拥有大量优点的离子液体作为萃取剂时所展现的优势相比拟[4]。因而,离子液体也就成为了现在“绿色化学”研究的重点之一,它不仅仅运用到有机合成、电化学等领域,在金属离子萃取分离方面的应用也有着显著效果。本文主要结合国内外的研究成果,阐述离子液体在萃取分离中的应用以及发展趋势。
1 离子液体
1.1 离子液体的种类与性质
季铵盐类离子液体之所以也被称之为室温离子液体或室温熔融盐(RTILs or ILs)[5],是因为它在室温或室温附近温度下呈液态。按照阳离子和阴离子的布列连合方式不同,离子液体可划分成多种类型。根据组成离子液体阳离子的化学结构可分为季铵盐类、季鏻盐类、咪唑类、吡啶类等。离子液体的阳离子化学结构如图1所示。

图1 离子液体阳离子化学结构[6]Fig.1 Chemical structures of ionic liquid cation[6]
依据构成阴离子的不一致可分为卤化盐类和非卤化盐类等,依照水溶性的不同还可以将离子液体划分为亲水性和疏水性两大类,见表1。

表1 离子液体的分类[7]Table1 Classification of ionic liquids[7]
与传统有机溶剂相比,离子液体突出的优点为:
1)液态范围宽,大致范围是-96~400 ℃。基本上可以理解为:它的液态范围是从远远低于或接近室温到400 ℃以上,足以表明离子液体液态范围宽的特点。利用离子液体的室温熔融盐这一特征,在比较低的温度下易于分解、降解[8]的化合物能够溶解。水的液态范围一般是在0~100 ℃,比离子液体的液态范围窄,它的动力学控制的操作弹性也就远次于离子液体的弹性。
2)蒸汽压小。就算是在真空度下或者很高的温度下也会保持非常低的蒸汽压力,这是因为离子液体内部存在着巨大的库伦作用力,一阶的异电荷离子之间的最高相互作用力是水的10倍,约是10 kJ/mol[9],在使用或储存的过程中不易挥发,甚至还可以循环使用,用离子液体代替传统的有机溶剂,可解决有机溶剂易于挥发且污染环境这一问题。
3)导电率高。离子液体的室温离子[10]导电率约在0.1 S/cm。离子液体的黏度、分子量、密度以及离子大小这些因素都会影响离子液体的导电率,其中影响最大的是离子液体的黏度,离子液体的黏度越小,离子导电性就越好。
4)功能可设计性。为了满足实际情况的需要,将不同的阴/阳离子组合,形成新型的离子液体,这些离子液体的性质、功能也会有所不同。但阴/阳离子组合的成果几乎是无限的。曾有研究者们发现,凭借阳离子和阴离子组合方式的差异性,可设计出的离子液体种类高达1018种[11]。
5)熔点低。离子液体的熔点往往在室温或者室温附近,绝大部分人认为影响离子液体熔点的主要原因是阳离子的空间结构,而组成的离子液体的阳离子所具有的对称性低、分子间作用力低以及阳离子电荷分布均匀等特点,才是导致它熔点较低的真正原因[10]。
6)具有溶解性。离子液体能够溶解有机物、无机物以及聚合物等。改变离子液体阳离子的烷基,可调整其溶解性。它的溶解性也与阴/阳离子的性质有着很大联系。由正辛烯在含相同甲苯磺酸根阴离子季铵盐离子液体中的溶解性可以看出,离子液体的季铵阳离子侧链变大(非极性特征增加),正辛烯的溶解性会随之变大[12]。
1.2 离子液体的发展
1914年,WALDEN报道出熔点为12 ℃的硝酸乙基胺([EtNH3][NO3])。它是被发现的第一个在室温下呈液态的有机盐,也被公认为最早的离子液体。但在当时,人们并没有很在意它的存在[13]。1948年,氯铝酸盐离子液体开始出现在人们的视野内,它由加热合成,无色透明,遇水容易分解变质,可应用于电镀体系。1951年,HURLEY等加热N-烷基吡啶与AlCl3固体混合物,获得的最终液体清晰明澄,它就是室温离子液体的初样:氯铝酸盐离子液体。1975年,研究者们合成了N-烷基吡啶氯铝酸盐离子液体,这种液体遇水容易发生反应,比较不稳定。20世纪80年代,以英、法两国的有关机构为代表,开始做出对离子液体作为萃取剂替换传统有机溶剂、催化剂的可行性研究[14]。1982年,1,3-二烷基咪唑氯铝酸盐离子液体横空出世,它比N-烷基吡啶氯铝酸盐离子液体的还原性稳定。1992年,WILKES等组合成了第一个稳定的离子液体[emim][BF4](二烷基咪唑类四氟硼酸、六氟磷酸等),类型是二烷基咪唑类的离子液体,它具有较强的稳定性和抗水性能,它的出现同时也标志着第二代耐水性离子液体的诞生,还原性比N-烷基吡啶氯铝酸盐离子液体更强,可大范围用于催化和电化学等领域。之后,离子液体[emim][PF6]也相继问世。至此以后,对离子液体应用的探索才得以扩展开来,研究者们成功地合成出手性/酸性/碱性等离子液体,这也标志着对离子液体的研究已经逐渐功能化[15,16]。
21世纪以后,对离子液体的研究迈向了新的里程碑,研究者们大力开发第三代离子液体:功能化离子液体。随着新型离子液体不断被设计合成,应用领域逐渐从合成化学、催化反应扩展到过程工程[17]、功能材料等诸多领域。这些离子液体在萃取分离中的应用也特别多。
离子液体发展简史见表2。

表2 离子液体的发展简史[18-21]Table 2 Development history of ionic liquids[18-21]
2 离子液体在萃取分离中的应用
离子液体拥有的独特优点可以利用到诸多工艺。如因为离子液体可以与大多数的有机化合物形成两相[22],它能在有机合成中同时发挥催化剂和溶剂的作用;因为离子液体中无酸性质子,它有较强的导电能力,而且“π-π环”相互作用[23]和黏合性较好,也就多应用于电化学中;因为离子液体分散、稳定,可同时起到修饰剂和双功能催化剂的效果,能够在材料合成中制造金属铂、银纳米粒子[24,25]等纳米材料。离子液体在萃取分离中的应用还只是在初级阶段,通过改变阴/阳离子的组合,设计研究者们所需的离子液体[26]。正因为离子液体种类繁多而且功能可设计,形成多相体系较为简单,特别有利于萃取分离工艺所需。另外,离子液体所具有的不易挥发性和溶解性低的特点,能够代替一些具有相似特性的有机溶剂[27],正逐步实现“绿色化学”的目标。
离子液体的萃取效应与一些其它的萃取剂有着异曲同工之妙,但它的酸碱性会影响萃取分配行为,这对于反萃取都很有优势,因此与溶剂的萃取分离技术进行结合,比传统的萃取分离技术更能增强稳定性,提高可靠性和萃取效率[28]。
在用于金属离子萃取分离时,通常向离子液体中加入螯合剂[29],改变离子液体自身的结构,加强萃取分离的效率。此外,添加特定官能团的功能化离子液体,也能达到最佳的萃取分离效果。
近年来,为了提高咪唑类离子液体在金属离子萃取分离时的效率,研究者们提出了加入螯合剂等一些相关的助剂,以达到萃取的最好结果。JONATHAN等[30]提议选择出了液-液萃取的新桥梁—室温离子液体,在萃取过程中用疏水性的1-丁基-3-甲基咪唑六氟磷酸盐([BMIM][PF6])作为萃取剂替代传统的有机溶剂,解决了传统的有机溶剂易挥发的问题。DAI等[31]为了探究萃取水溶液中的 Sr2+,用1-R1-2-R2-3-甲基咪唑双(三氟甲基磺酰)亚胺(R1R2MeIm+Tf2N-)、1-R1-2-R2-3-甲基咪唑六氟磷酸盐(R1R2MeIm+PF6-)两种离子液体分别与萃取剂二环己基18冠6(DCH18C6)相溶,结果发现Sr2+的分配比(D)在离子液体相中比在甲苯相中要高出多个数量级,用离子液体替换甲苯作为萃取溶剂,这种方法对环境有所保护,实现了无毒化学,并进一步走向了“绿色化学”。
目前,研究者们着重研究向咪唑类离子液体中除却加入螯合剂之外,还加入特定官能团的功能化离子液体的应用。FANG等[32]将合成的硫醇功能化离子液体用于萃取水和食物样品中Cd2+,在相同的温度、pH值条件下,测试了一些金属离子如Na+、Mg2+、Ca2+、Mn2+、Fe3+、Al3+、 Cu2+、Zn2+等对Cd2+萃取率是否有影响,发现它们的存在对Cd2+萃取率的影响并不大,通常在5%以内。二硫代氨基甲酸吡咯、二乙基二硫代氨基甲酸[33]这两种传统的有机溶剂对于Cd2+的选择性并没有硫醇功能化离子液体强,它对Cd2+的萃取效率可高达90.5%,但对其他金属离子的萃取效率不会超过59.1%。此外,硫醇离子液体对Cd2+的回收率也达到了102%,与其余金属离子做比较,它对Cd2+的回收率明显很高。
离子液体萃取分离金属离子是湿法冶金行业中一个比较成熟的工艺。不同金属离子所形成的化合物在互不相溶的两相溶剂中分配比不同,与其他金属离子分离就是利用分配比[34]的差异进行实现,目标对象就会从水相进入到有机相中,也就达到了分离金属离子的目的。与传统萃取体系相比,离子液体在金属离子萃取分离[35]过程中体现出萃取高效、选择性好、稳定性强、挥发性小、绿色环保等优点。因此,这种离子液体也就作为了“绿色”萃取溶剂,同时也成为了“绿色化学”研究的热点。
2.1 碱金属和碱土金属离子的萃取分离
核燃料后处理主要会产生两种高放射性裂变产物[36]:一种是碱金属铯(Cs),另一种是碱土金属锶(Sr),用离子液体萃取分离这两种金属的研究案例较多。
CHEN[37]向离子液体(Bu3MeN-TFSI)中分别加入了两种萃取剂:DCH-18-C-6和杯[4]芳烃二(三-辛基苯并-冠-6)(BOBCalixC6),为了除去水溶液中的Sr2+和Cs+,就将离子液体萃取与电沉积相结合,这样就会生成DCH-18-C-6·Sr2+和BOBCalixC6·2Cs+,它们分别是由Bu3MeN-TFSI离子液体中的Sr2+、Cs+与DCH-18-C-6和BOBCalixC6配对得来,分配系数会影响离子液体中离子载体的浓度与水溶液中金属离子的浓度,分配系数增大,两者的浓度也会随之增大。离子液体中萃取的金属配合物富集到汞电极上,形成了Sr-汞合金、Cs-汞合金两种合金,实现了金属离子的回收。
离子液体自身的结构对其萃取性能有很大的影响。CHUN等[38]制作了[Cnmim][PF6](n=4,5,6,7,8,9)离子液体。这种离子液体对碱金属离子的萃取能力并不是很强,与离子液体阳离子侧链的增长成反比,且萃取的选择性顺序为:Cs+>Rb+>K+>Li+≈Na+,其萃取的选择性顺序和对应碱金属的疏水性质保持一致,向其中加入DC18C6萃取剂,对金属离子的萃取能力才有所增强,这时萃取的选择性顺序变为:K+>Rb+>Cs+> Na+≥Li+,从中也反映出金属离子与DC18C6萃取剂相结合能力的强弱。LUO[39]等选择的溶剂是侧链长度不同的离子液体[Cnmim][NTf2](n=2,4,6,8),萃取剂是DCH18C6、N-烷基-氮18冠6(N-alkyl-aza-18C6),两两融合分别萃取Sr2+,K+,Na+等,发现溶剂相同但萃取剂不同时,它们各自的萃取率以及金属离子的选择性顺序具有差异性。
2.2 重金属离子的萃取分离
随着现代化社会的推进,重金属污染也越来越严重,不仅污染生态环境,还破坏生态平衡,甚至直接危害到人类的健康生活。目前,关于如何解决重金属离子污染的这个问题已经成为人们关注的重要环境问题。电沉积[40]、固相分离[41]、离子交换[42]等工艺都可以用来分离重金属,但是在分离的过程中容易对周围环境造成二次污染。因此,通过阴/阳离子的不同组合[43],配对出具有特定官能团的功能化离子液体,萃取分离工业废水、污水的重金属离子至关重要。
FISCHER等[44]使用了十四烷基三己基膦2-(甲基硫代)苯甲酸([P66614][MTBA])、十四烷基三己基膦硫代水杨酸([P66614][Ts])、十四烷基三己基膦水杨酸([P66614][Sal]),含有硫醇或硫醚的三种不同的功能化离子液体,用于萃取分离公共污水以及工业废水中的重金属离子,这些拥有特定官能团的功能化离子液体对公共污水中Ag+、Hg2+和Cu2+都有着很强的萃取能力,且十四烷基三己基膦硫代水杨酸[P66614][Ts],对Pb2+、Cd2+和Zn2+等重金属离子萃取能力比该类其他两种离子液体的萃取能力强、选择性高,比较适合投入到市场中应用,如用于工业废水中脱除重金属离子。
AL BISHRI[45]等将[NSi-NH2-Bmim][Tf2N]离子液体使用到工业废水、湖水、自来水中萃取Pb2+,在三种不同的液相中,离子液体对Pb2+的萃取率都将近100%。将疏水性离子液体和纳米硅颗粒结合在一起,可以不再向两者的混合物中加入螯合化合物或者中间体,而是直接用到重金属离子萃取中。这种方式无疑成为了研究者们针对离子液体在重金属离子的萃取分离的探究中的又一个探讨重点。
当下,有效提高离子液体在萃取重金属离子时的效率仍在探索阶段,研究者们还未找到可以大幅度、普遍性地提高萃取效率的方法[46],但离子液体已经应用于研究废水中重金属离子的脱除过程中。在涉及到废水处理中,可先对重金属离子富集,接着通过离子液体萃取分离,这样可以减少重金属对地表水、地下水和土壤的污染[47],同时实现金属资源的回收利用。笔者希望今后能够探索更多的离子液体与不同重金属离子的萃取分离,将“绿色溶剂”在重金属离子萃取分离方面的应用倾注到工业废水和污染物等领域。
2.3 过渡金属离子的萃取分离
离子液体在萃取分离过渡金属离子的过程中,让过渡金属离子形成疏水基团进入离子液体相这一步是重中之重。
WEI等[48]用1-丁基-3-甲基咪唑六氟磷酸盐[C4mim][PF6]离子液体用作溶剂,双硫腙(Dithizone)作为螯合剂,用来萃取Zn2+,Cd2+,Hg2+,Ag-,Cu2+等过渡金属离子,如图2所示。
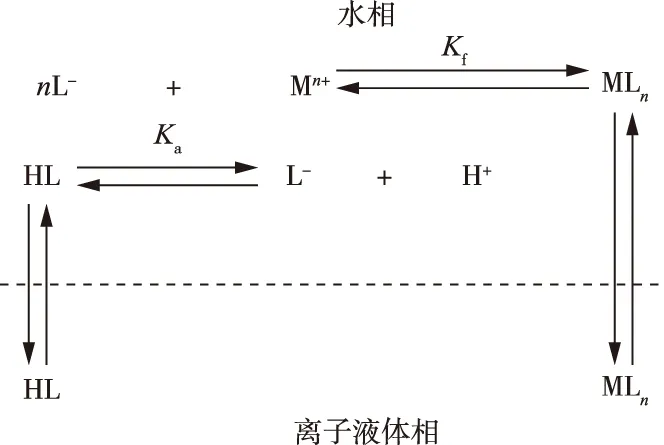
图2 离子液体萃取过渡金属离子过程[46]Fig.2 Ionic liquid extraction of transition metal ions[46]
当pH值很低时,双硫腙布列在有机相中,且大多数的双硫腙呈中性HL的状态,它限度变成金属-双硫腙配合物,如此以来,萃取率会有所下降;当pH值升高时,双硫腙就转换成阴离子的形式,并与金属阳离子聚合变为亲离子液体相的配合物,进入到离子液体相中。萃取过程的分配比与pH 值密切相关:当pH值为 1.9时,双硫腙萃取Ag+和Pb2+的混合物时,它们的浓度相同,结果Ag+有92%被萃取,Pb2+几乎没有被萃取。那么控制金属离子的预富集、分离的过程[49]可以通过调节体系的pH值来完成。HIRAYAMA等[50]用[Cnmim][PF6]离子液体(n=4,6,8)作溶剂,萃取剂采用的是2-噻吩甲酰三氟丙酮,萃取Ni2+、Cu2+、Mn2+、Co2+、Zn2+、Cd2+等过渡金属离子。此体系比一般普遍的有机溶剂充当萃取溶剂时,对金属离子的萃取能力要强很多,但Cu2+、Pb2+除外。
一般情况下,离子液体在萃取分离金属离子时都包含了卤素,虽然这样可以增加其疏水性,但是卤素的存在具有隐形的环境污染问题,未来应该着重开发不含卤素的离子液体。
3 结论与展望
离子液体具有液态范围宽、蒸汽压小、导电率高、功能可设计、熔点低、溶解性可调整、可以循环利用、对环境友好等特性,已经逐渐取代了传统有机溶剂,并且已经用于研究核燃料后处理中的产物如碱金属与碱土金属的回收、工业废水以与公共污水中的重金属离子的处理、过渡金属离子的萃取分离等领域。经过研究人员的努力,其性能由不稳定到稳定、功能由单一到繁多。在作为萃取溶剂萃取分离金属时,向其中加入[BMIM][PF6]、DCH18C6等螯合剂或者添加带有醇硫功能化特定官能团的试剂,还可以提高萃取体系的分配比和金属离子的选择性顺序。通过不停地尝试改变阳离子与阴离子的组合,以及与不同萃取剂相结合的方式可以达到金属离子的反萃回收。并且离子液体针对不同种类的金属离子(碱金属、碱土金属、重金属、过渡金属),与传统的有机溶剂相比,能够体现出突出的萃取优势。
离子液体虽是一种非常有前途的萃取溶剂,但许多离子液体的合成以及本身在提纯过程中仍然需要用到传统的有机溶剂。这无疑会给环境造成污染,那么要真正的实现“绿色化学”,有待开发出新的合成离子液体的方法。目前,对离子液体毒性的相关案例较少,一些金属离子在离子液体中所显露的状态以及分配机制如何还未分析透彻,尚不能保证离子液体进入环境之后,对环境不会造成影响。因此,还需要侧重加强离子液体毒性的探索,在确保无毒无害、安全系数高的环境下,加深离子液体在萃取分离中的应用的研究,使得它在金属离子萃取分离方面的应用更完善。

