基于转录组测序的脓毒症休克转录因子挖掘及验证
林 爽,白永江,马骏麒
(新疆医科大学第四附属医院急诊科,乌鲁木齐 830000)
脓毒症(sepsis)是指因感染引起宿主反应失调而导致危及生命的器官功能障碍,脓毒症休克作为脓毒症的一种,存在循环、代谢功能异常[1]。脓毒症早期过度激活的炎症反应对机体造成一系列严重损伤甚至导致器官功能衰竭发生脓毒症休克,是感染引起宿主机体免疫失调的表现之一,是脓毒症患者早期死亡的重要原因[2]。近年来,国内外关于脓毒症的基础与临床研究较多,但完全阐明脓毒症休克的具体发病机理的研究较少。既往基因组及转录组的研究中,关注脓毒症患者与健康人的差异研究较多[3],而关于脓毒症休克的作用机制相关研究尚不充分。有研究表明,对脓毒症患者实施早期预警,识别危险因素,可更快、更准确地进行规范化治疗,有助于脓毒症的诊断、治疗及预后[4]。因此,本研究着力于阐明脓毒症患者发展为脓毒症休克的分子机制,通过转录组测序分析筛选差异基因,进行基因本体(gene ontology,GO)及基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)数据库富集分析,检测与脓毒症的发生、发展相关的信号通路,对基因表达层面上的差异进行分析,进一步说明信号通路参与识别及应答脓毒症患者发展为脓毒症休克的作用机制,为进一步防治脓毒症休克提供早期诊断治疗策略。
1 资料与方法
1.1 研究对象与分组选择2019年6月-2021年6月在新疆医科大学第四附属医院急诊科住院诊断为脓毒症患者70例作为研究对象,根据随访患者病情及预后,分为脓毒症休克组、脓毒症非休克组,每组35例。纳入标准:符合《拯救脓毒症运动:脓毒症与脓毒性休克治疗国际指南(2016版)》[5]中脓毒症诊断标准序贯器官衰竭评分(SOFA)较基线上升≥2分。脓毒症休克的诊断在脓毒症的基础上,出现持续性低血压,在充分容量复苏后仍需血管活性药以维持,且平均动脉压(MAP)低于65 mmHg、血乳酸浓度>2 mmol/L。排除标准:年龄<18岁或>85岁,不可逆的临终状态或预测24 h内死亡者;患有严重神经系统疾病,且格拉斯哥昏迷评分(glasgow coma score,GCS)评分<5分;患者及家属不配合治疗;肾功能不全者;基础心脏功能疾病或急性冠脉综合征、心源性休克者;妊娠期患者。本研究经新疆医科大学第四附属医院伦审委员会审批通过(2019XE0149-1),所有患者均签署知情同意书。
1.2 方法
1.2.1 一般情况与感染指标分析分析两组年龄、体重等一般资料的差异是否具有统计学意义。对血浆白细胞介素-6(IL-6)、降钙素原、C反应蛋白水平等进行比较。
1.2.2 差异基因分析采集的新鲜全血置于EDTA抗凝管保存,并进行mRNA测序[6]。总RNA抽提试剂Trizol 6 mL与新鲜血液2 mL(Trizol∶血液=3∶1),混匀1~2 min,直至絮状物充分溶解。室温孵育5 min,至核蛋白体完全分解,编号、封存,液氮速冻,-80°C冻存,共进行20例mRNA测序。
1.2.3 差异表达基因GO及KEGG富集分析[7]采用Illumina测序平台对测序所获得的原始数据进行过滤,获得高质量的过滤后片段(clean reads)并进行分析。采用PE150测序策略,样本测序量为6 G对转录组RNA-seq进行基因表达量测定。对样品中的RNA反转录后进行高通量测序,将测序片段(reads)与参考序列进行比对,计算基因表达量测定转录所得的mRNA水平。差异表达基因(DEGs,differentially ex⁃pressed genes)的筛选条件:差异倍数log2(FoldChange)>1为上调表达;log2(FoldChange)<-1为下调表达。对筛选出的差异基因进行多元分析,并采用火山图进行可视化展示。GO是描述基因功能的综合性数据库,包括生物过程BP(biological process)、细胞组成CC(cellular component)及 分 子 功 能MF(molecular function)3个 部 分。GO功 能 富集以矫正 后的P值(p.adj)<0.05作为显著性富集。通过KEGG富集分析,检测关键信号通路,筛选出核心基因,并以p.adj<0.05作为显著性富集的阈值。
1.2.4 蛋白质网络互作分析[7]采用STRING数据库进行差异基因蛋白互作网络分析。针对数据库中包含的物种,从数据库中提取目标基因集(如差异基因列表)的互作关系进行网络构建;利用比对上的该参考物种蛋白质互作关系构建互作网络图。互作网络图中节点(node)的大小与此节点的度(degree)成正比,即与此节点相连的边越多,度越大,则节点也越大,说明该节点在网络中可能处于较核心位置。节点的颜色与此节点的聚集系数(clustering coefficient)相关,颜色梯度由绿到红对应聚集系数的值由低到高;聚集系数值越高,此节点的邻接点之间的连通性越好。
1.2.5 实时荧光定量检测通过实时荧光定量PCR(quantitative real-time PCR,qPCR)分析排名前十位的差异基因,对关键信号通路中的核心基因进行扩大样本量qPCR验证。匹配正常人20例,脓毒症非休克组患者20例,脓毒症休克组患者20例,扩增条件:95℃10 min预变性,95℃10 s变性,58℃30 s退火,72℃10 s延伸,共进行40个循环。定量表达结果根据每次反应内荧光信号到达设定域值时所需循环数(cycle threshold,CT)数值,根据2-ΔΔCt法,计算其相对表达量。引物设计及合成,见表1。

表1 PCR引物设计
1.3 统计学处理所有数据采用SPSS20.0统计软件进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以构成比表示,比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料与感染指标结果比较两组研究对象基本情况无明显差异,具有可比性(P>0.05),见表2。两组血浆IL-6、降钙素原、C反应蛋白水平差异具有统计学意义(P<0.05),见表3。
表2 两组一般资料比较(±s)

表2 两组一般资料比较(±s)
指标年龄/岁体重/kg n 35 35脓毒症休克组67.06±8.94 66.77±8.65脓毒症非休克组66.94±8.81 66.71±8.58 t值0.054 0.028 P值0.95 0.97
表3 两组IL-6、降钙素原、C反应蛋白水平的比较(±s)

表3 两组IL-6、降钙素原、C反应蛋白水平的比较(±s)
组别脓毒症休克组脓毒症非休克组t值P n 35 35 IL-6/(pg/mL)65.94±15.45 23.86±6.38 14.89<0.05降钙素原/(ng/mL)32.94±9.58 9.57±4.81 12.89<0.05 C反应蛋白/(mg/L)47.46±7.98 18.94±3.90 18.98<0.05
2.2 差异基因分析火山图结果显示,上、下调基因分布基本均匀,见图1。差异基因筛选共获得28 543个差异基因,其中下调基因1 126个,STAT1为前十名的差异基因;上调基因1 053个,MYD88、JUN2均为前十名的差异基因,见图2。
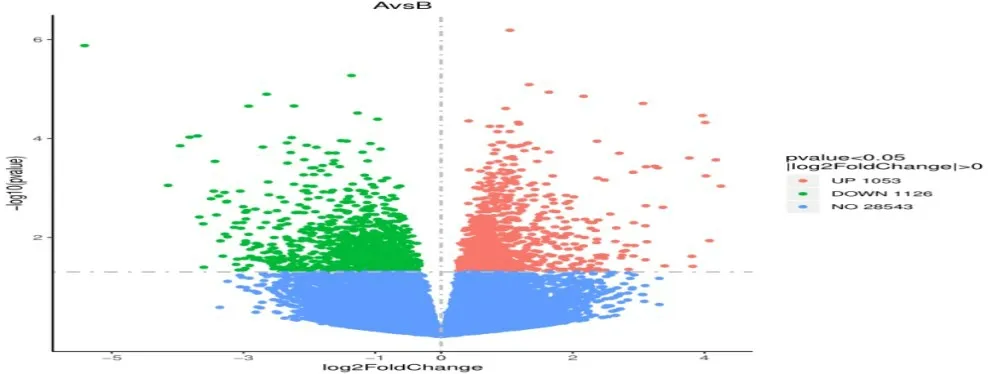
图1 差异基因火山图
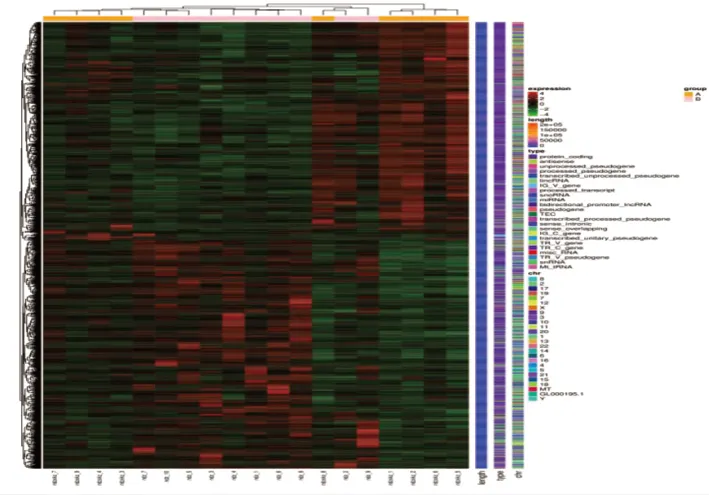
图2 差异表达基因聚类热图
2.3 差异表达基因GO及KEGG分析结果比较GO富集分析结果显示,上调差异基因功能集中于生物过程(biological process),包括中性粒细胞脱颗粒、中性粒细胞活化、中性粒细胞介导免疫应答、免疫检测过程的调控等,下调差异基因功能集中于细胞组成(cellular component)包括溶酶体颗粒释放、细胞膜水解酶活性改变等,而分子功能(molecular function)主要调控肿瘤坏死因子受体超家族s补体结合、钙黏蛋白结合、RNA聚合酶原裂解酶活性改变、UDP糖基转移酶活性改变等,见图3。KEGG富集分析发现,核苷酸结合寡聚结构域样受体信号通路(nucleotide binding oligomerization domain-like receptors,NOD),Toll样受体信号通路(toll like receptors,TLRs),视黄酸诱导基因1样受体信号通路(retinoicacidinduciblegene-1,RIG-1)等均与脓毒症的发生、发展相关。结合差异基因分析,STAT1、MYD88、JUN2基因均属于TLRs通路相关基因,TLRs通路为富含前十位差异基因最多的信号通路,见图4。
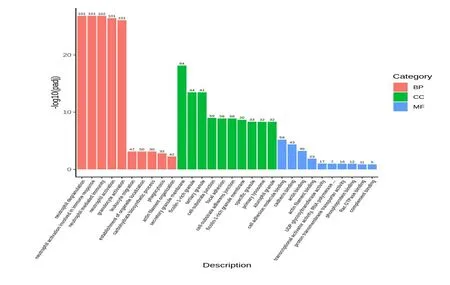
图3 GO富集分析结果
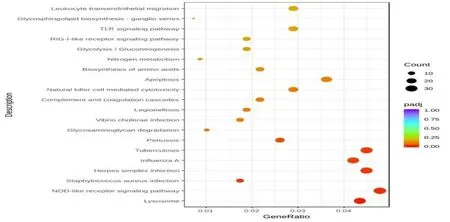
图4 KEGG富集分析结果
2.4 蛋白质网络互作分析TLRs信号通路中对疾病发生起上调作用的基因为MAPK3、MYD88、TOL⁃LIP、MAP2K3、RELA、JUN2、FADD;下调作用的基因为CXCL10、CXCL9、CXCL11、IRF7、MAPK12、STAT1,见图5。

图5 TLR通路蛋白质网络互作图
2.5实时荧光定量(qPCR)检测结果TLRs信号通路中起关键作用的MYD88、JUN2、CXCL10、STAT1基因验证结果显示,MYD88、JUN2基因在脓毒症休克组中的相对表达量高于脓毒症非休克组,CXCL10、STAT1在脓毒症休克组中的相对表达量低于脓毒症非休克组,差异具有统计学意义(P<0.05),见图6。
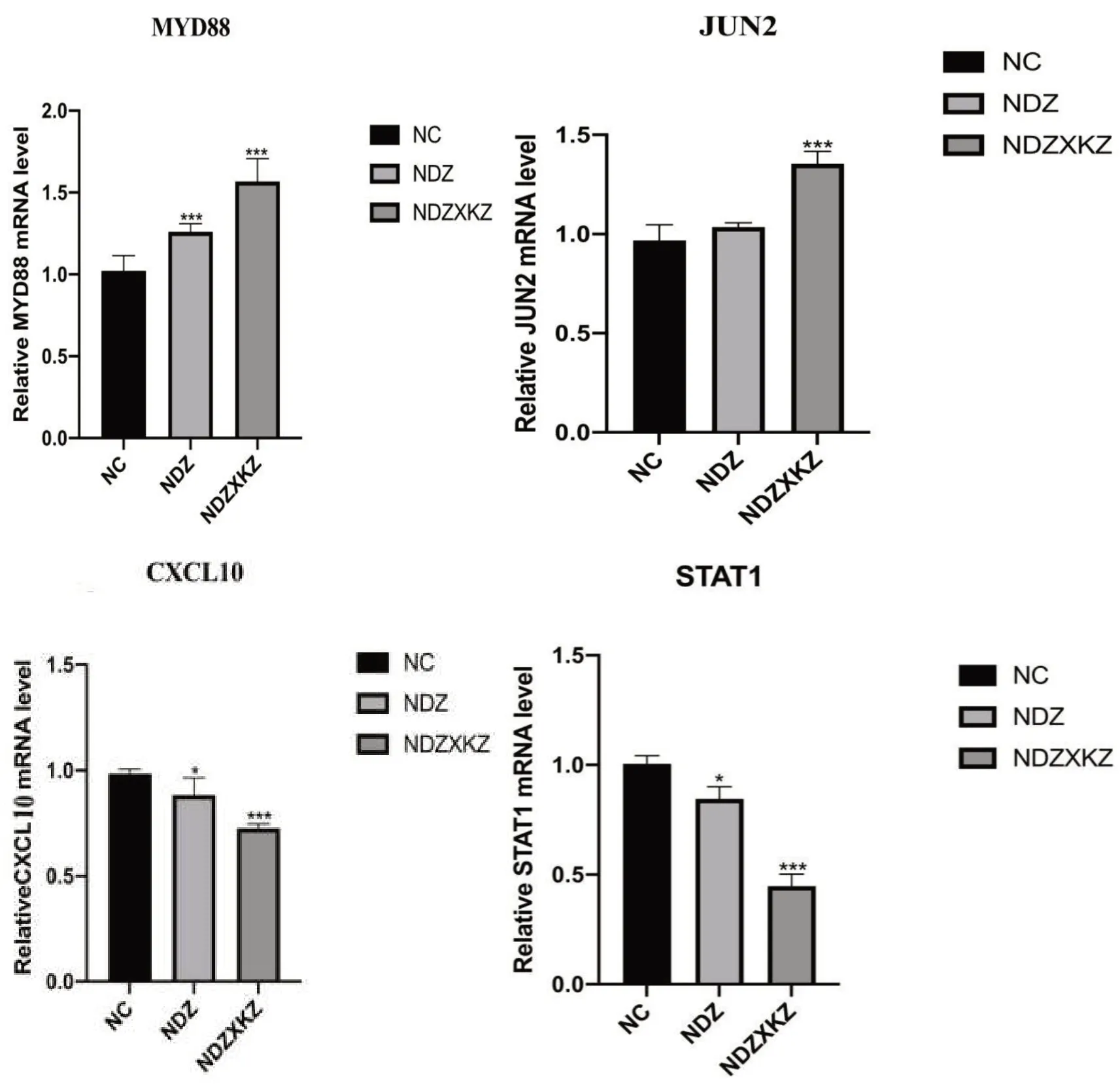
图6 PCR验证结果
3 讨论
脓毒症是由严重的感染引起的全身性炎反应,而脓毒症休克为其较严重的情况,其死亡率较高。目前有证据表明[8-9],脓毒症休克的急诊优化治疗,可以提高治疗质量,由此改善此类患者的预后,本研究关注脓毒症休克的早期诊断,通过转录组高通量筛选技术分析脓毒症非休克患者及脓毒症休克患者差异基因,对差异基因进行GO数据库、KEGG数据库富集分析出影响脓毒症休克发病的信号通路,NODlike通路,TLRs信号通路、RIG-1样受体信号通路等与脓毒症的发生、发展相关。经差异基因分析显示,排名前十名的差异基因STAT1,MYD88、JUN2均属于TLRs通路。TLRs受体家族的成员可以识别传统的微生物菌株结构,参与先天免疫与后天免疫,在宿主防御中起着关键作用。经蛋白质互作网络分析,筛选TLRs通路中可能影响脓毒症休克发病的关键基因,TLRs通路中对疾病发生起上调作用的基因为MAPK3,MYD88,TOLLIP,MAP2K3,RELA,JUN2,FADD,下 调 作 用 的 基 因 为CXCL10,CXCL9,CX⁃CL11,IRF7,MAPK12,STAT1。
研究表明[10-13],MYD88基因编码是一种在先天性与适应性免疫应答中起中心作用的细胞溶质结合蛋白质。该蛋白质在白细胞介素-1、TLRs信号通路中起着重要的信号转导作用,调节诸多促炎症基因的激活;JUN2基因编码与病毒蛋白高度相似的蛋白质;CXCL10基因编码CXC亚家族的趋化因子可以刺激单核细胞、自然杀伤细胞和T细胞迁移以及调节黏附分子的表达,起到抑制炎症的作用;STAT1基因编码的蛋白质可被多种配体激活,包括α干扰素、γ干扰素和白细胞介素6,在对病毒、真菌及分枝杆菌病原体的免疫应答中起重要作用。根据差异基因分析及蛋白质互作分析结果选取TLRs信号通路中MYD88,JUN2,CXCL10,STAT1基因进行扩大样本量qPCR验证,结果与转录组分析一致。
综上所述,本研究得到与导致脓毒症易于发展为脓毒症休克的机制相关的关键基因,为进一步的预防与制定治疗策略提供可能的研究方向。

