比格犬下颌骨层片状与线性骨折愈合进程中生物力学分析
邵静宇,陈俊文,李 军,徐 前
(1新疆维吾尔自治区人民医院口腔颌面外科,乌鲁木齐 830001;2湖北省天门市第一人民医院口腔科,湖北 天门 431700)
面部外伤是口腔颌面部最常见的疾病之一,多数外伤均与颌面部损伤有关[1]。据流行病学研究报道,颌面部损伤最常见的类型是颌面部骨折(66.9%),而最常见的骨折部位则是下颌骨[2]。由于下颌骨结构及解剖形态导致其骨折率高,其中下颌骨体部层片状、线性骨折为下颌骨折的常见类型。目前国内外关于下颌骨体部层片状骨折在临床内固定研究协会/骨科创伤协会(association for the study of internal fixation/the orthopaedic trauma association、OTA/AO)分类系统中均无较为准确、细致的分型及相应的治疗指南与方案。同时,由于层片状骨折线走行特殊性,导致其临床治疗具有一定的挑战性。在临床治疗工作中,经常将层片状骨折按照常规治疗方案进行手术及治疗。因此,本研究对骨折愈合进程中的生物力学进行分析,以期为层片状骨折临床治疗提供理论依据。
1 材料与方法
1.1 实验动物与分组健康成年比格犬18只,20~24月龄,体重8.0~12.0 kg,雌雄不限。实验动物由新疆医科大学实验动物中心提供[动物许可证号:SCXK(新)2018-0003],实验已通过新疆维吾尔自治区人民医院伦理委员会审批(KY2018060613),并在符合国家相关要求设施内完成。实验过程符合动物福利相关法规、标准。所有动物入圈圈养1周后,按登记顺序编号,将偶数分为线性组,奇数分为层片组,每组9只。层片组行层片状截骨,即建立长度范围约2.0 cm角度约25°的层片状骨折模型;线性组行线性截骨,骨切开线方向与下颌骨下缘垂直,即建立线性骨折模型,见图1。
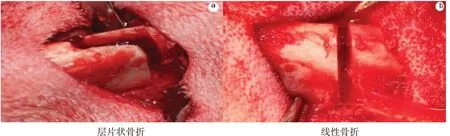
图1 两组骨折模型图
1.2 实验材料钛板,板厚0.6 mm、长12 mm,螺钉直径1.5 mm、长8 mm,由西安中邦钛生物材料有限公司提供(CN102846356A)。微机控制电子万能试验机(济南鑫光试验机制造有限公司),MC鲁制01000068号,型号DWD-5,规 格50 KN(编 号:J170914D),精度0.5级。
1.3 手术方法所有动物禁食12 h。术前建立静脉通道,静脉滴注500 mL葡萄糖及生理盐水,术前半小时皮下注射氨苄青霉素1.4 g。采用速眠新Ⅱ(0.6 mg/kg)与舒泰(0.75 mg/kg)混合肌注诱导麻醉,麻醉显效后,犬左侧下颌下备皮。实验动物取仰卧位,四肢固定,常规消毒铺巾。手术部位局部皮下注射0.5%必兰麻,以减少术区出血。左侧平行下颌骨下缘作长3.0 cm弧形切口,15号手术刀按美兰划线切开黏膜、肌肉及骨膜,沿骨面剥离骨膜,暴露左侧下颌骨下缘至下颌骨体部牙槽嵴骨面,使用电刀电凝止血。
1.3.1 层片组建立第一磨牙至第一前磨牙下颌骨体部上缘向下凿出与下颌骨长轴成25°夹角的断面,使下颌骨唇颊侧骨皮质与舌侧骨皮质分离形成层片状,骨刀逐渐向下劈开下颌体内外侧骨板,下颌骨撑开器完全离断下颌骨内外侧骨板,建立下颌骨体部层片状骨折。
1.3.2线性组建立第一磨牙与第一前磨牙间的区域凿出垂直于下颌骨体部的凹槽,凹槽由下颌骨颊侧移行至舌侧磨牙牙槽嵴,截断下颌骨,建立下颌骨体部线性骨折。手术过程中需注意牙根、颏神经及下牙槽神经。充分松解下颌骨体部骨断端后,在恢复并保持正常咬牙合关系的同时复位骨断端。下颌骨体部颊侧骨折线两侧分别并排打入4孔,打孔深度至舌侧骨板松质骨距离约5 mm,打孔同时进行冲洗,2套中邦4孔钛板及配套螺钉固定下颌骨体部骨断端。
1.4 术后处理术后3 d,2次/d皮下注射氨苄青霉素1.4 g预防感染,1次/d皮下注射卡洛芬70 mg止痛,高蛋白营养支持1周,观察创面愈合情况。术后1周拆除比格犬下颌骨术区缝线。
1.5 愈合骨组织取材与X线评估分别于术后2周、1个月、3个月处死两组实验动物,每个时间点3只,共9只。去除下颌骨残留软组织后立即取出完整下颌骨进行影像检测,球管距离75 cm,输出电压480 kV,输出电流80 mA,爆光时间0.08 s,观察骨折愈合情况及骨小梁改建情况。采用双盲法,由两名具有高级职称的口腔颌面外科医师阅片。
1.6 力学四点弯曲试验将下颌骨标本骨折线至于顶端跨距为8 mm,底端跨距为20 mm的中心位置固定,保持加载速度为1 mm/min进行加载,见图2。测量时保持位置一致及标本湿润状态,通过材料试验机配套计算机记录载荷-位移曲线。以骨断裂线为中心,截取长2 cm的下颌骨标本进行标记后浸泡于多聚甲醛固定,并置于-80℃干冰中储存。对两组断裂能、刚度、最大载荷进行比较。

图2 力学四点弯曲试验图
1.7 愈合骨组织的组织学观察以骨断裂线为中心,截取长约2 cm的下颌骨标本本进行脱钙、脱水、石蜡包埋、0.22 μm切片后进行HE及Masson染色,观察愈合组织成分、骨折愈合形式。
1.8 统计学处理数据分析采用SPSS 23.0统计软件进行。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 两组术后观察结果所有实验动物均从麻醉中恢复平稳,并在第二天开始正常进食、排便,手术后均未见伤口裂开或感染迹象。
2.2 两组X线评估结果比较术后2周,两组标本骨痂少,骨切开线均清晰,外侧皮层均无显著骨痂形成,而内侧末端可见一薄层骨膜组织;术后1个月,两组骨痂均显著增多,线性组骨切开线开始模糊,但仍可见完整的骨切开线,层片组骨切开线基本消失,骨折间隙中见部分骨桥出现;术后3个月,骨痂较前缩小,线性组骨折间隙透射影模糊,切开线模糊,骨小梁结构不清,层片组间隙基本愈合,骨切开线消失,骨折部位几乎完全用新骨桥接,可见较为完整骨小梁结构,层片组愈合速度整体上较线性组快,见图3。

图3 两组术后X线影像图
2.3 组织学评估病理切片结果显示,术后2周两组骨折断端骨痂形成,胶原纤维增多,骨折间隙为增生的纤维肉芽组织,层片组骨折间隙中可见骨组织与纤维间延续,此现象并未在线性组中出现。术后1个月,骨断端形成骨组织,两组骨痂的骨小梁进一步增粗,层片组骨组织具有一定的方向性,成骨细胞活跃,胶原纤维组织增生变少,新生骨量变少。术后3个月,两组骨折间隙区新生骨改建成熟,层片组骨细胞及成骨细胞更丰富,未见破骨细胞,见图4、5。
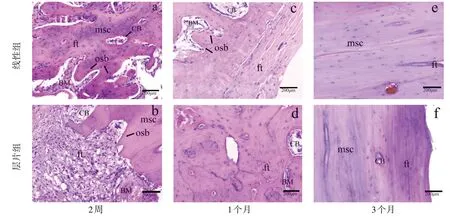
图4 术后HE染色图(×200)
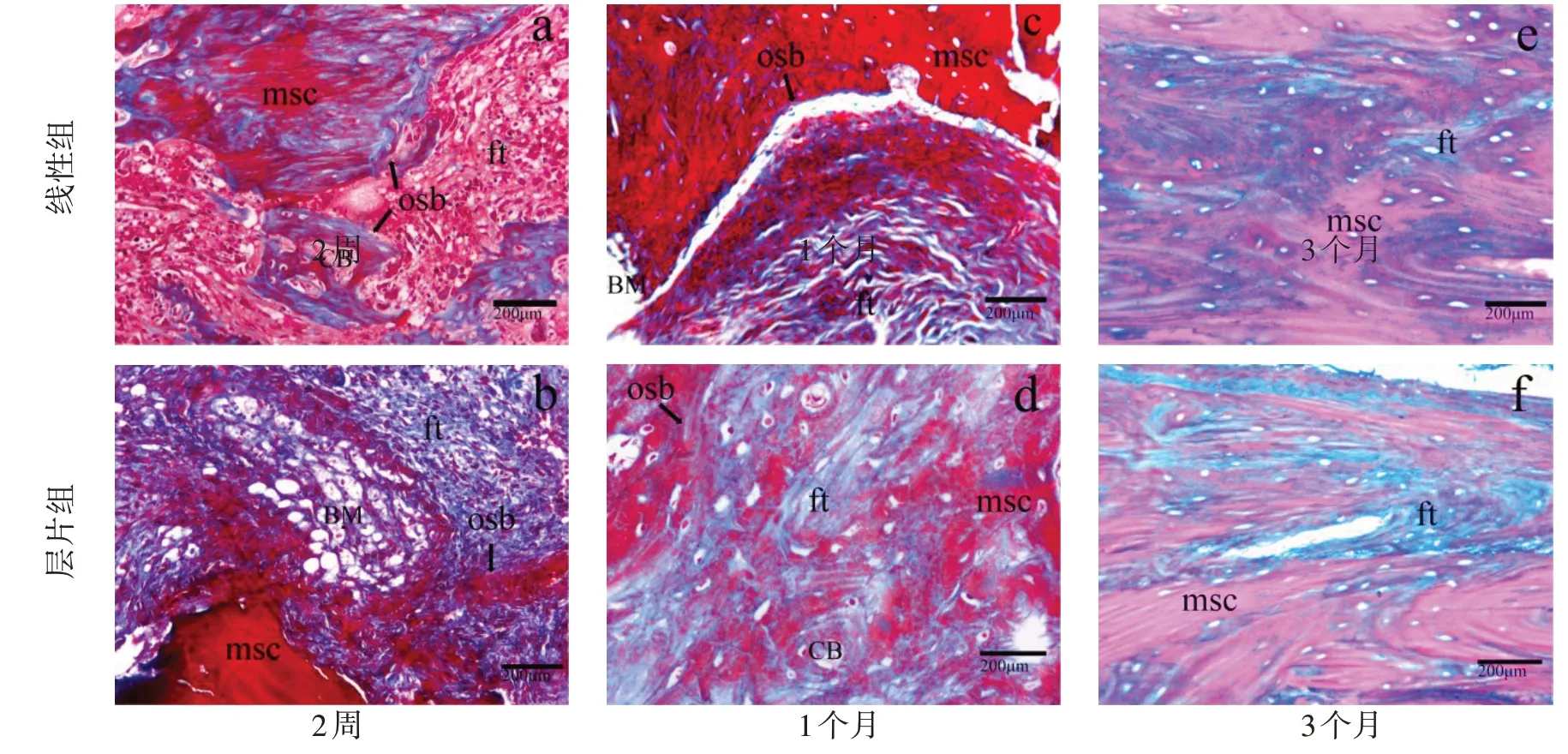
图5 术后Masson染色图(×200)
2.4两组生物力学评估四点弯曲试验结果显示,载荷-位移曲线达到最高峰时下颌骨出现裂缝,载荷-位移曲线最高点时呈断崖式下降,下颌骨骨折线断裂程度随时间增加而增加。随着骨折愈合时间的延长,两组标本力学参数相对增高。术后1个月,层片组最大载荷、断裂能高于线性组(P<0.05)。术后3个月,层片组最大载荷、刚度高于线性组(P<0.05),层片组骨折愈合后的生物力学总体情况较线性组好,见表1。
表1 术后四点弯曲试验情况比较(±s)
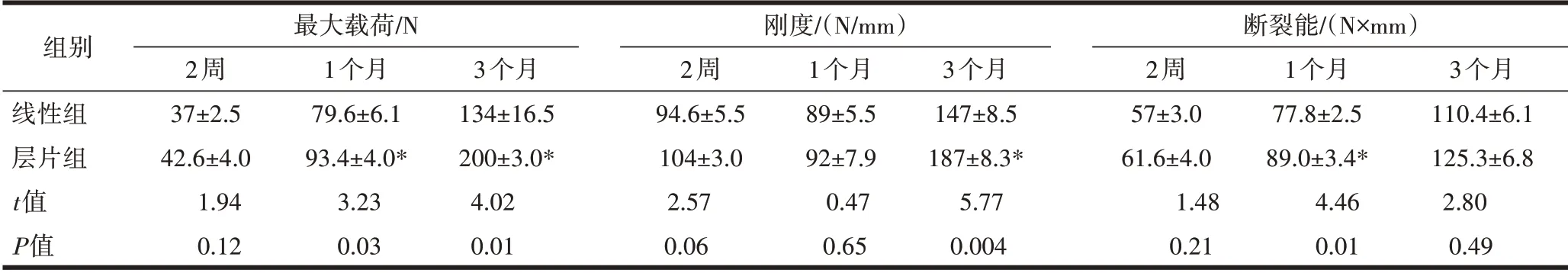
表1 术后四点弯曲试验情况比较(±s)
注:与线性组比较,*P<0.05。
组别线性组层片组t值P值最大载荷/N 2周37±2.5 42.6±4.0 1.94 3.23 4.02 0.12 0.03 0.01 1个月79.6±6.1 93.4±4.0*3个月134±16.5 200±3.0*刚度/(N/mm)2周94.6±5.5 104±3.0 2.57 0.47 5.77 0.06 0.65 0.004 1个月89±5.5 92±7.9 3个月147±8.5 187±8.3*断裂能/(N×mm)2周57±3.0 61.6±4.0 1.48 4.46 2.80 0.21 0.01 0.49 1个月77.8±2.5 89.0±3.4*3个月110.4±6.1 125.3±6.8
3 讨论
坚固内固定技术已成为口腔颌面部骨折的首选治疗方法,已广泛用于临床[3]。本研究结果显示,手术后第2周、1个月、3个月均未出现植入物引起的不良反应,这表明坚固内固定方法可以保证层片状骨折的稳定,满足层片状骨折愈合的需要。
临床上,骨折愈合受局部生物学、生物力学及多种系统因素的影响。其中生物力学因素主要包括:骨折固定的稳定性,骨折类型,骨断端的应力类型及大小等[4]。有研究认为,早期骨折固定的稳定性是骨折愈合的关键前提,骨折稳定性的缺失会造成骨愈合延迟,甚至骨不愈或骨不连[5]。早期愈合组织的机械微环境会受到骨折固定,骨折的几何形状以及施加的载荷的影响。Miramini等[6]通过机械测试结合计算模型研究骨折倾斜度对早期骨折愈合的影响,结果表明,倾斜角(θ)对片段间运动(IFM)有重要影响,片段间运动(Inter-fragmentary movement,IFM)影响愈合组织的机械微环境。骨折附近皮质的轴向IFM随θ减小,而剪切IFM随着倾斜角显著增加,与横向骨折相比,较大的θ可以使剪切IFM增加4倍,但它也会在骨折愈合的皮层附近产生应力效应。因倾斜角度大(θ≥30°)易导致皮质骨骨形成不均匀,且近皮质层的轴向运动会增加骨折固定的不稳定性。临床研究和动物实验也表明,轴向运动在锁骨板稳定的骨折近皮质附近过小,可以抑制骨的形成导致愈合延迟[7]。因此,骨折部位的过度剪切运动已被认为是倾斜骨折不稳定的重要决定因素。骨断端的扭转运动被普遍认为不利于愈合组织的生长,在扭转载荷运动下的骨断端会延迟愈合。而循环加载轴向应力会促进骨痂的形成以及矿化过程,有利于骨折愈合[8]。
分析X线结果,同一时间下层片状骨折组较线性骨折组愈合进展略快,这说明层片骨折组愈合能力较线性骨折组强。这与Tourolle等[9]的研究结果一致。而染色结果显示,在术后1个月,3个月层片状骨折组较线性骨折组有更为丰富的纤维组织与活跃的骨细胞,说明骨细胞能促进骨折愈合,这也与X线结果相互验证。而骨细胞及其分泌因子可能在骨折修复中起关键的调节作用[10],可调节骨代谢、再生、重塑[11]。努尔曼·衣西坚等[12]对骨折愈合机制的探讨证明,骨折愈合过程中增强骨细胞活性能促进骨折愈合。生物力学结果显示,层片组骨折愈合后的生物力学总体情况较线性组好,说明在愈合过程中所受应力类型更有利于层片状骨折断端的愈合。Ren等[13]研究表明,不同几何形状裂缝的片段间运动(IFM)差异可显著改变愈合时间,即使没有会增加损伤严重性的生物学混杂因素,几何形状也可影响骨折愈合。通过坚固内固定方式进行骨折固定,层片状骨折与线性骨折因骨折类型不同在愈合上也会有所差异,而层片状骨折受断端的几何形状、更利于骨折愈合的断端应力等影响,同一时间层片状骨折较线性骨折愈合更快,愈合后骨力学性能更佳。本研究不足之处是建立的骨折模型仅代表临床常规层片状骨折类型,并不能代表所有层片状骨折类型。
综上所述,下颌骨体部层片状骨折所受生物力学更有利于骨折愈合,可为临床选择手术方式、治疗方案及干预措施提供理论依据。
——以内蒙古伊敏煤为例

