不同酶对巫山淫羊藿中淫羊藿苷和朝藿定C含量的影响及抑菌活性研究
谢娟平,常永宏,强世喜,刘春阳,陈嘉悦
(1.安康学院医学院,陕西 安康 725000;2.安康学院 秦巴中药资源研发中心,陕西 安康 725000)
巫山淫羊藿(EpimediumwushanenseYing)始载于《神农本草经》,味苦、辛,性温,归肝、肾经,具有补肾阳、强筋骨、祛风湿等功效,临床常用于治疗小儿麻痹症、神经衰弱、慢性气管炎等,是药用历史悠久的传统中药之一[1-3]。巫山淫羊藿含多种成分,具有防抑郁、抗肿瘤、抗氧化和增强机体免疫力等功能,也具有抗皮肤老化、美白等功能[3]。巫山淫羊藿的有效活性成分淫羊藿苷和朝藿定C是目前市场急需的保健原料之一。但是巫山淫羊藿中的淫羊藿苷含量并不高,目前多采用大孔树脂进行纯化提高含量[4]。而巫山淫羊藿中药材含有多种与淫羊藿苷结构类似的成分,理论上存在生物转化为淫羊藿苷的可能性,与朝藿定C结构类似的化合物也有转化为朝藿定C的可能。
生物酶能分解细胞壁中的纤维素、半纤维素及果胶,加快有效成分溶出,提高提取效率,同时作用于目标产物中立体结构大的活性成分。因此,使用葡萄糖苷酶、转苷酶、淀粉酶等断裂糖苷键,改变理化性质,提高效用[5-6]。酶解法高效,条件温和,操作简单,能更好提升产率更利于工业生产。纤维素酶、果胶酶和α-淀粉酶是目前酶解常用的酶,其中纤维素酶是一种复合酶,能够降解纤维素及纤维素衍生物;果胶酶可以降解细胞间的果胶质,使细胞从组织内分离出来;α-淀粉酶可以断裂淀粉内部的α-1,4-糖苷键[7-10]。
为探索一种绿色方法来提高巫山淫羊藿中淫羊藿苷和朝藿定C的含量,达到绿色高效提取的目的,作者将酶解与大孔树脂纯化相结合,在巫山淫羊藿提取物中分别加入α-淀粉酶、果胶酶、纤维素酶进行酶解,经大孔树脂纯化后采用HPLC法测定巫山淫羊藿中淫羊藿苷和朝藿定C含量;并初步研究巫山淫羊藿提取物对金黄色葡萄球菌和大肠杆菌的抑菌活性[11],为巫山淫羊藿有效成分的开发奠定基础。
1 实验
1.1 材料、试剂与仪器
巫山淫羊藿提取物,安康市宝杰植化有限公司。
淫羊藿苷标准品、朝藿定C标准品、α-淀粉酶,上海源叶生物科技有限公司;SCDLP液体培养基、卵磷脂吐温80营养琼脂,北京陆桥技术股份有限公司;果胶酶、纤维素酶,河南美罗实业有限公司;乙腈、甲醇,山东禹王天下新材料有限公司;乙醇,天津天力化学试剂有限公司;AB-8大孔树脂,天津光复精细化工研究所。
电子天平,北京赛多利斯仪器系统有限公司;DK-2000-Ⅲ L型电热恒温水浴锅,天津泰斯特仪器有限公司;KH-250DE型超声波清洗器,昆山禾创超声仪器有限公司;LC-20A型高效液相色谱仪,日本岛津公司;LRH-150型生化培养箱,海慧泰仪器制造有限公司。
1.2 方法
1.2.1 巫山淫羊藿提取物的酶解
称取巫山淫羊藿提取物3份,每份5 g,分别置于烧杯中,按料液比1∶10(g∶mL)加入蒸馏水溶解;分别加入0.5%(以提取物溶液体积计)的α-淀粉酶、果胶酶、纤维素酶,超声1 h后继续保温(50 ℃)酶解8 h,即得巫山淫羊藿黄酮,分别命名为α-淀粉酶酶解物、果胶酶酶解物、纤维素酶酶解物。
1.2.2 巫山淫羊藿提取物的纯化
取AB-8大孔树脂4份,每份50 g,分别置于烧杯中,加入95%乙醇浸泡2 h;分别装柱,蒸馏水清洗至无醇味。将巫山淫羊藿提取物、α-淀粉酶酶解物、果胶酶酶解物、纤维素酶酶解物分别上柱吸附,蒸馏水洗至无色后用8 BV 75%乙醇洗脱,收集洗脱液,回收乙醇,浓缩,于80 ℃烘箱中干燥6 h,分别得到巫山淫羊藿纯化物、α-淀粉酶酶解纯化物、果胶酶酶解纯化物、纤维素酶酶解纯化物。
1.2.3 HPLC法测定淫羊藿苷和朝藿定C的含量
1.2.3.1 混合标准溶液的制备
精密称取1.0 mg淫羊藿苷标准品和朝藿定C标准品于10 mL容量瓶中,用50%乙醇定容,混匀,配制成0.1 mg·mL-1的混合标准溶液。
1.2.3.2 供试溶液的制备
精密称取巫山淫羊藿提取物或纯化物0.2 g于锥形瓶中,用20 mL 50%乙醇溶解,称重;超声45 min,补足重量,混匀;取1.0 mL定容至10 mL容量瓶中,混匀,0.45 μm滤膜过滤,即得供试溶液。
1.2.3.3 色谱条件[12]
BP-C18色谱柱(4.6 mm×150 mm,5 μm),流动相为乙腈-水(25∶75,体积比),流速1.0 mL·min-1,检测波长270 nm,柱温30 ℃,进样量10 μL。
1.2.4 滤纸片法测定巫山淫羊藿提取物的抑菌活性
1.2.4.1 样品溶液的制备
称取40 mg巫山淫羊藿提取物、巫山淫羊藿纯化物、果胶酶酶解物、果胶酶酶解纯化物,分别置于4个烧杯中,配制成10 mg·mL-1溶液;取直径1 cm的圆形滤纸片放入上述溶液中浸泡2 h,备用。
1.2.4.2 固体培养基的制备
称取卵磷脂吐温80营养琼脂2.55 g于玻璃瓶中,加入50 mL蒸馏水溶解,封瓶;沸水中加热溶解至无沉淀,冷却后倒入培养皿中,于超净工作台凝固24 h,备用。
1.2.4.3 抑菌实验
称取SCDLP液体培养基2.28 g于玻璃瓶中,加入60 mL蒸馏水溶解,封瓶;沸水中加热溶解至无沉淀,冷却后倒入培养管中;用移液管取金黄色葡萄球菌或大肠杆菌各1 mL至培养管中,于保温箱中保温24 h;取出,用移液管取0.5 mL至固体培养基上,用涂布器涂抹均匀,再将浸泡2 h的圆形滤纸片放在上面,盖上培养皿盖子,置于培养箱中培养4 h。
2 结果与讨论
2.1 HPLC图谱
混合标准溶液和供试溶液在色谱条件下的HPLC图谱如图1所示。
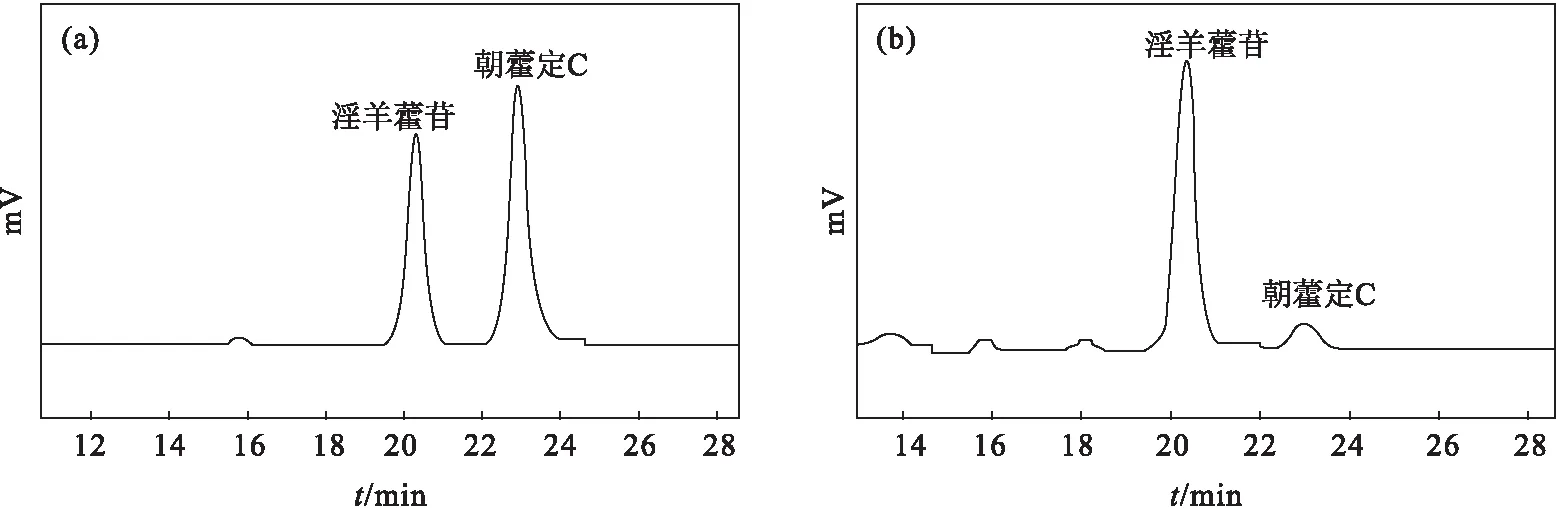
图1 混合标准溶液(a)和供试溶液(b)的HPLC图谱Fig.1 HPLC spectra of complexed standard solution(a) and test solution(b)
由图1可知,在色谱条件下,样品各成分分离良好,理论板数按朝藿定C色谱峰计算不低于2 000。
2.2 线性关系
制备浓度分别为20 μg·mL-1、40 μg·mL-1、60 μg·mL-1、80 μg·mL-1、100 μg·mL-1的标准溶液,在色谱条件下进样测定。以标准溶液浓度(c, μg·mL-1)为横坐标、峰面积(A)为纵坐标绘制标准曲线,拟合得到淫羊藿苷标准曲线方程为A=14296c-46141,R=0.9994,线性范围0.02~0.1 mg·mL-1;朝藿定C标准曲线方程为A=11355c-17916,R=0.9993,线性范围0.02~0.1 mg·mL-1。
2.3 精密度实验
按1∶1配制50 μg·mL-1的混合标准溶液,在色谱条件下连续进样6次,测定峰面积,计算得到淫羊藿苷和朝藿定C峰面积的RSD值分别为1.74%、1.77%。表明,仪器精密度良好。
2.4 重现性实验
取同一批次的巫山淫羊藿提取物,按1.2.3.2方法制备供试溶液,平行制备6份,在色谱条件下进样,测定峰面积,计算得到淫羊藿苷和朝藿定C峰面积的RSD值分别为1.35%、1.65%。表明,该方法重现性良好。
2.5 稳定性实验
取同一份供试溶液,在室温、色谱条件下进样,分别于0 h、2 h、4 h、8 h、12 h、24 h测定峰面积,计算得到淫羊藿苷和朝藿定C峰面积的RSD值分别为1.71%、1.24%。表明,供试溶液在24 h内稳定。
2.6 加标回收率实验
取已知含量的巫山淫羊藿提取物6份,分别加入一定量的淫羊藿苷标准品和朝藿定C标准品,制备供试溶液,在色谱条件下进样测定,计算加标回收率及RSD值,结果见表1。

表1 加标回收率实验结果
由表1可知,淫羊藿苷和朝藿定C的加标回收率的RSD值分别为1.09%、2.19%。表明该方法的准确度较好,可用于淫羊藿苷和朝藿定C的含量测定。
2.7 样品测定
分别称取巫山淫羊藿提取物、α-淀粉酶酶解纯化物、果胶酶酶解纯化物、纤维素酶酶解纯化物,按1.2.3.2方法制备供试溶液,在色谱条件下进样测定,依据标准曲线方程计算淫羊藿苷和朝藿定C的含量,结果见表2。

表2 巫山淫羊藿提取物及其酶解纯化物中淫羊藿苷和朝藿定C的含量/%
由表2可知,巫山淫羊藿提取物在经过酶解和大孔树脂纯化后,淫羊藿苷和朝藿定C的含量均明显增加,其中果胶酶对两者含量的影响最大,巫山淫羊藿提取物在经过果胶酶酶解和大孔树脂纯化后,淫羊藿苷含量为11.65%,朝藿定C含量为31.79%。
2.8 抑菌活性
巫山淫羊藿提取物、巫山淫羊藿纯化物、果胶酶酶解物、果胶酶酶解纯化物对金黄色葡萄球菌和大肠杆菌的抑菌实验结果如图2所示。

(a)金黄色葡萄球菌 (b)大肠杆菌
由图2可知,巫山淫羊藿提取物、巫山淫羊藿纯化物、果胶酶酶解物、果胶酶酶解纯化物对金黄色葡萄球菌均有一定的抑菌效果,其中巫山淫羊藿提取物的抑菌效果最强(图2a);果胶酶酶解纯化物对大肠杆菌的抑菌效果不明显,巫山淫羊藿提取物、巫山淫羊藿纯化物、果胶酶酶解物对大肠杆菌有一定的抑菌效果(图2b)。总体来看,未酶解的巫山淫羊藿提取物的抑菌活性优于酶解物和纯化物。
3 结论
巫山淫羊藿提取物在经过酶解和大孔树脂纯化后,淫羊藿苷和朝藿定C的含量均明显增加,其中果胶酶对两者含量的影响最大,巫山淫羊藿提取物在经过果胶酶酶解和大孔树脂纯化后,淫羊藿苷含量为11.65%,朝藿定C含量为31.79%。巫山淫羊藿提取物及果胶酶酶解物对金黄色葡萄球菌和大肠杆菌均有较好的抑菌效果,但未酶解的巫山淫羊藿提取物的抑菌活性优于酶解物和纯化物,原因有待进一步深入研究。

