基于靶向代谢组学研究环形泰勒虫对宿主细胞能量代谢的影响
李 霞,李 志,曹天行,殷 宏,3,罗建勋,关贵全,刘军龙,赵洪喜*
(1.宁夏大学农学院,银川 750021;2.中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室/甘肃省动物寄生虫病重点实验室,兰州 730046)
环形泰勒虫(Theileriaannulata)是由硬蜱传播的、能够感染牛科动物引发泰勒虫病的一种血液原虫,其裂殖体感染的宿主细胞可获得类似肿瘤细胞样的无限增殖能力,即细胞的永生化状态[1-2]。抗泰勒虫药物布帕伐醌(BW720c)作用于转化的细胞时,可终止细胞的永生化状态并使细胞重新进入正常的凋亡程序。环形泰勒虫通过劫持宿主信号通路、调节表观遗传因子和转录程序来诱导白细胞的Warburg效应帮助细胞转化,但宿主细胞转化的分子机制仍不清楚。Warburg效应主要与宿主的能量代谢相关。因此,研究BW720c对环形泰勒虫转化细胞能量代谢的影响,对于揭示细胞发生转化的分子机制具有显著意义。能量代谢与生物体的存活息息相关,通过基因组测序发现顶复门寄生虫缺少参与三羧酸循环和β-氧化代途径所需酶的基因序列[3]。因为缺少这些代谢酶,顶复门寄生虫的能量代谢主要来源于糖酵解,在至少10个酶的作用下寄生虫将从宿主获得的己糖催化成丙酮酸。丙酮酸在后续的酶促反应下生成乙酰辅酶A或乳酸,脂肪酸的合成需要乙酰辅酶A作为原料。顶复门寄生虫不但利用宿主细胞的脂肪酸,自身也存在脂肪酸的合成,但是不同种属之间存在差异[4]。除了糖酵解外,顶质体也是顶复门寄生虫能量来源的途径。顶质体是除隐孢子虫外的顶复门寄生虫特有细胞器,参与虫体新陈代谢[5]。目前的研究证明,顶质体是合成代谢的中枢,参与3条重要代谢途径:2C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径、脂肪酸从头合成途径(FAS2)和血红素合成途径[7]。在疟原虫的研究中发现,膦胺霉素靶向MEP途径的1-脱氧-D-木酮糖-5-磷酸还原异构酶(DXR)可使疟原虫死亡[6]。在刚地弓形虫中,顶质体存在磷酸甘油酸酯变位酶(PGAM)、丙酮酸脱氢酶复合体[7]。在刚地弓形虫入侵宿主时,其能量获得依赖于糖酵解过程并且葡萄糖异生和糖酵解过程中PGAM是重要的催化酶,该酶也在弓形虫能量代谢中参与碳水化合物转运、新陈代谢调节[8]。靶向代谢组学通过对小分子代谢物的绝对定量,直观反映药物处理后细胞的能量代谢,有利于鉴定特征性代谢物,判断感染细胞在药物处理下的代谢状态,阐明转化发生的机制。本研究拟从靶向代谢组学的角度出发,以环形泰勒虫感染细胞为模型,研究转化细胞在BW720c处理下的代谢产物的变化,寻找环形泰勒虫与宿主细胞相互作用的分子及其能量代谢变化,阐明环形泰勒虫引起宿主细胞转化的机制,为预防环形泰勒虫感染提供理论基础。
1 材料与方法
1.1 试验材料与试剂
1.1.1 试验材料 第17代环形泰勒虫裂殖体感染的牛淋巴细胞系(由中国农业科学院兰州兽医研究所平台-TDRC-22资助提供)。
1.1.2 主要试剂 BW720c和DMSO由中国农业科学院兰州兽医研究所提供。rI1640(Biological Industries)、硫酸庆大霉素注射液(8万单位)、dimethyl sulfoxide(SIGMA)、Phosphate Buffered Saline(Biological Industries)、Foetal Bovine Serum(Biological Industries)、甲醇(Merck)、乙醇(Merck)、乙腈(Merck)、蒸馏水、牛谷氨酰胺(Gln)定量检测试剂盒、乳酸(LA)含量检测试剂盒及丙酮酸(PA)含量检测试剂盒,均购自河南宝格生物技术有限公司。
1.1.3 主要仪器 细胞培养箱(Thermo)、湘仪离心机(Xiangyi Yi Centrifuge Instrument Co.,Ltd)、高速离心机(Eppendorf)、-80 ℃冰箱、可调式移液器、烘箱、酶标仪、Countstar自动细胞计数仪(上海睿钰生物科技有限公司)。
1.2 试验方法
1.2.1 转化细胞系的复苏和培养 将第17代环形泰勒虫感染淋巴细胞放入37 ℃水中,1 000 r·min-1离心5 min。沉淀转入10%胎牛血清、16 ng·μL-1庆大霉素的RPMI1640培养瓶,置于37 ℃含5% CO2的培养箱中培养。
1.2.2 BW720c作用细胞生长曲线的绘制及细胞处理[9-10]将培养好的转化细胞设为DMSO对照组、处理组及空白对照组。细胞浓度设为1×105cells·mL-1,处理组加入DMSO配制的200 ng·mL-1的BW720c;在DMSO对照组中加入相同体积的DMSO;空白对照组加入相同体积的RPMI1640完全培养基。细胞放回培养箱中继续培养,在12、24、36、48、60、72 h收集细胞,利用CountStar IC 1000软件计算各个时间点的活细胞数,绘制细胞的生长曲线。在72 h收集DMSO对照组与药物组细胞样品,每组均有6个生物学重复。收集细胞之前进行细胞计数,保证细胞数量在1×107个细胞左右(数量相差控制在±2倍内)。从培养瓶中取出细胞悬液,装入50 mL离心管;1 200 r·min-14 ℃离心5 min,去除上清;向细胞沉淀中加入1 mL PBS洗涤去除残余培养液成分,混匀后转入1.5 mL离心管,900 r·min-14 ℃离心3 min,离心后去除上清,重复3遍;将细胞沉淀立即放入液氮中浸泡,淬灭24 h后转入-80 ℃冰箱保存备用。代谢组学检测:-80 ℃冰箱中取出细胞样本,冰上解冻后加入500 μL预冷的提取剂(80%的甲醇水溶液,含内标),涡旋2 min;放入液氮中速冻5 min,冰上解冻5 min,涡旋2 min混匀,循环3次;12 000 r·min-14 ℃离心20 min;取上清液进行LC-MS/MS分析。
1.2.3 代谢物分析 利用软件Analyst 1.6.3处理质谱数据,通过三重四极杆筛选特征离子得到离子信号强度(CPS),MuLtiQuant软件进行积分和校正,area代表物质相对含量。
1.2.4 多元统计分析及差异代谢物筛选及验证 将归一化后的数据矩阵导入R软件(https://www.r-project.org/),先采用无监督的主成分分析(principal component analysis,PCA)然后采用有监督的正交偏最小二乘判别分析使组间区分最大化,寻找差异代谢物。选取fold change≥2和fold change≤0.5,VIP≥1的代谢物为差异代谢物。
1.2.5 部分差异代谢物的验证 应用购自河南宝格生物技术有限公司的试剂盒进行代谢物检测。首先制备试剂盒的标准品,根据各个标准品浓度和吸光度制备标准曲线,并将细胞含量调到1×106个,后按照试剂盒操作步骤测量吸光度,根据标准曲线方式计算相应的含量。并用PraghPad Prism 8软件绘制标准曲线及含量。
2 结 果
2.1 BW720c处理后细胞生长曲线的绘制
CountStar IC 1000软件计算活细胞数获得转化细胞生长曲线(图1);发现,试验组与对照组相比,24 h内细胞数没有明显差异,36 h以后试验组的细胞生长速度明显低于对照组,72 h组间的差异最大。表明BW720c对转化细胞的增殖有显著抑制,这为后续能量代谢检测提供了依据。
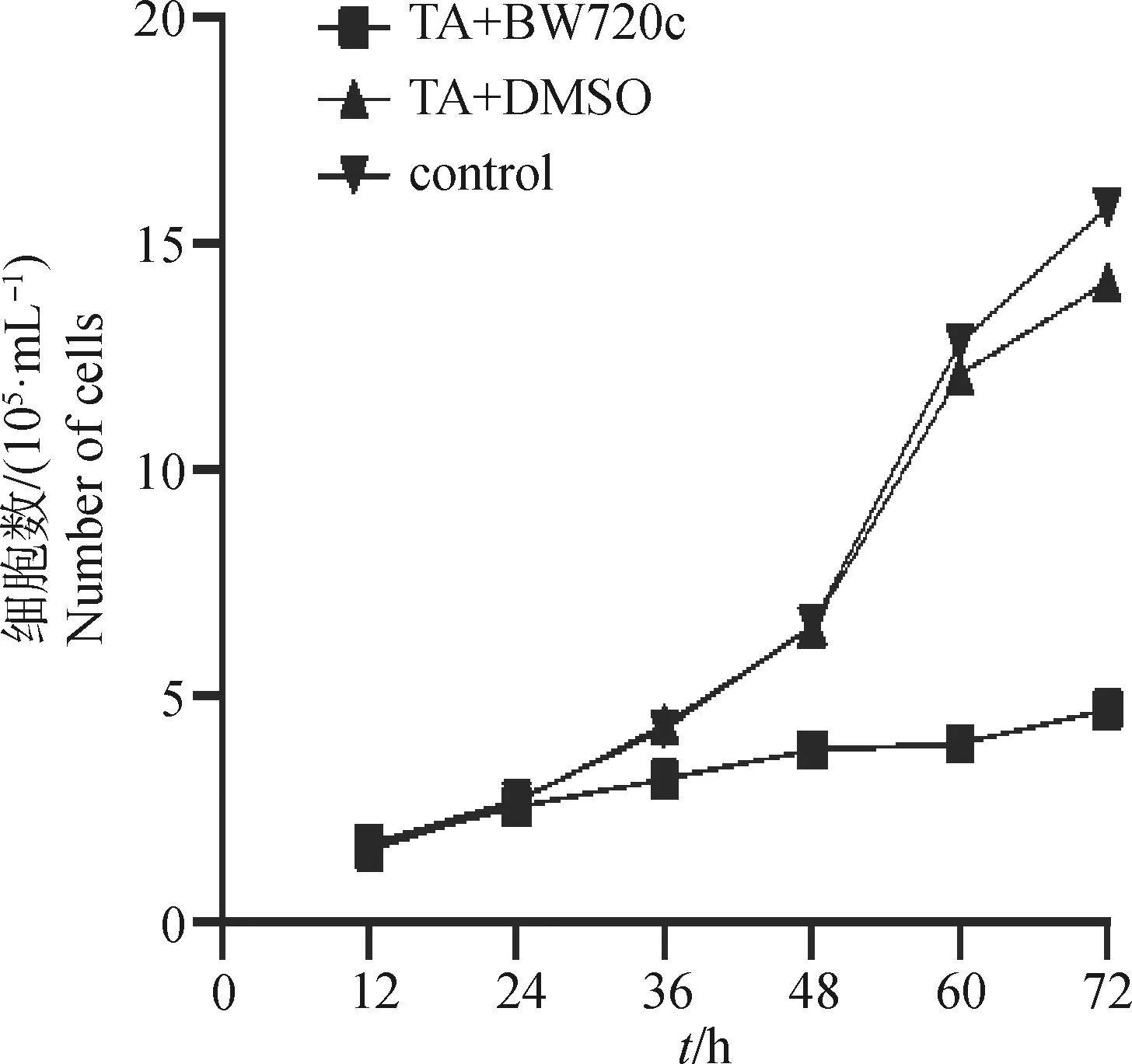
图1 BW720c作用后环形泰勒虫(TA)转化细胞生长曲线Fig.1 Growth curve of T. annulta (TA)transformed cells treated with BW720c
2.2 代谢物总离子图分析与代谢物鉴定
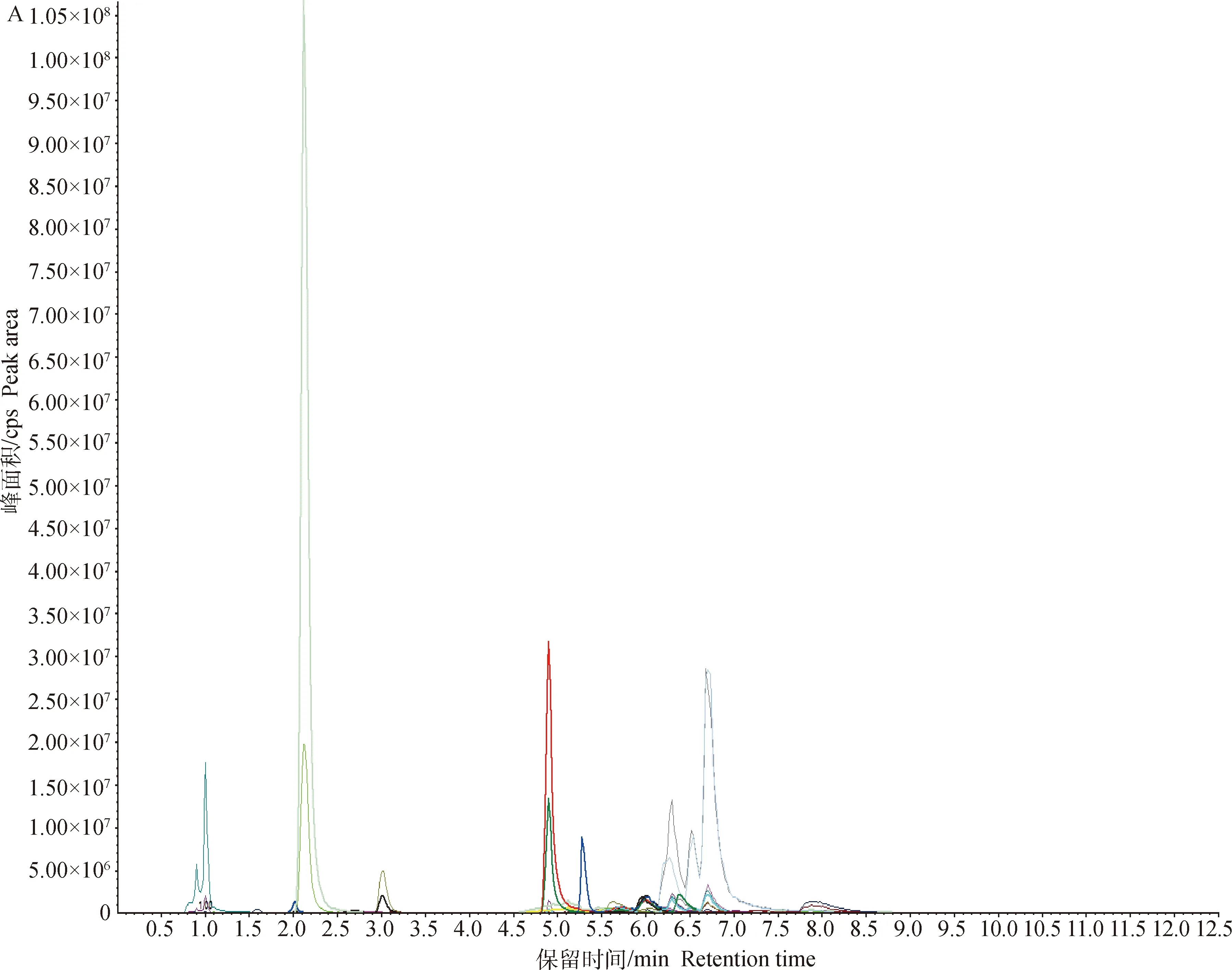
对两组细胞样品的总离子流图(TIC图)进行可视化检查(图2),样品仪器分析信号强、峰容积大且保留时间重复性好。将检测到的质谱结果与MWDB(metware database)对比,共鉴定出49种代谢物。为了进一步筛选2组间的差异代谢物,采用多元统计方法获得能量代谢的特征性代谢物。
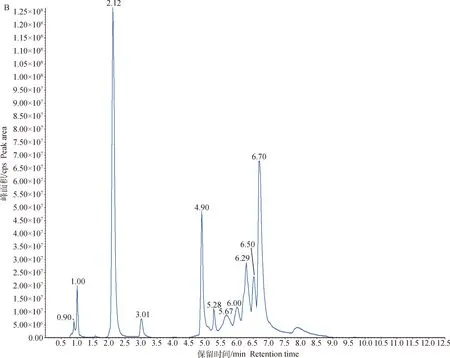
A.MRM代谢物检测多峰图;B.混样样品质谱分析总离子流图A.MRM metabolite detection multi-peak diagram;B.Total ion flow diagram of mixed sample quality spectrum analysis图2 基于MRM分析获得的细胞总离子流图Fig.2 A total ion chromatograms(TIC)of cells analyzed by MRM
2.3 多元统计分析
2.3.1 PCA分析 本研究通过对2种细胞样品进行PCA分析,获得拟合较好的PCA模型。两个主成分占总方差的80.79%,其中第一主成分(PC1)的解释率为61.91%;第二主成分(PC2)的解释率为18.88%。控制组细胞(Tacon)6个样品均在第一主成分原点的左侧,处理组细胞(BW720c)6个样品在第一主成分原点的右侧,说明2种细胞样品在能量代谢方面的代谢物组成上有明显差异(图3)。
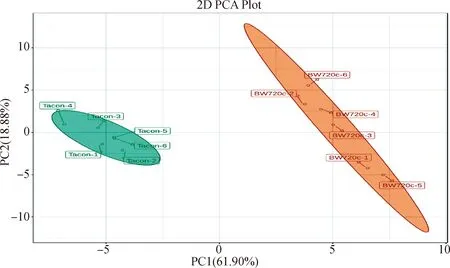
Tacon.控制组;BW720c.药物处理组;PC1.第一主成分;PC2.第一主成分;百分比表示所占的解释率Tacon.Control group;BW720c.Treatment group;PC1.The first principal component;PC2.The second principal component;Percentage represents explained rate图3 2组样品PCA得分Fig.3 PCA score plot of the two groups
2.3.2 OPLS-DA分析 为了消除不相关的噪音信息,建立了OPLS-DA模型进一步分析空白对照组与处理细胞代谢模式的变化。OPLS-DA模型中BW720c组主要分布在原点的左边部分,Tacon组分布在原点的右侧部分,2组样品在坐标轴上离散度较好(图4)。
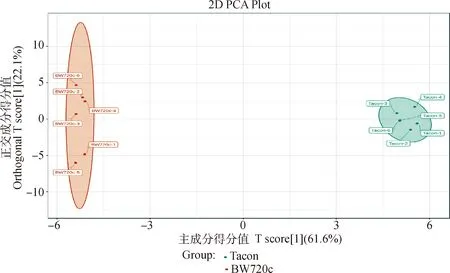
图4 2组样品OPLS-DA得分图Fig.4 OPLS-DA scores plot for two groups
置换检验结果发现(图5),OPLS-DA模型有两个主成分,其中R2X=0.837,R2Y=0.998,Q2=0.994,R2X表示变量X的总变异,目的是为了分析模型的优化程度;R2Y和Q2分别表示模型的解释率和预测的准确度,值越是接近1表明该模型越理想,对样本具有很好的解释率和预测率。参数>0.5显示模型拟合较好,Q2和R2Y的P值均<0.005,表明置换检验(permutation test)中没有随机分组模型强于此次模型,因此本研究建立的OPLS-DA模型可以说明对照组与处理组之间差异变化。
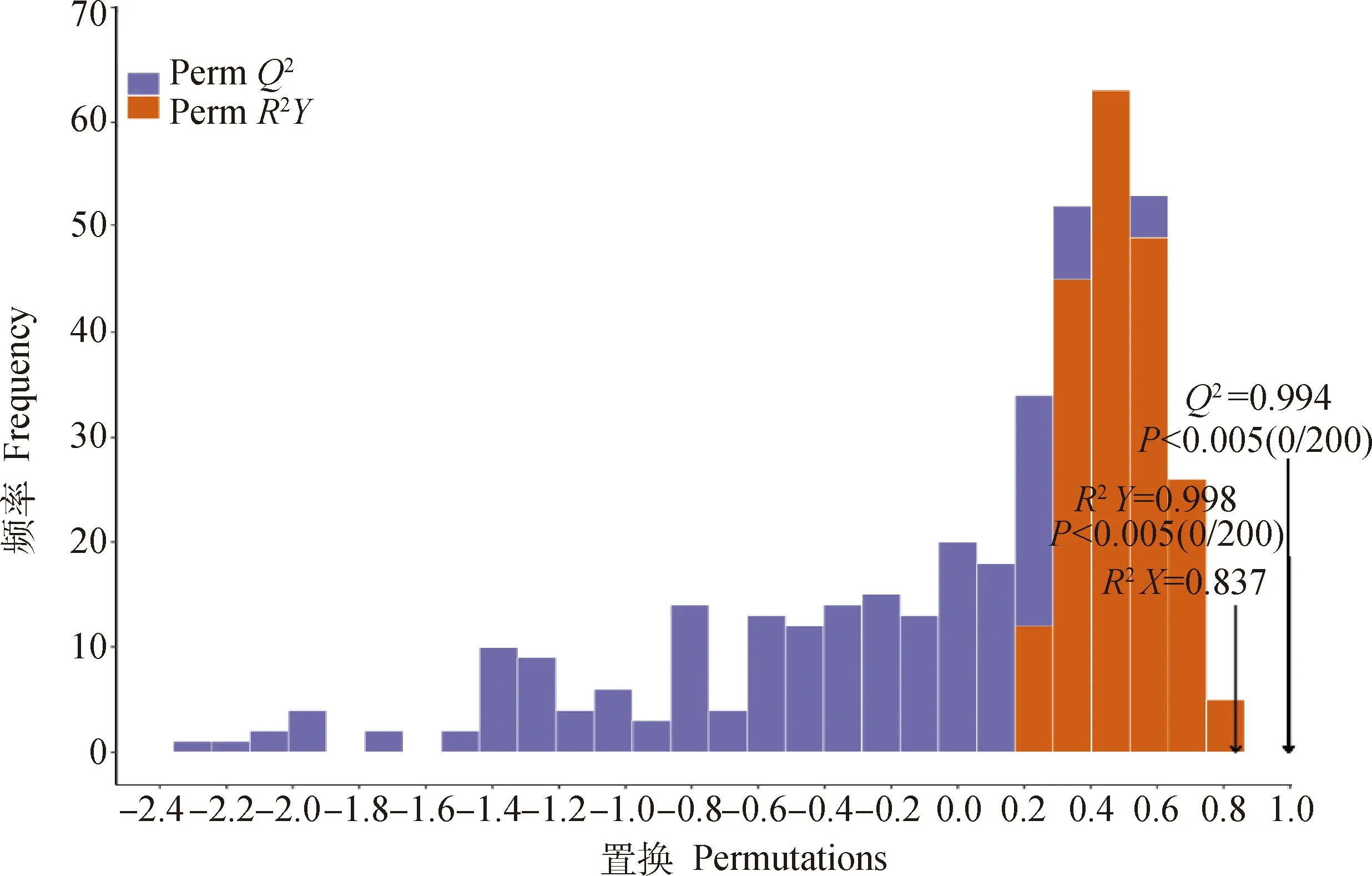
图5 2组样品的OPLS-DA验证Fig.5 Permutation test of OPLS-DA model for two groups
2.3.3 差异代谢物筛选 以“1.2.4”的标准筛选差异代谢物。2组样品共筛出21种差异代谢物(表1),选出的差异代谢物即是组间分离的标志变量。处理组与对照组相比,有13个差异代谢物下调,8个上调(图6)。主要包括氨基酸、核苷酸、有机酸以及酶类等能量代谢物质。BW720c处理可降低感染细胞L-乳酸、果糖1,6二磷酸、丙酮酸、异柠檬酸、乙酰辅酶A等成分的含量,并上调L-丝氨酸、L-天冬酰胺、谷氨酰胺、IMP、L-天冬氨酸等。糖酵解及三羧酸循环相关的差异代谢物见图7。
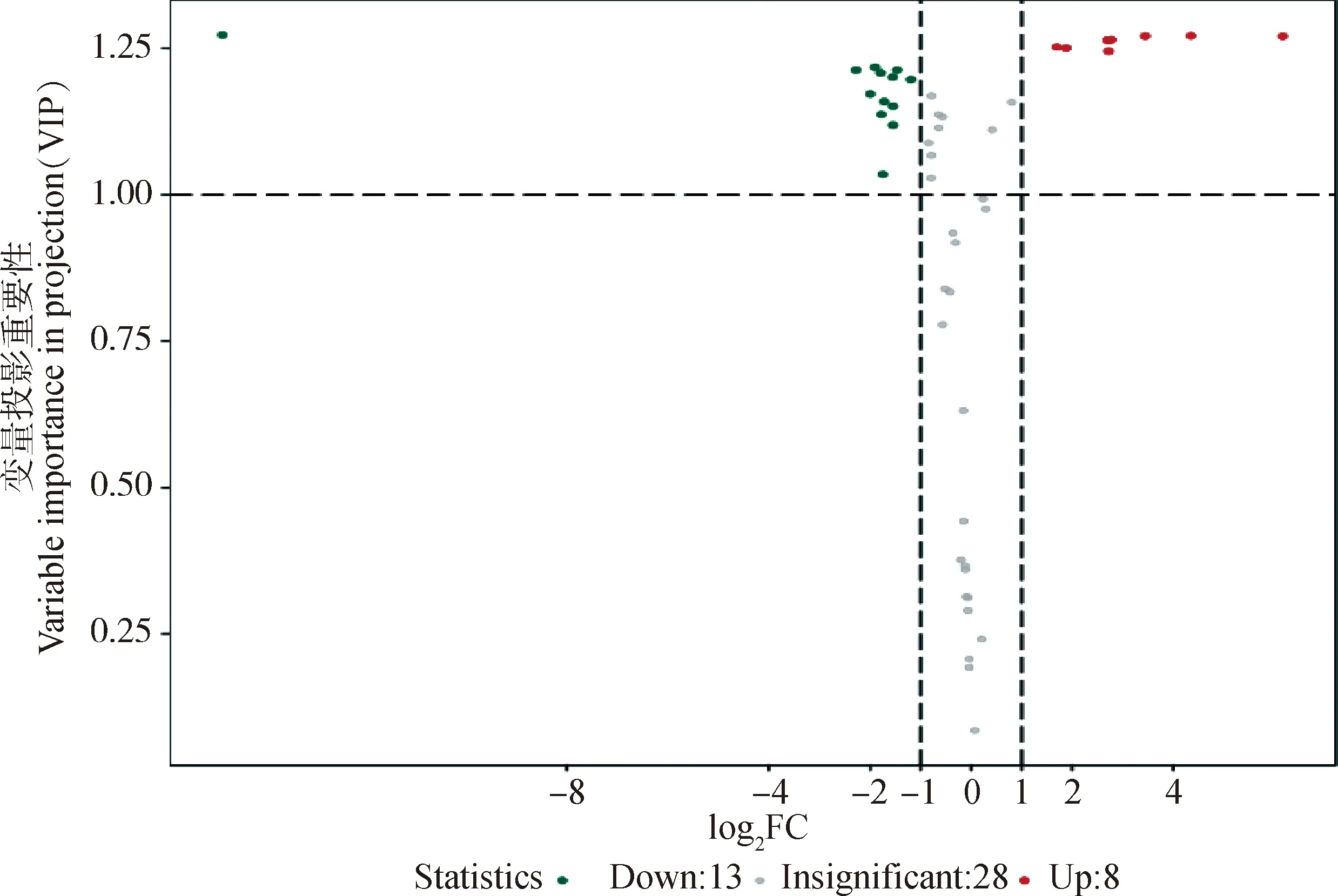
Down.下调的代谢物;Up.上调的代谢物;Insignificant.没有变化的代谢物Down.Down-regulated metabolites;Up:Up-regulated metabolites;Insignificant.Metabolites without change图6 差异代谢物火山图Fig.6 Volcano map of differential metabolites
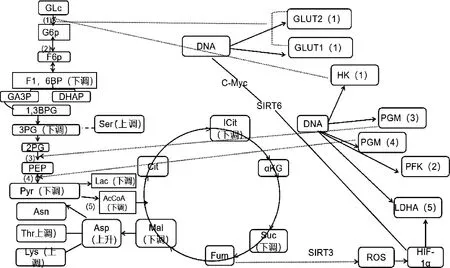
1)己糖激酶或葡萄糖激酶;2)磷酸果糖激酶;3)磷酸甘油酸变位酶;4)丙酮酸激酶;5)丙酮酸脱氢酶系1)Hexokinase/glucokinase;2)Phosphofructokinase;3)Phosphoglyceromutase:4)Pyruvate kinase:5)Pyruvate dehydrogenase complex图7 糖酵解及三羧酸循环的差异代谢物Fig.7 Differential metabolites in glycolysis and tricarboxylic acid cycle
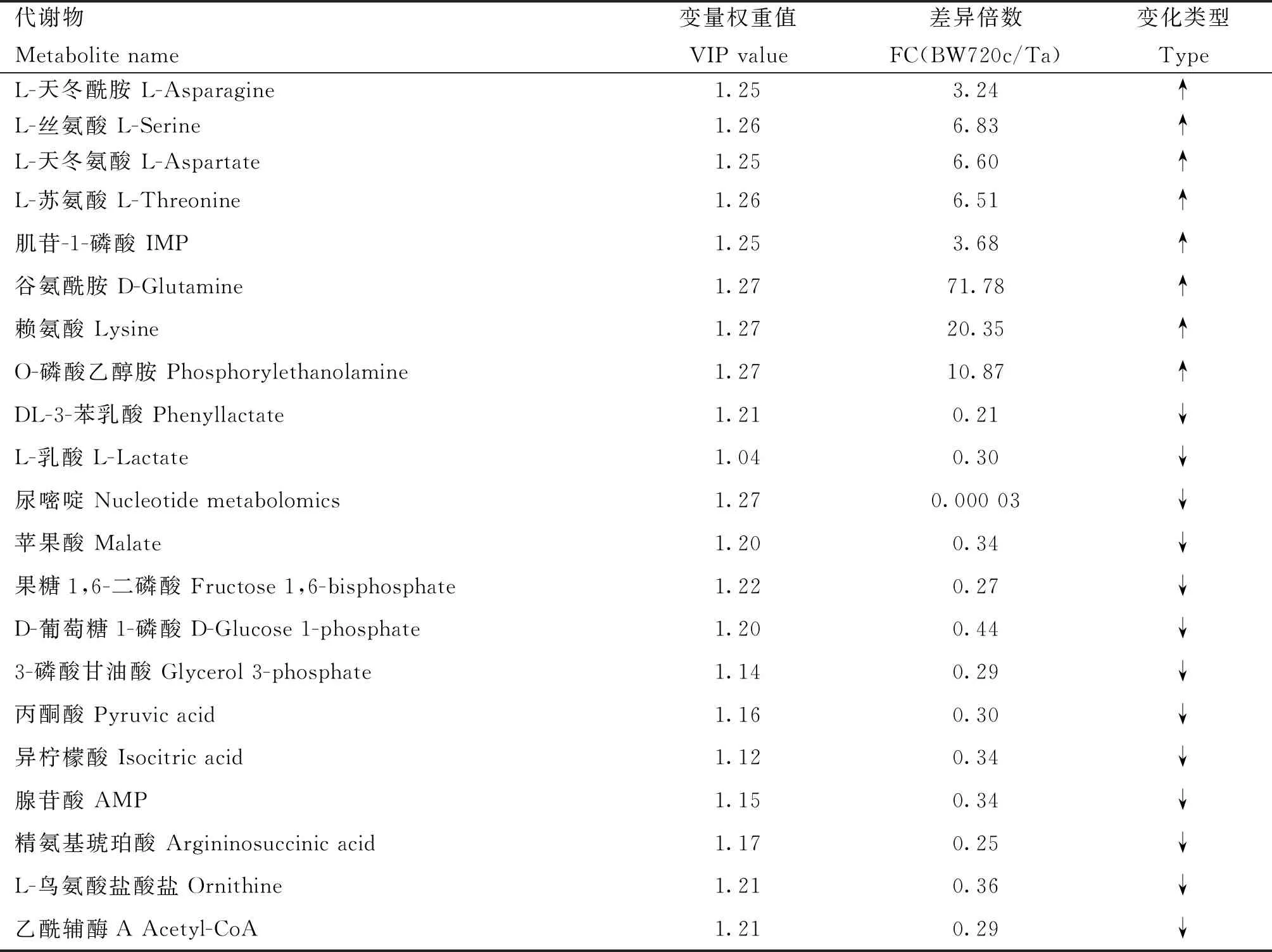
表1 Tacon与BW720c组间的差异代谢物Table 1 Differential metabolites between Tacon group and BW720c group
2.3.4 部分差异代谢物的验证 对筛选到的谷氨酰胺、丙酮酸及乳酸进行验证。首先收集药物处理组细胞及对照组细胞,细胞的含量要达到1×106cells·mL-1。收集的细胞用预冷的PBS洗涤3次,然后分别按照试剂盒说明书进行代谢物的含量测定。依据检测时的标准品浓度及吸光度值(OD),用Graphad Prim 8软件,采用四参数Logistic曲线拟合(4-p1)绘制标准曲线方程(图8)。然后根据各自的标准曲线计算对照组、药物处理组细胞中谷氨酰胺、丙酮酸、乳酸的含量。谷氨酰胺的标准曲线方程为Y=691.0X-192.3,相关系数R2为0.999 5;丙酮酸的标准曲线为Y=0.019 60X+0.020 10,相关系数为R2为0.999 8;乳酸的标准曲线为Y=0.331 9X+0.014 41,相关系数为0.997 2。所建标准曲线的相关系数均大于0.99,表明线性关系良好。根据标准曲线及试剂盒的含量计算公式可知每1×104个处理组细胞的谷氨酰胺含量为66.85 μmol·L-1,对照组中的含量为4.36 μmol·L-1;每1×106个处理组细胞的乳酸含量为0.4 μmol·mL-1,对照组中的含量为1.2 μmol·mL-1;处理组细胞的丙酮酸含量为44 μg·104cells-1,对照组的丙酮酸含量为74 μg·104cells-1。验证的代谢物含量处理组与对照细组的变化趋势与靶向代谢组学检测是一致的。
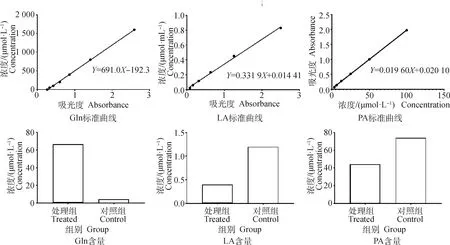
图8 差异代谢物含量及标准曲线Fig.8 Differential metabolites content and standard curve
3 讨 论
3.1 BW720c处理对感染细胞氨基酸代谢的影响
环形泰勒虫感染可造成细胞的无限增殖,代谢重编程是其重要特征。肿瘤细胞发生代谢重编程是细胞无限增殖和侵袭的先决条件[11]。代谢重编程可满足细胞异常增殖和高能量需求。甘氨酸、丝氨酸和苏氨酸代谢以及天冬氨酸和谷氨酸代谢通路在感染细胞中是异常的,药物处理组(BW720c)L-丝氨酸、L-天冬氨酸、L-天冬酰胺、谷氨酰胺及赖氨酸是上调的。谷氨酰胺与葡萄糖都是癌细胞使用的主要营养物质[12],谷氨酰胺作为氮供体是核苷酸生物合成所必需的。此外谷氨酰胺作为碳源支持癌细胞能量代谢,一旦缺乏会造成癌细胞的死亡,在各类癌症中均观察到此现象[13,16]。环形泰勒虫感染细胞的代谢模式类似于肿瘤细胞,根据代谢组数据分析结果,环形泰勒虫转化细胞也是以谷氨酰胺作为能量来源的,转化细胞的代谢重编程实现了对谷氨酰胺的有效利用。谷氨酰胺酶是癌症治疗的有效靶点[17-18],谷氨酰胺酶将谷氨酰胺转化为谷氨酸,谷氨酸进一步转变为α-酮戊二酸进入三羧酸循环,在药物处理后三羧酸循环受到抑制谷氨酰胺消耗减少,相对于对照组(Tacon)其含量上升,因此怀疑BW720c的有效靶点之一是谷氨酰胺酶。并用谷氨酰胺试剂盒检测时也发现在药物处理组中谷氨酰胺也是上调的,因此也验证了把谷氨酰胺酶作为进一步的研究对象的猜想。Zhang等[19]发现胶质母细胞瘤中天冬酰胺的生成途径可以挽救谷氨酰胺缺乏下的细胞生存。天冬酰胺在药物处理之后上调,也说明感染细胞中天冬酰胺可能因谷氨酰胺减少而加速自身合成速度来挽救细胞凋亡。癌细胞中的谷氨酰胺还可以维持氧化还原状态,调控糖脂代谢。谷氨酰胺通过谷氨酰胺转运体进入细胞内,LAT2是溶质载体家族成员,Feng等[20]发现,LAT2能调节谷氨酰胺依赖的回补调节,因此说明LAT2参与转化细胞的能量代谢,可以作为研究转化机制的新靶点。
3.2 BW720c处理对感染细胞糖酵解代谢的影响
Warburg[21]指出肿瘤细胞的能量代谢来源是糖酵解,糖酵解产生大量的乳酸。糖酵解途径的异常活跃使得葡萄糖代谢改变以及利用率增加,与正常细胞相比,有氧条件下肿瘤细胞的糖酵解途径可提供的ATP占总量的50%~60%[22]。核酸、脂质及蛋白质的合成与葡萄糖代谢有关,葡萄糖的摄取依靠细胞膜葡萄糖转运蛋白。Duan等[23]研究表明,葡萄糖向天冬氨酸转化是肿瘤生长的限制性代谢途径。天冬氨酸是线粒体呼吸的关键产物,葡萄糖转运蛋白的失活或抑制可阻止天冬氨酸的产生。在药物处理组中天冬氨酸是上调的,推测环形泰勒虫感染细胞可能有额外的调控机制控制天冬氨酸的生成,如果BW720c的作用也是抑制葡萄糖转运蛋白或使其失活,那么天冬氨酸在药物处理组中应该是下调的,而不是上升,这与研究结果不相符合。糖酵解途径的最后一步磷酸烯醇式丙酮酸在丙酮酸激酶的催化下生成丙酮酸,Marsolier等[24]研究发现,环形泰勒虫分泌的Pin1异构酶可以稳定宿主的2型丙酮酸激酶(PKM2),使宿主细胞代谢重编程。PKM2在哺乳动物中高度保守,与细胞合成代谢相关,在肿瘤细胞中有表达[25],表达PKM2的肿瘤细胞在组织培养和作为异种移植物在小鼠中具备更快的增殖速度[26]。本研究中,丙酮酸与乳酸是下调的,而磷酸烯醇式丙酮酸没有变化,因此推测PKM2的活性被抑制,这也与Marsolier的研究结果一致。在用试剂盒验证时发现在药物处理组中丙酮酸也是下调的,但是Pin1异构酶怎样引起宿主细胞代谢通路改变尚不清楚。Luo等[27]发现PKM2通过结合癌细胞和活化的巨噬细胞中的HIF-1α转录因子,从而反式激活基因表达。HIF-1α、PKM2及脯氨酰羟化酶结构域3(PHD3)结合可以使PKM2正向调节葡萄糖转运蛋白1(GLUT1)、PHD3和LDHA等HIF-1α的靶基因表达。Metheni等[28]提出HIF-1α诱导促进了泰勒虫转化细胞的致瘤特性。本研究中如果GLUT1活性抑制,药物处理细胞对葡萄糖的利用率降低,转化细胞失去能量来源细胞凋亡。宿主细胞中PKM2的变化仍然不清楚,上下游通路中分子机制也不清楚,还有待进一步的研究来阐明作用机制。
3.3 BW720c处理对感染细胞三羧酸代谢的影响
Warburg[21]认为肿瘤细胞从线粒体呼吸到有氧糖酵解的改变,可能是线粒体受损的结果。然而,Weinhouse[29]通过同位素标记发现线粒体氧化磷酸化产生的二氧化碳的数量在癌细胞中与正常细胞的一样,现在人们也发现Warburg效应伴随葡萄糖转化为乳酸含量增加碳进入三羧酸循环速度减慢。本研究中,药物处理组三羧酸循环中的苹果酸、异柠檬酸和延胡索酸是下调的,但这些代谢物是在药物作用下通过何种途径下调,机制还不清楚。SIRT3参与线粒体参与氧化应激与能量代谢并调节癌症发病过程,通过调节线粒体稳态防止细胞转化和细胞衰老[30]。在各种恶性肿瘤中SIRT3是低表达的,其作为肿瘤抑制基因发挥作用。延胡索酸可参与SIRT3对HIF-1α信号通路的调节。因此,作者推测BW720c与隐丹参酮一样使SIRT3的表达降低。在药物处理转化细胞中低表达量的延胡索酸影响SIRT3的表达量,最终使HIF-1α信号通路抑制,但是延胡索酸与SIRT3是如何协调发挥作用的还有待进一步研究。冯俭等[31]也报道了丹参能增加缺氧细胞的氧分压从而抑制HIF-1α表达以阻止肿瘤血管生成和肿瘤细胞的增殖,因此,可以设计靶向SIRT3的分子,探索转化发生机制。
4 结 论
环形泰勒虫转化细胞在BW720C药物处理下代谢状态发生显著变化,基于LC-MS/MS代谢组学方法可以全面地筛选出药物处理后影响转化的差异代谢;通过分析这些差异代谢物的代谢途径,可以初步分析转化发生的机制,同时也为人类癌症的治疗提供新方法。

