海兰褐蛋鸡ZP3基因结构及其在卵泡中表达规律分析
朱帅鹏,王东雪,刘 聪,孙君卫,杜振伟,孙桂荣,李文婷
(河南农业大学动物科技学院,郑州 450046)
卵透明带蛋白(ZP)是围绕在卵子周围的一层糖蛋白基质[1],其结构与功能是以几种蛋白之间相互作用为基础[2]。ZP糖蛋白最早是在初级卵泡中合成[3],被转化酶处理之后分泌到细胞外[4],在细胞外ZP蛋白受到水解酶切割形成单体(ZP1、ZP2、ZP3和ZP4),其中ZP3是精子的最初受体[5-6],它对卵子的生成、精卵结合以及早期胚胎发育都具有重要的作用[7]。ZP3与精子蛋白受体结合引发顶体反应[8],促进精卵结合从而完成受精[9],除此之外ZP3还参与阻止多精入卵,有助于子宫内受精卵的贴附[10]。
ZP3可以与ZP1、ZP2、ZP4分别结合形成3种二聚体[11],构成ZP蛋白的结构框架,缺乏ZP1蛋白的卵母细胞不能形成正常的ZP组织[12],缺乏ZP3的雌性小鼠不能形成ZP蛋白[13],ZP3的突变会使其与ZP2之间作用机制受到影响,会导致女性空卵泡综合征[14]进而引起人类不育[15],同时有研究证实,ZP3变异与绵羊[16]、猪等的产羔数、产仔数显著相关。在小鼠中敲除ZP3后不能形成卵透明带蛋白[17],研究者们因此认为,ZP3蛋白可能是免疫不育的潜在靶抗原[18]。
目前有多种动物的ZP3 cDNA序列得到扩增,如褐家鼠、草原兔尾鼠、牦牛、野猪、欧洲兔等。但关于鸡ZP3基因研究较少,因此,本试验通过对海兰褐蛋鸡ZP3全长克隆,对其编码区序列进行分析和功能结构域预测,并和多种不同物种的编码序列进行比对分析构建基因进化树,为鸡ZP3及其功能的研究提供理论依据。通过构建海兰褐蛋鸡ZP3在不同组织、不同发育阶段卵泡以及不同发育阶段的卵泡颗粒细胞和卵泡膜细胞的表达谱,分析ZP3在鸡卵泡发育过程中的表达特征,为ZP3基因在卵泡发育过程中作用的研究提供基础。
1 材料与方法
1.1 试验材料
50周龄(50 W)海兰褐蛋鸡6只,其生长健康状况相似且产蛋率均达到了70%以上。颈部脱臼致死,并取其心、肝、肺、肾、胸肌、腿肌、卵巢组织,收集50 W海兰褐蛋鸡各等级卵泡分离膜细胞和颗粒细胞,提取总RNA之后用于后续试验。
1.2 主要试剂及仪器
氯仿、异丙醇、DEPC水溶液、无水乙醇、RNA提取试剂Trizol、胰蛋白酶(Solarbio),青链霉素混合液(Solarbio),胎牛血清、DMEM高糖培养基(BI),荧光倒置显微镜(Nikon,Japan),反转录试剂盒、RACE试剂盒(TaKaRa),荧光定量试剂(南京诺唯赞生物科技有限公司);4 ℃离心机、细胞培养箱、超微量分光光度计(美国Thermo公司),定量PCR仪(LightCycler96,瑞士Roche公司)等。
1.3 引物设计
使用引物设计软件Oligo7,利用NCBI已知鸡CDS区序列(NM_204389.2)设计引物F0、R0,用扩增得到的序列设计巢式PCR引物F1、R1、F2、R2、F3、R3,设计定量引物F、R,以β-actin作为内参基因,引物均由尚亚生物有限公司合成,引物序列见表1。
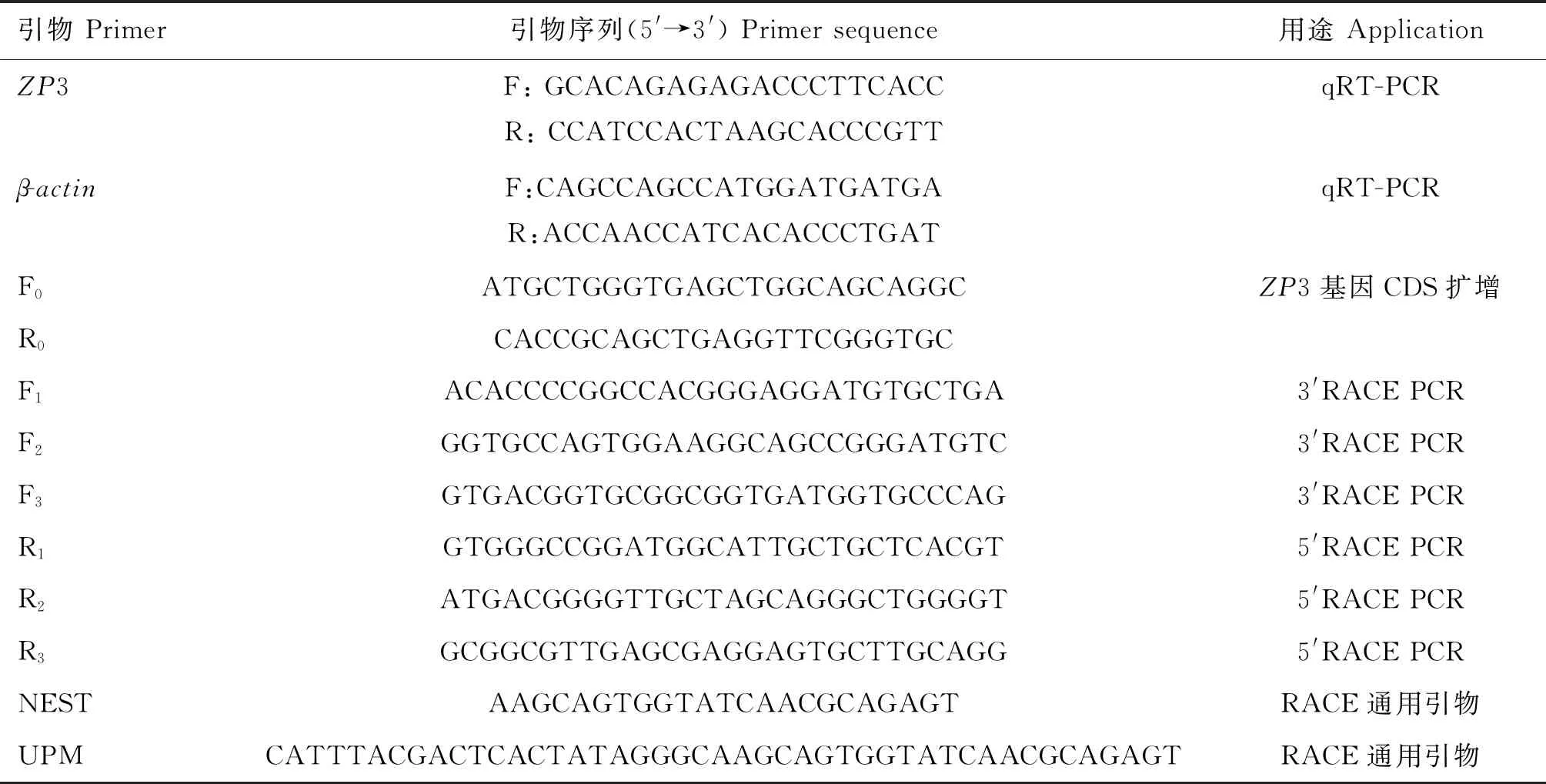
表1 引物序列Table 1 Primer sequences
1.4 ZP3基因全长扩增
利用RACE试剂盒,以卵泡3′和5′ RACE-cDNA为模板,用通用引物UPM分别与F1、R1进行巢式PCR第一轮扩增,以3′ UTR扩增为例,反应体系为50 μL:3′ RACE-cDNA 2.5 μL,10×UPM 5 μL,引物F11 μL,2×Taq Buffer 25 μL,RNase-free ddH2O 16.5 μL。反应程序选择Touchdown程序:第一步95 ℃ 5 min;第二步95 ℃ 30 s,73 ℃ 30 s,72 ℃ 1 min,共20个循环;第三步95 ℃ 30 s,63 ℃ 30 s,72 ℃ 1 min,共20个循环;最后4 ℃保存。将第一轮扩增产物稀释50倍后作为模板,以通用引物NEST和F2、R2分别进行第二轮巢式PCR,反应体系为50 μL:稀释后产物5 μL,引物F21 μL,引物NEST 1 μL,2×Taq Buffer 25 μL,RNase-free ddH2O 18 μL。PCR反应程序:第一步95 ℃ 5 min;第二步95 ℃ 30 s、68 ℃ 30 s、72 ℃ 1 min共20个循环;第三步72 ℃ 10 min;最后4 ℃保存。再将产物稀释50倍后,以引物NEST分别和F3、R3进行第三轮巢式PCR,步骤及反应程序与第二轮巢式PCR一致。将产物进行凝胶电泳分离后,选择单一条带进行切胶回收,连接T载体之后进行测序拼接。
1.5 ZP3基因进化树构建及编码区生物信息学分析
利用MegAlign软件对扩增得到的鸡ZP3的CDS序列及已有的斑马鱼NM_131331.1、狗NM_001003224.1、牛NM_173974.3、人NM_007155.6、鼠M20026.1、兔NM_001195720.1、猪NM_213893.1 ZP3的核酸序列和氨基酸序列分别进行同源性比对,利用MEGA7构建系统进化树。同时利用PSIPRED对ZP3氨基酸序列进行蛋白质二级结构预测,通过SWISS-MODEL在线软件预测海兰褐蛋鸡ZP3蛋白三级结构,使用ProtParam工具对ZP3理化性质进行分析,通过TMHMM对ZP3蛋白进行跨膜区分析,通过SignaiP-5.0 Server工具对ZP3蛋白进行信号肽检测,通过EXPASY网站在线分析ZP3蛋白亲疏水性。
1.6 鸡原代卵泡颗粒细胞和卵泡膜细胞分离培养与激素处理
采用本实验室成熟技术方法[19]分别收集不同等级卵泡:小白卵泡(SWF:1~3.9 mm)、大白卵泡 (LWF:4~4.9 mm)、小黄卵泡(SYF:5~8 mm)和等级卵泡(F6:9~15 mm、F5:16~20 mm、F4:21~25 mm、F3:26~30 mm、F2:31~35 mm、F1:136~40 mm),分离鸡不同等级卵泡颗粒细胞以及膜细胞,接种于培养瓶,待其生长密度达到90%,利用TRIzol消化裂解细胞并提取总RNA进行后续试验。取部分等级卵泡颗粒细胞分为4组,分别添加浓度为5、10、50 ng·mL-1的 FSH,对照组添加等量PBS,处理 24 h,去除培养基,用 PBS 进行冲洗后,加入适量TRIzol裂解提取总RNA。
1.7 总RNA反转录
反转录第一步反应体系:4 μL 4×gDNA wiper Mix,Total RNA 1 pg-1 μg,添加RNase-free ddH2O至总体系16 μL,设置反应程序为:42 ℃ 2 min,4 ℃ 60 min;第二步反应体系:4 μL 5×HiScript Ⅲ qRT SuperMix 加入到上一步产物中,总体系20 μL,设定反应程序为:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 60 min。反应结束后将反转录产物稀释两倍,以便用于后续的实时荧光定量PCR。
1.8 ZP3基因qRT-PCR检测
以不同组织和细胞样品cDNA为模板进行荧光定量PCR,总反应体系为10 μL:SYBR qPCR Master Mix 5 μL,RNase-free ddH2O 3 μL,上、下游引物各0.5 μL,cDNA 1 μL。反应程序为:第一步95 ℃ 5 min;第二步95 ℃ 12 s,60 ℃ 40 s,72 ℃ 30 s,共40个循环,每个待测样本3个生物学重复,2个技术重复。
1.9 统计与分析
采用2-△△Ct法,以β-actin作为内参基因,对ZP3基因进行荧光定量 PCR 分析。采用 SPSS24.0 的独立样本T-test 法检验不同样本表达量的差异显著性。
2 结 果
2.1 鸡ZP3基因的克隆及cDNA全长获得
为分析ZP3结构功能,以鸡卵泡cDNA为模板,用引物F0、R0扩增ZP3 CDS区,得到约1 341 bp 的条带(图1A),通过回收纯化连接T载体进行测序。同时通过RACE试剂盒克隆得到5′ RACE 产物351 bp (图1B),3′ RACE产物228 bp(图1C),条带明亮且单一,说明没有可变剪切体存在,经纯化回收连接T载体测序,拼接得到ZP3全长1 415 bp,其中编码区1 341 bp,5′ UTR 8 bp,3′ UTR 36 bp,该基因起始密码子为ATG,终止密码子为TGA,共编码446个氨基酸,通过Ensembl网站的BLAST/BLAT分析,该基因位于10号染色体,共有9个外显子,长度在90~375 bp之间。
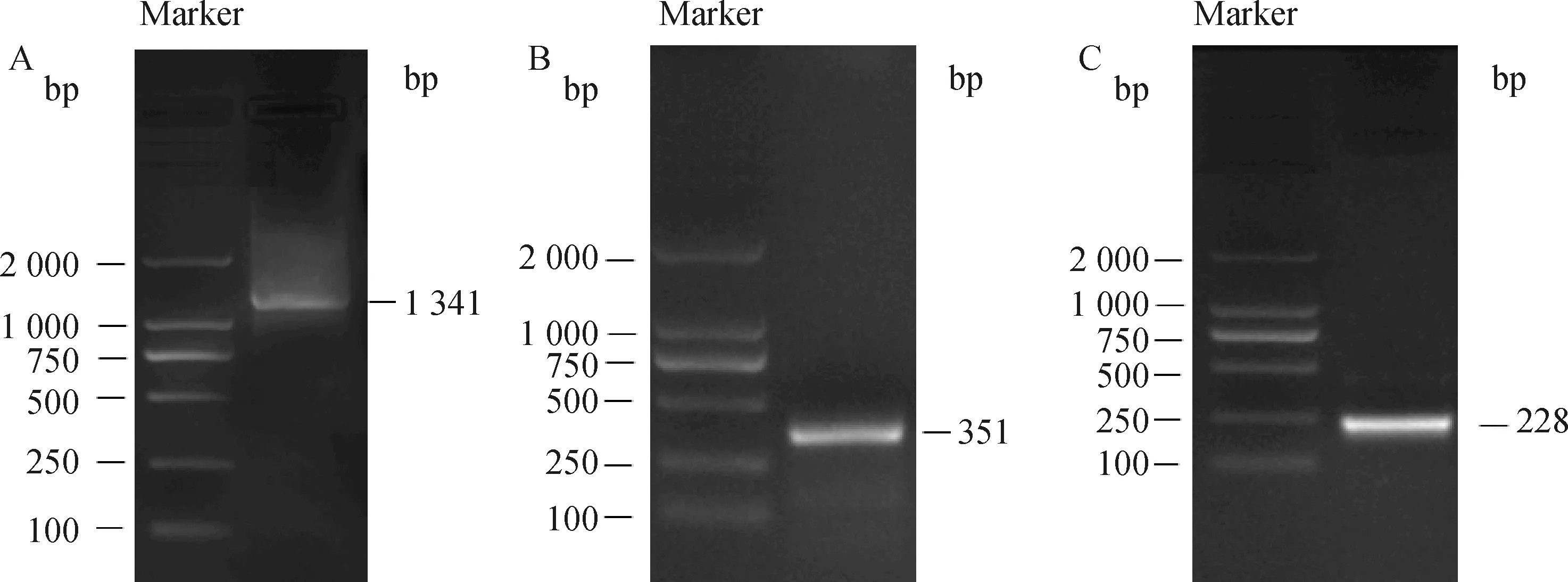
图1 鸡ZP3 基因CDS区(A)、5′ RACE(B)、3′ RACE(C)产物电泳图Fig.1 Electrophoresis diagram of CDS region(A),5′ RACE(B)and 3′RACE(C)products of chicken ZP3 gene
2.2 鸡ZP3基因序列分析
为分析ZP3在不同物种间的同源性,使用MegAlign将扩增得到的鸡ZP3基因CDS序列与斑马鱼、狗、牛、人、鼠、兔、猪等7个不同物种ZP3核酸序列进行同源性比对,同源性分别为:60.8%、60.3%、50.4%、60%、57.6%、58.9%、55.5%,氨基酸序列同源性比对显示同源性分别为:31.4%、47.8%、48.6%、47.9%、45.9%、46.8%、49.5%。使用Mega 7.0 软件构建进化树,结果如图2所示,结果表明,鸡ZP3基因在进化过程中符合物种进化规律,并且通过系统发生树可以得出海兰褐蛋鸡与斑马鱼相距较近,与人和鼠次之,与猪最远。
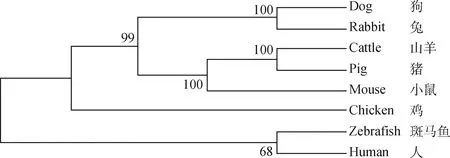
图2 海兰褐蛋鸡ZP3基因进化树Fig.2 ZP3 phylogenetic tree of Hailan brown laying hens
2.3 鸡ZP3蛋白结构功能分析
为研究海兰褐蛋鸡ZP3蛋白质理化性质,使用ProtParam工具对ZP3蛋白理化性质进行分析,结果表明,该基因共编码446个氨基酸,负电荷残基总数45个,正电荷残基总数为38个,其中丙氨酸所占比例最大(11.4%),缬氨酸次之(10.3%),甲硫氨酸含量最低(1.1%),总原子数为6 623,分子式为C2079H3284N608O631S21,体外蛋白半衰期为30 h,不稳定系数为44.91,将其归类为不稳定蛋白,相对分子质量为47 565.90,理论PI为5.83。通过PSIPRED在线分析ZP3蛋白二级结构,结果显示,该蛋白主要由257个氨基酸残基组成的无规则卷曲形成,占整个二级结构的57.62%,是二级结构的主要构成部分;由137个氨基酸构成延伸部分,占整体的30.72%,由52个氨基酸组成α-螺旋并占据整个结构的11.65%,通过SWISS-MODEL在线软件预测海兰褐蛋鸡ZP3蛋白三级结构(图3A),发现无规则卷曲占据主要成分,与二级结构分析结果相符合。通过TMHMM和SIGNAIP-5.0 SERVERZP3对ZP3蛋白进行跨膜结构和信号肽分析,结果表明ZP3蛋白存在一个跨膜区(图3B),同时信号肽分析表明存在一个信号区域(图3C),表明该蛋白可以进行信息传导,预测该蛋白可能具有信号传递的作用,通过蛋白质亲水性工具(Protein GRAVY)对其亲水性总值进行计算,得到结果为0.002,表示该蛋白为弱的疏水性蛋白质。
2.4 海兰褐蛋鸡不同组织中ZP3基因的表达分析
为研究ZP3基因在50 W海兰褐蛋鸡不同组织中的表达情况,采用qRT-PCR 的方法,以β-actin作为内参基因,结果如图4所示,ZP3在心、肝、肺、肾、卵巢、胸肌、腿肌等组织中均有表达,在卵巢中的相对表达量最高,且显著高于其它组织(P<0.05),表示ZP3基因可能在卵巢中发挥重要生理作用。
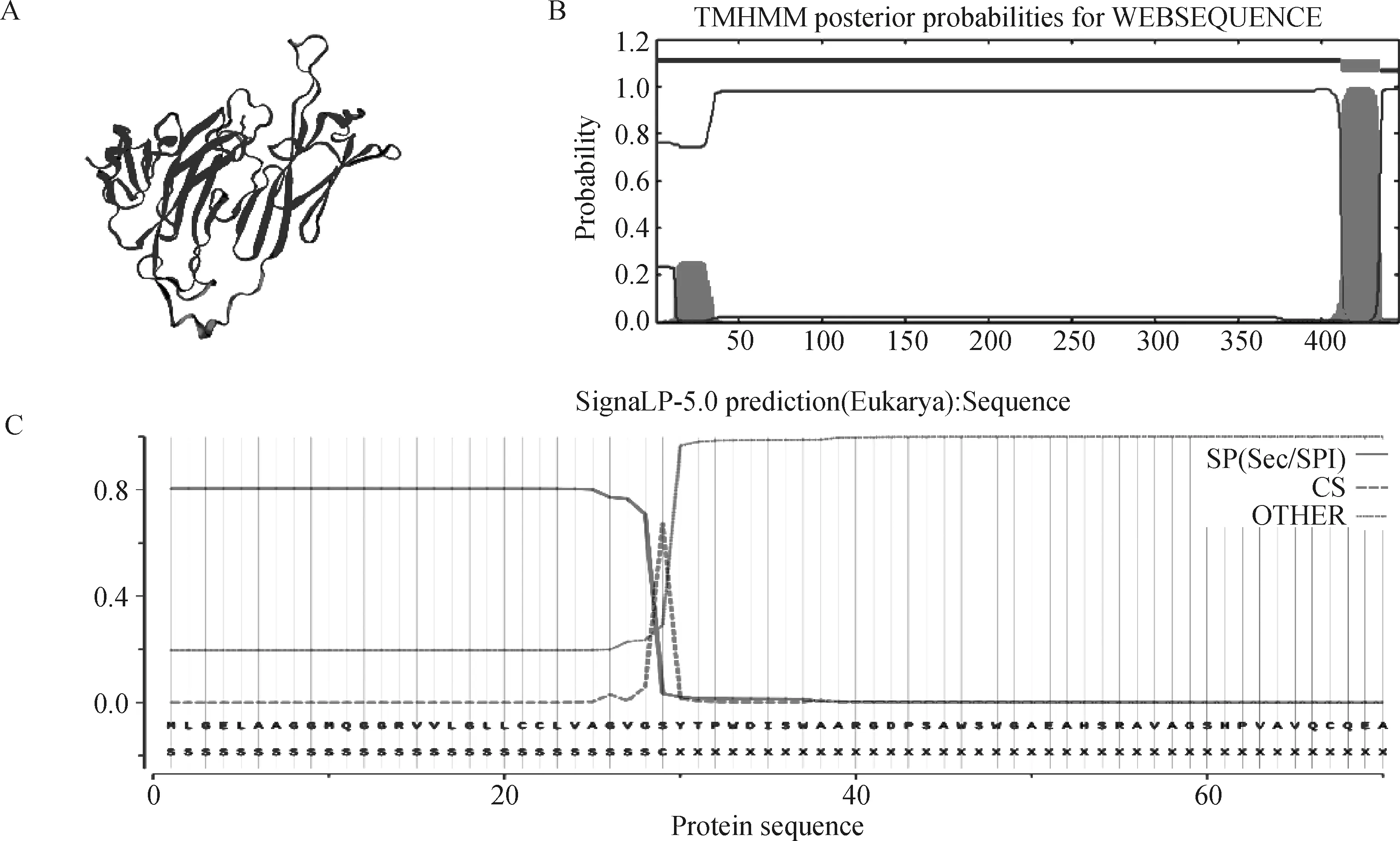
A.ZP3的三级结构预测;B.ZP3的跨膜结构预测;C.ZP3的信号肽预测A.Prediction of ZP3 tertiary structure;B.Prediction of ZP3 transmembrane structure;C.Prediction of ZP3 signal peptide图3 ZP3蛋白质结构预测分析Fig.3 Prediction analysis of ZP3 protein structure
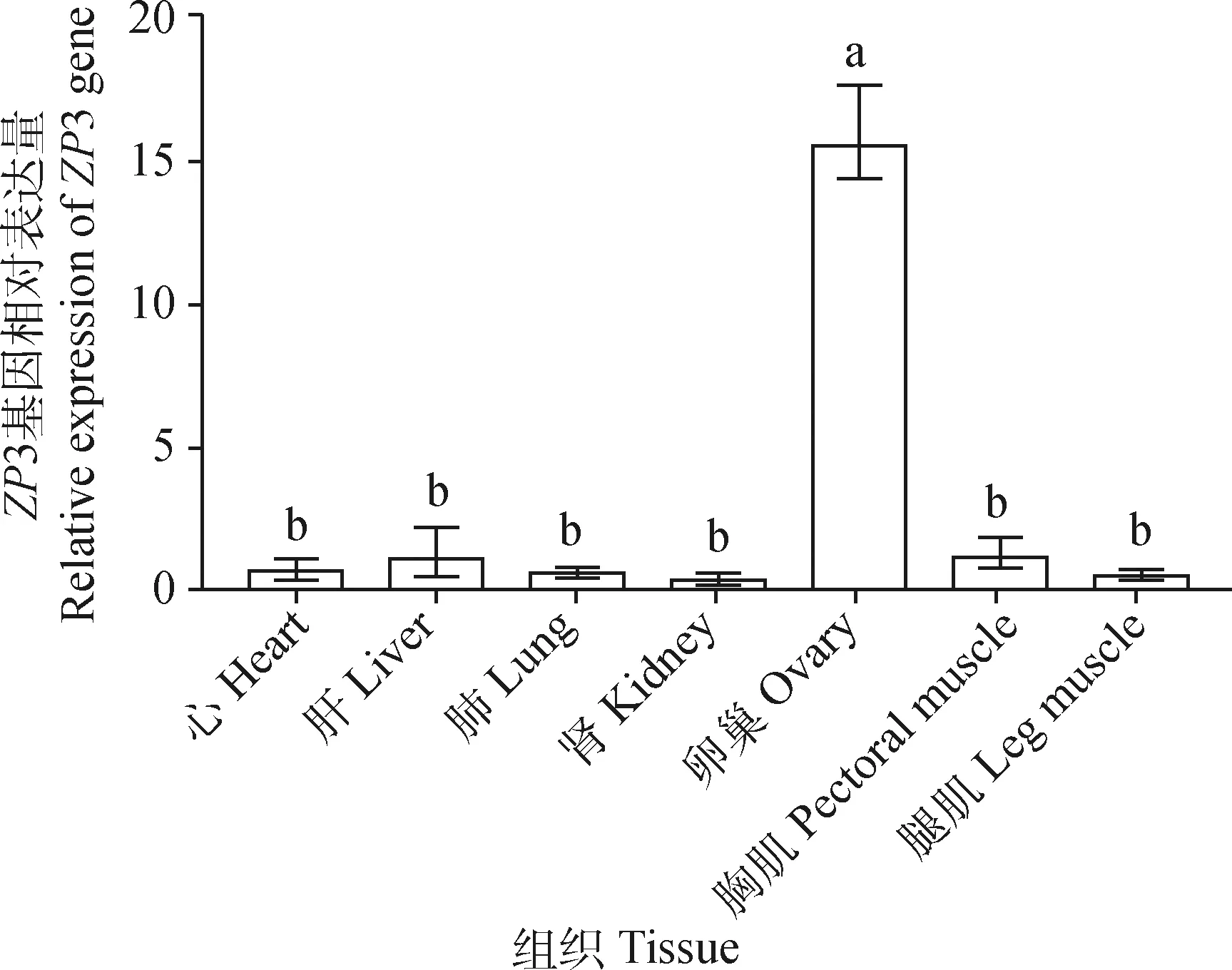
小写字母不同表示差异显著(P<0.05),下同Different lowercase letters indicate significant differences (P<0.05),the same as below图4 不同组织中ZP3 的表达Fig.4 Expression of ZP3 in different tissues
2.5 鸡ZP3基因在不同等级卵泡、颗粒细胞、膜细胞的表达
qRT-PCR检测ZP3基因在不同等级卵泡、颗粒细胞、膜细胞中的表达,结果见图5,在初始卵泡(F6)中表达量较低,随着卵泡的生长发育,该基因表达量不断升高,在F1阶段表达量显著高于F6阶段(P<0.05)。
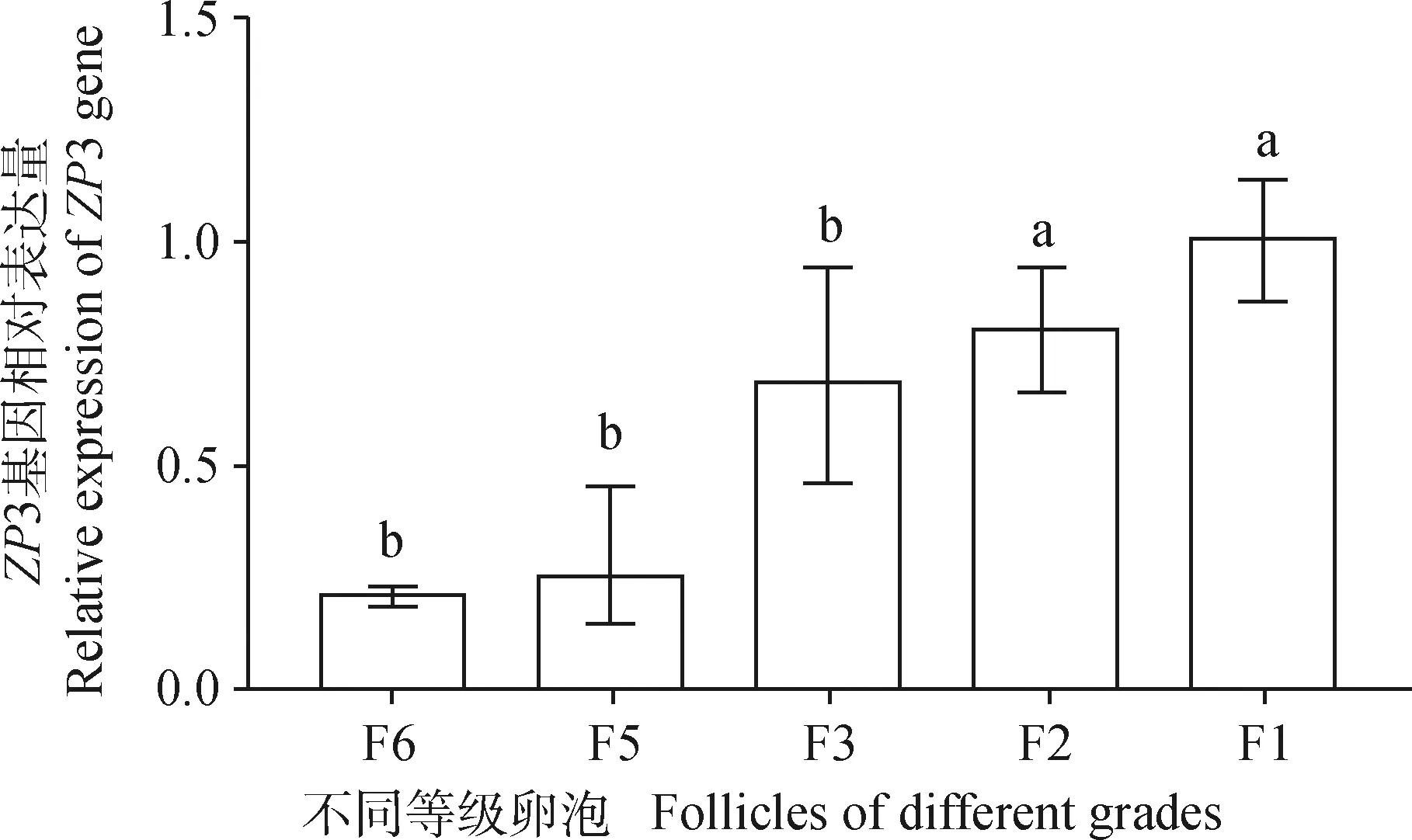
图5 不同等级卵泡中ZP3的表达Fig.5 Expression of ZP3 in follicles of different grades
qRT-PCR检测ZP3基因在不同等级卵泡颗粒细胞中的表达,结果见图6,在卵泡发育初期基因表达量最低,随着卵泡的发育,基因表达量增加,在卵泡发育近成熟(F1阶段),ZP3表达量显著高于其他阶段(P<0.05)。ZP3在不同等级卵泡膜细胞中的表达情况见图7,卵泡膜细胞ZP3表达趋势和卵泡颗粒细胞相似,小黄卵泡中表达量最低,在F1阶段表达量最高。ZP3总体呈现逐渐上升表达趋势,并且趋势与卵泡中表达趋势一致,但是在颗粒细胞中表达量明显高于膜细胞,表示该基因主要在颗粒细胞中发挥主要功能。
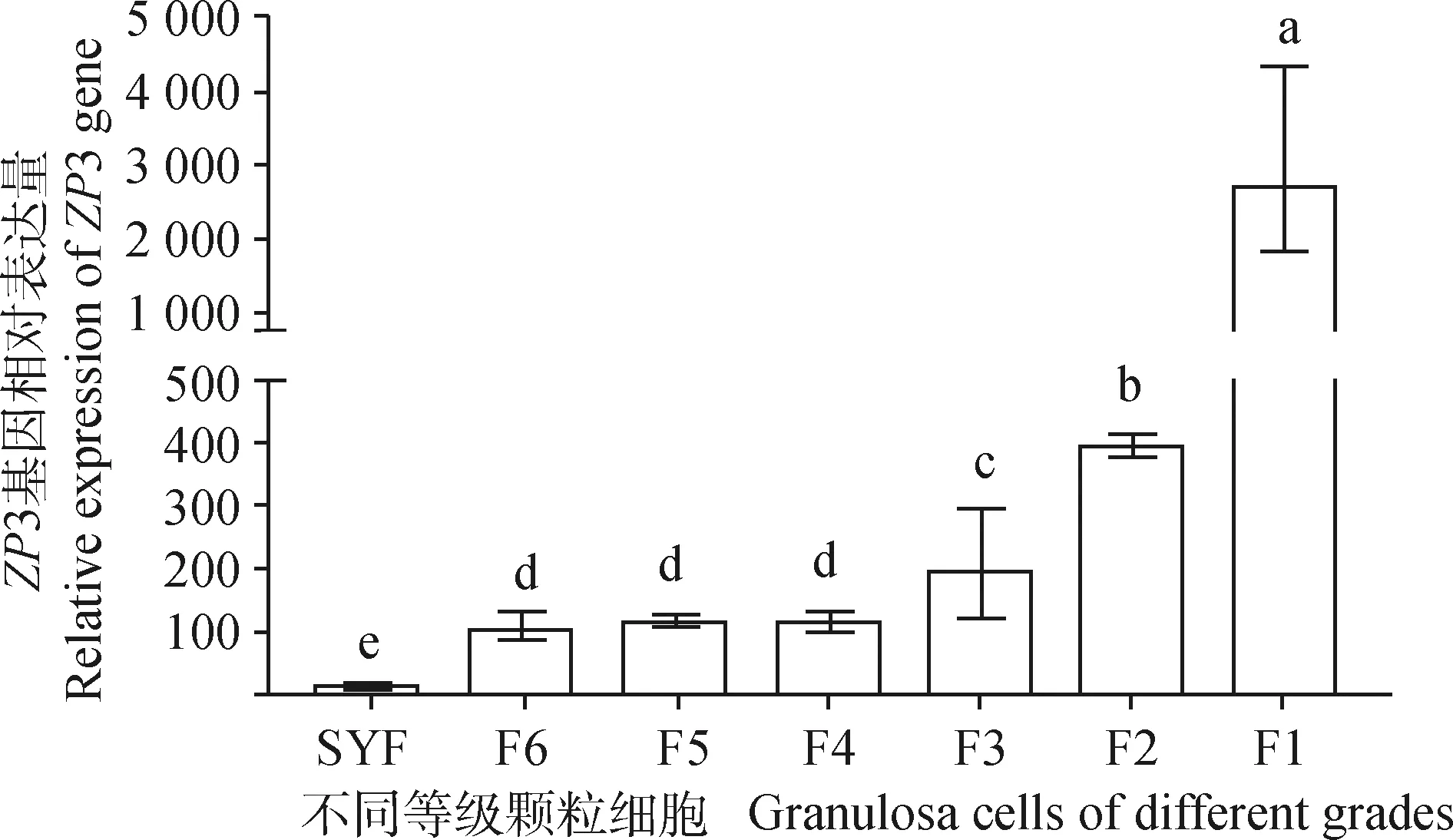
图6 不同等级卵泡颗粒细胞中ZP3的表达Fig.6 Expression of ZP3 in follicular granulosa cells of different grades
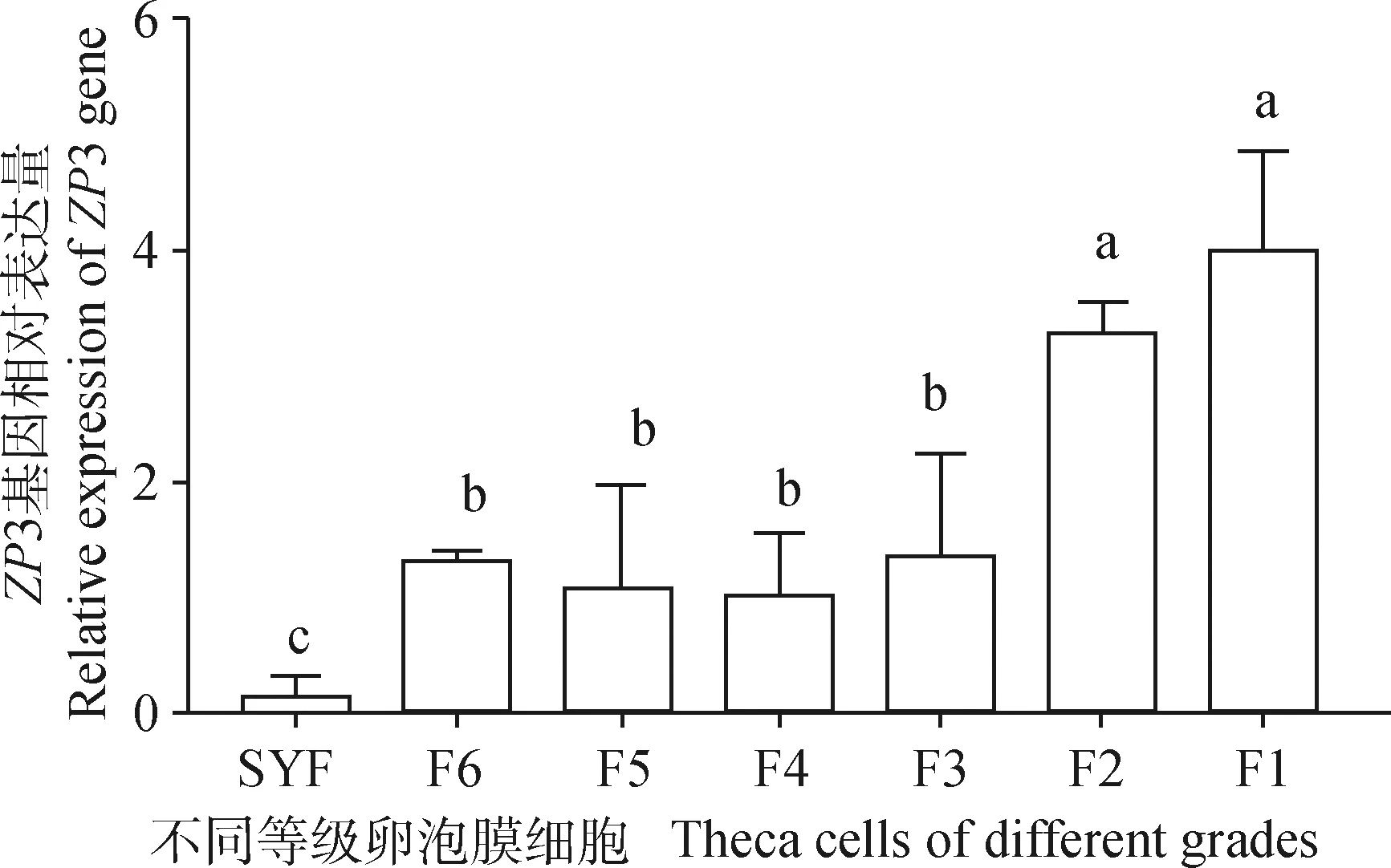
图7 不同等级卵泡膜细胞中ZP3的表达Fig.7 Expression of ZP3 in theca cells of different grades
2.6 不同浓度FSH对卵泡颗粒细胞中ZP3基因表达的影响
为研究不同浓度FSH对卵泡颗粒细胞中ZP3表达量的影响,分别采用5、10、50 ng·mL-1浓度的FSH对卵泡颗粒细胞进行处理,24 h后收集细胞样品,采用荧光定量PCR进行基因表达量检测,结果如图8所示,3种浓度的处理组之间并无显著差异,但均显著高于空白对照组(P<0.05)。
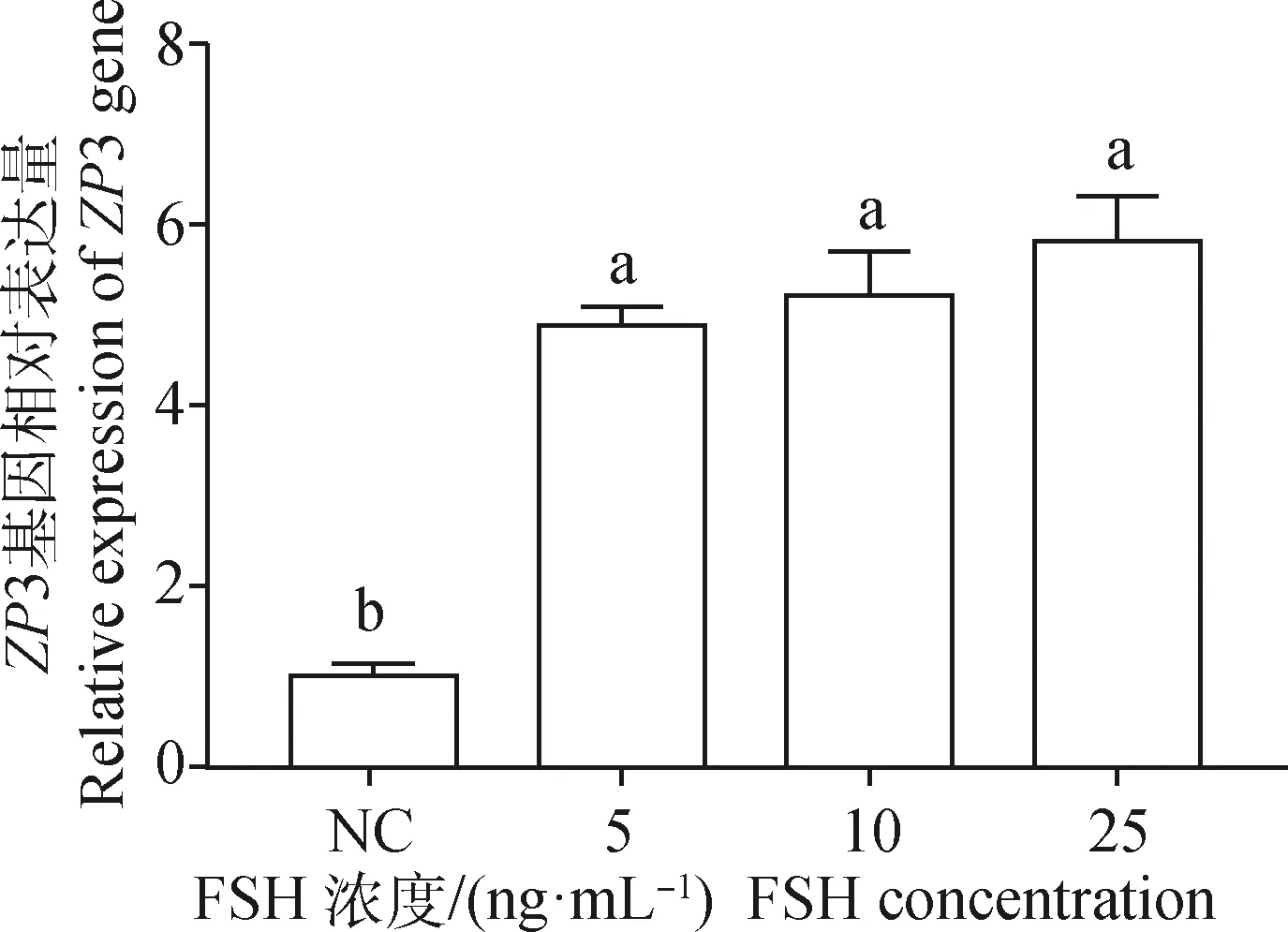
图8 不同浓度FSH对卵巢颗粒细胞中ZP3 表达的影响Fig.8 Effects of FSH with different concentrations on the expression of ZP3 in ovarian granulosa cells
3 讨 论
透明带蛋白在哺乳动物中有着很高的保守性,但是在非哺乳动物中的研究较少。有研究表明,在小鼠及爪蟾中ZP3诱导精子发生顶体反应,从而阻止多精受精。在对萍乡红鲫的研究中发现,精子和卵子相遇需要一套稳定的机制,使精子能够迅速准确地进入卵子[20]。而ZP3就是其中的一个识别因子,在与精子结合后,ZP3被修饰而不再具有精子受体活性和顶体反应诱导作用[21]。因此,在非哺乳动物中ZP3同样起到阻止多精受精的作用。在传统家禽育种中,产蛋率和受精率在很大程度上影响了育种的成本,而如何从分子机制上提高产蛋率和受精率成为了育种的新方向。
目前ZP3的研究主要集中在精卵结合方面,有研究证明,在哺乳动物如人和鼠上,ZP3蛋白主要在卵巢组织表达[22],但在家禽上的研究较少,家禽原始卵泡的发育起始于卵泡颗粒细胞分泌的细胞因子,促进卵母细胞生长,家禽的卵泡结构主要有卵黄膜层、颗粒细胞层、卵泡膜内层、卵泡膜外层鸡外周组织层[23],其中卵泡颗粒细胞在卵泡生长发育过程中发挥重要作用[24],颗粒细胞与膜细胞之间的互作机制是卵巢雌激素形成的基础[25]。在卵泡发育过程中,FSH可以促进发育差的卵泡再次发育[26],在小鼠模型中,敲除FSH受体可显著抑制卵泡生成,敲除ZP3会使小鼠卵母细胞发育失常[27],因此FSH和ZP3之间可能存在互作机制,同时 FSH还可以促进雌二醇分泌,以及通过促进抗凋亡蛋白(如XIAP蛋白和FLIP抑制蛋白)的表达来抑制细胞凋亡[28],雌二醇又可以与颗粒细胞内受体结合形成复合物通过抑制P53信号通路和相关蛋白进而抑制凋亡[29],同时雌二醇还可以通过TGF-α影响XIAP进而促进颗粒细胞增殖[30]。对哺乳动物的大量研究表明,颗粒细胞产生的孕酮可以反作用于卵泡颗粒细胞并抑制其凋亡,而颗粒细胞的凋亡是卵泡闭锁的根本原因[31],卵泡闭锁与产蛋量紧密相关,减少卵泡的闭锁在一定程度上可以提高产蛋量。
4 结 论
本试验获得的ZP3全长为1 415 bp,其中编码区1 341 bp;通过对海兰褐蛋鸡ZP3进行组织表达谱分析表明,基因在卵巢中表达量最高,通过构建不同发育阶段卵泡的表达谱,发现ZP3随着卵泡发育,在成熟卵泡中表达量最高,在颗粒细胞层表达量逐渐增加;在FSH处理颗粒细胞后,发现ZP3表达量显著上调,本试验证明FSH可以促进ZP3表达量的增加。基于以上结果推测,ZP3可能参与调控鸡的产蛋过程,但FSH-颗粒细胞-ZP3之间的具体调控机制还需后续研究。

