鸡脂肪组织TCF21基因启动子区DNA甲基化与其表达的关系
刘雨萌,马艳艳,姜海煦,张心扬,武春艳,程博涵,李 辉*
(1.农业农村部鸡遗传育种重点实验室,哈尔滨 150030;2.黑龙江普通高等学校动物遗传育种与繁殖重点实验室,哈尔滨 150030;3.东北农业大学动物科学技术学院,哈尔滨 150030)
脂肪组织不仅是能量储存库,也是机体最大的内分泌器官,通过分泌各种内分泌和旁分泌因子来调节多种生理过程[1-2]。脂肪组织生长发育的细胞学基础是脂肪细胞数量的增多和体积的增大[3]。其中,脂肪细胞的数量主要受多潜能干细胞向前脂肪细胞定向及前脂肪细胞增殖的调控,而脂肪细胞的体积则与其分化程度及甘油三酯积累量有关[4-5]。脂肪组织的生长发育主要受转录因子构成的网络调控,如过氧化物酶体增殖物激活受体γ(PPARγ)[6]、CCAAT增强子结合蛋白(C/EBPs)[7]、固醇调节元件结合蛋白(SREBPs)[8]、Kruppel样转录因子(KLFs)[9]和GATA结合蛋白(GATAs)[10]等。此外,不断有研究发现新的转录因子在调控脂肪组织生长发育过程中发挥重要的作用,如碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)家族中的转录因子TFE3、Ids等[11-12]。
DNA甲基化是一种重要的调控基因表达的表观遗传学机制,其调节基因表达的主要方式为改变DNA的稳定性、构象以及与蛋白质之间的相互作用[22-23]。DNA甲基化一般导致基因沉默[24-25];而DNA去甲基化则相反,往往会重新激活沉默基因的表达[26]。近年来一些研究结果显示,DNA甲基化在脂肪组织生长发育过程中发挥关键的调控作用[27-28]。Li等[29]发现,在诱导分化的小鼠3T3-L1前脂肪细胞中,C/EBPα基因的启动子呈高甲基化状态,而在未分化的3T3-L1前脂肪细胞中却没有检测到这种高甲基化信号增加。有研究表明,用DNA甲基转移酶抑制剂5-氮杂-2-脱氧胞苷(5-Aza-dC)处理小鼠C3H/10T1/2干细胞后,会增加其定向分化为脂肪细胞的能力[30]。Li等[31]利用MeDIP-seq技术绘制了猪不同部位脂肪组织(背部浅表脂肪组织和背部深层脂肪组织)的DNA甲基化图谱,发现与深层脂肪组织相比,浅表脂肪组织中的DNA甲基化程度更高,表明不同部位脂肪组织的甲基化程度不同。以上研究表明,DNA甲基化在脂肪组织的生长发育中扮演重要角色。近年来,对TCF21基因DNA甲基化的研究主要集中在癌症上面。在多种癌症中发现TCF21基因的表达与其启动子区DNA甲基化的状态密切相关[32-35]。到目前为止,尚未发现脂肪组织中TCF21基因DNA甲基化水平与其表达关系的研究报道。
本实验室以腹脂率和血浆极低密度脂蛋白为选择指标,构建了东北农业大学肉鸡高、低腹脂双向选择品系(Northeast Agricultural University broiler lines divergently selected for abdominal fat content,NEAUHLF)[36]。目前,这两个品系已经选育了24个世代,两品系肉鸡之间腹脂率差异极显著。本课题组前期研究发现,TCF21基因在第19世代高脂系肉鸡腹部脂肪组织中的表达水平显著高于低脂系肉鸡[21],但其潜在的调控机制还不清楚。鉴于此,本研究将在前期研究的基础上,探究鸡脂肪组织中TCF21基因启动子区DNA甲基化与其表达之间的关系。研究结果将有助于揭示高、低脂系肉鸡腹部脂肪组织中TCF21基因差异表达的原因,为深入研究鸡TCF21基因的表达调控机制奠定基础。
1 材料与方法
1.1 试验材料
以高、低脂系第24世代7周龄肉鸡(来自于东北农业大学阿城畜牧基地鸡场)为试验材料(每个品系15只鸡)。禁食12 h后称量体重(BW)并屠宰,屠宰后称量腹脂重(AFW),并计算腹脂率(AFP=AFW/BW)。采集的腹部脂肪组织样品于0.75%氯化钠中清洗,剪成小块,放置于5 mL采样管中,并于液氮中速冻,-80 ℃保存待用。需要说明的是:高、低脂系肉鸡第24世代每个品系各组建了40个 半同胞家系,定向输精、系谱孵化。每个品系孵化出1 000只左右的雏鸡,公母各半。所有公鸡按照肉仔鸡的饲养方式饲养至7周龄屠宰。在挑选用于组织样品采集的鸡只时,要符合以下两个条件:1)每个品系的15只鸡生长发育正常;2)每个品系的15只鸡来源于不同的半同胞家系。
1.2 载体和细胞系
海肾荧光素酶报告基因载体pRL-TK和萤火虫荧光素酶报告基因载体pGL3-basic由本实验室留存;不含CpG位点的萤火虫荧光素酶报告基因载体,pCpGL-basic由扬州大学戴超辉惠赠[37];永生化鸡前脂肪细胞(ICP1、ICP2细胞)由本实验室构建[38]。
1.3 主要试剂
TRIzol RNA分离试剂、DMEM/F12培养基、Opti-MEM无血清培养基、LipofectamineTM3000 Transfection Reagent、Penicillin-Streptomycin Liquid购自赛默飞世尔科技(中国)有限公司;0.25% Trypsin-EDTA(1×)购自Gibco公司;PBS缓冲液粉末购自北京中杉金桥生物科技有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser购自TaKaRa公司;Fast Start Universal SYBR Green Master购自Roche公司;胎牛血清(FBS)购自Biological Industries公司;CpG甲基转移酶(M.SssI)购自NEB公司;质粒小提试剂盒购自Axygen公司;双荧光素酶报告基因试剂盒Dual-Luciferase®Reporter Assay System购自Promega公司。
1.4 生物信息学预测
利用JASPAR(http://jaspar.genereg.net/)、TRANSFAC(http://gene-regulation.com/pub/databases.html)、AnimalTFDB(http://bioinfo.life.hust.edu.cn/AnimalTFDB)预测转录因子结合位点。利用MethPrimer(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)预测鸡TCF21基因启动子区CpG位点、CpG岛的数量和分布。将片段长度大于200 bp,CG含量超过50%,CG核苷酸比率大于0.6 的片段定义为CpG岛。
1.5 引物设计和合成
本研究所用引物均根据鸡的全基因组序列(http://genome.ucsc.edu,UCSC)Mar.2018(GRCg6a/galGal6)来设计,并委托北京英潍捷基公司进行合成。TCF21基因表达检测引物使用Primer Premier 5.0软件设计,其中TCF21-P1扩增片段长度为264 bp、TBP-P1扩增片段长度为122 bp。TCF21基因启动子区DNA甲基化检测引物使用Agena EpiDesigner程序设计,其中TCF21-P2引物扩增片段长度为487 bp(-1 961~-1 475 bp)、TCF21-P3引物扩增片段长度为467 bp(-1 455~-989 bp)、TCF21-P4引物扩增片段长度为423 bp(-1 013~-590 bp)、TCF21-P5引物扩增片段长度为490 bp(-676~-187 bp)、TCF21-P6引物扩增片段长度为334 bp(-170~+164 bp)。引物信息见表1。

表1 引物序列Table 1 Primer sequences
1.6 RT-qPCR
采用 TRIzol 试剂提取脂肪组织的总RNA,并反转录成cDNA。Real-Time PCR反应液的组成:SYBR 5 μL,上/下游引物各0.2 μL,H2O 3.6 μL,cDNA 1 μL,总体系为10 μL。反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。以TATA盒结合蛋白(TATA-box binding protein,TBP)为内参基因,采用2-△△Ct方法计算TCF21基因的相对表达水平[39],其中ΔCt =Ct(TCF21)-Ct(TBP)。TCF21基因表达检测引物序列见表1。
来了一个人,正在打量投水似的神气,把花条子衬衣下角长长的拖着,作成北京城大学生特有的丑样子,在脸上,也正同样有一派老去民族特有的憔悴颜色。
1.7 Sequenom MassARRAY检测DNA甲基化
采用QIAamp DNA Mini Kit提取鸡腹部脂肪组织DNA。采用EpiTect Fast DNA Bisulfite Kit说明书对DNA进行亚硫酸氢盐处理。以上述亚硫酸盐处理的DNA为试验材料,利用Sequenom MassARRAY飞行质谱技术进行TCF21基因启动子区CpG单元的甲基化水平检测(委托上海欧易生物医学科技有限公司完成)。一个CpG单元表示一个单独的CpG位点或者是多个联合的CpG位点[40-41]。TCF21基因启动子区DNA甲基化检测引物见表1。
1.8 启动子荧光素酶报告基因载体的构建
委托金唯智生物技术公司合成鸡TCF21基因启动子(将5′-UTR对应的基因组区域及5′-UTR上游2 000 bp定义为TCF21基因启动子)及5′端截短的启动子片段并连接至pGL3-Basic载体,构建含有TCF21基因启动子及5′端截短的启动子片段的萤火虫荧光素酶报告基因载体,分别命名为pGL3-2000/+165、pGL3-1500/+165、pGL3-1000/+165、pGL3-500/+165、pGL3-200/+165、pGL3-100/+165,并将鸡TCF21基因5′-UTR对应的基因组区域及5′-UTR上游2 000 bp定义为鸡TCF21基因启动子。委托金唯智生物技术公司合成TCF21基因启动子R2+R3区域(-1 500~-500 bp)、R2区域(-1 500~-1 000 bp)、R3区域(-1 000~-500 bp)DNA片段并连接至pCpGL-Basic载体(该载体骨架不含CG位点),构建含有TCF21基因启动子重要区域的萤火虫荧光素酶报告基因载体,分别命名为pCpGL-1500/-500、pCpGL-1500/-1000和pCpGL-1000/-500。
1.9 细胞转染及荧光素酶活性检测
将永生化鸡前脂肪细胞接种于24孔板,当细胞70%~90%汇合时,采用Lipofectamine 3000转染试剂将构建好的萤火虫荧光素酶报告基因质粒和海肾荧光素酶报告基因质粒以100∶1的比例转染至细胞中。转染后48 h收集细胞,根据Dual-Luciferase Reporter Assay System(Promega)试剂盒说明书分别检测萤火虫荧光素酶活性(Fluc)和海肾荧光素酶活性(Rluc)。TCF21基因启动子活性用相对荧光素酶活性(Fluc/Rluc)表示。
1.10 DNA甲基化转移酶处理启动子报告基因载体
甲基化组:用CpG甲基转移酶(M.SssI)在37 ℃ 条件下对pCpGL-TCF21-1500/-500、pCpGL-TCF21-1500/-1000、pCpGL-TCF21-1000/-500质粒及阳性对照质粒pGL3-P1和阴性对照质粒pCpGL-basic处理4 h。CpG甲基化酶(M.Sssl)反应体系:10×NEBuffer 230 μL,S-adenosylmethionone (1 600 μmol·L-1)30 μL,质粒15 μg,甲基转移酶3.75 μL,补充Nuclease-free water至150 μL。非甲基化组:反应体系中用Nuclease-free water代替甲基转移酶,其它操作与甲基化组相同。质粒处理4 h后,利用PCR纯化试剂盒对甲基化组与非甲基化组的质粒进行纯化,-20 ℃保存待用。
1.11 统计分析
所有数据结果都表示为“平均值(Mean)±标准差(SD)”。采用Student’st-test进行两组数据的差异显著性分析。利用Pearson相关系数分析DNA甲基化水平与基因表达水平之间的相关性。P<0.05 表示差异显著或相关性显著,P<0.01或P<0.001表示差异极显著或相关性极显著。统计分析所用软件为JMP 11.0(SAS Institute)。
2 结 果
2.1 高、低脂系肉鸡脂肪组织中TCF21基因表达水平的比较分析
结果显示,高脂系肉鸡的腹脂率极显著高于低脂系肉鸡(P<0.001,图1A)。高脂系肉鸡腹部脂肪组织中TCF21基因mRNA表达水平极显著高于低脂系肉鸡(P<0.001,图1B)。

A.第24世代7周龄高、低脂系肉鸡腹脂率的比较;B.第24世代7周龄高、低脂系肉鸡腹部脂肪组织中TCF21基因的mRNA表达情况。LEAN代表低脂系肉鸡(n=15),FAT代表高脂系肉鸡(n=15);***.P<0.001,下同A.Comparison of abdominal fat percentage between lean and fat line broilers at 7 weeks of age from the 24th generation of NEAUHLF;B.Expression of TCF21 mRNA in abdominal adipose tissue of fat and lean broilers at 7 weeks of age from the 24th generation of NEAUHLF.LEAN represent lean line broilers (n=15),FAT represent fat line broilers (n=15).***.P<0.001,the same as below图1 高、低脂系肉鸡第24世代7周龄腹脂率及腹部脂肪组织中TCF21基因的mRNA表达情况Fig.1 Comparison of AFP and the expression of TCF21 mRNA in abdominal adipose tissue of fat and lean broilers at 7 weeks of age from the 24th generation of NEAUHLF
2.2 鸡TCF21基因启动子结构与功能的初步分析
Methprimer在线软件分析结果显示,鸡TCF21基因的启动子区(5′-UTR对应的基因组区域及5′-UTR上游2 000 bp)不存在CpG岛,但存在40个CpG位点,这些CpG位点在启动子的近端和远端均有分布(图2)。

每条竖线代表一个CpG位点Each vertical line represents a CpG site图2 鸡TCF21基因启动子区CpG位点分布Fig.2 Distribution of CpG sites in the promoter region of chicken TCF21
启动子报告基因活性分析结果显示,当TCF21基因启动子从-2 000 bp截短到-1 500 bp时,启动子活性降低,暗示TCF21基因启动子-2 000~-1 500 bp之间存在重要的正调控元件,将该区域命名为“R1”(图3A、B、C);当TCF21基因启动子从-1 500 bp截短到-1 000 bp时,启动子活性上升,暗示TCF21基因启动子-1 500~-1 000 bp之间存在重要的负调控元件,将该区域命名为“R2”(图3A、B、C);当TCF21基因启动子从-1 000 bp截短到-500 bp时,启动子活性上升,暗示TCF21基因启动子-1 000~-500 bp之间存在重要的负调控元件,将该区域命名为“R3”(图3A、B、C);当TCF21基因启动子从-500 bp截短到-200 bp时,启动子活性降低,暗示TCF21基因启动子-500~-200 bp之间存在重要的正调控元件,将该区域命名为“R4”(图3A、B、C);当TCF21基因启动子从-200 bp截短到-100 bp时,启动子活性消失,说明TCF21基因启动子-200~-100 bp之间具有维持TCF21基因转录活性的基本元件,该区域是TCF21基因启动子的核心区域,将该区域命名为“Core”(图3A、B、C)。此外,将TCF21启动子-100~ +165 bp的区域命名为R5(图3C)。
为明确哪些转录因子可能参与调控鸡TCF21基因启动子的活性,本研究利用JASPAR、TRANSFAC和AnimalTFDB在线软件分析了鸡TCF21基因启动子各个区域内潜在的转录因子结合位点。结果显示,鸡TCF21基因启动子R1区域(-2 000~-1 500 bp)存在CDX1、HOXA2、PDX1、Pax2及Sox17的结合位点;R2区域(-1 500~-1 000 bp)存在Pax2、Sox10、FOS、SPIB及FOXP3的结合位点;R3区域(-1 000~-500 bp)存在FOXA1、CREB1、Sox3及STAT3的结合位点;R4区域(-500~ -200 bp)存在IRF7、KLF5及Pax2的结合位点;Core区域(-200~-100 bp)存在KLFs(KLF4、KLF5、KLF16),Sps(Sp1、Sp2、Sp3)及GATA5的结合位点(图3D)。

A.ICP1细胞中鸡TCF21基因启动子的报告基因分析;B.ICP2细胞中鸡TCF21基因启动子的报告基因分析;C.TCF21基因启动子重要区域;D.鸡TCF21基因启动子区潜在的转录因子结合位点。*. P<0.05,**.P<0.01,下同A.Reporter gene analysis of chicken TCF21 promoter in ICP1 cells;B.Reporter gene analysis of chicken TCF21 promoter in ICP2 cells;C.The important region of TCF21 promoter;D.The potential transcription factor binding site in the chicken TCF21 promoter region.*.P<0.05,**.P<0.01,the same as below图3 鸡TCF21基因启动子的结构和功能的初步分析Fig.3 Structure and function analysis of chicken TCF21 promoter
2.3 TCF21基因启动子区DNA甲基化分析
利用Sequenom MassARRAY飞行质谱技术检测高、低脂系肉鸡7周龄腹部脂肪组织中TCF21基因启动子区(-2 000~+165 bp)40个CpG位点的甲基化程度。需要说明的是:一个CpG单元表示一个单独的CpG位点或者是多个联合的CpG位点。据此,将40个CpG位点划分为38个CpG单元(CpG_32与CpG_33合并、CpG_37与CpG_38合并,图4)。本研究成功检测到31个CpG单元的甲基化,其中3个CpG单元位于R1区域、7个CpG单元位于R2区域、6个CpG单元位于R3区域、5个CpG单元位于R4区域、1个CpG单元位于Core区域、9个CpG单元位于R5区域(图4)。
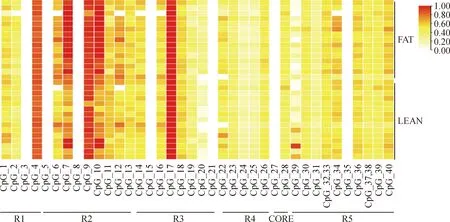
每一行表示一个样本,每一列表示一个CpG单元。从浅黄色到红色的变化显示甲基化水平的升高,白色表示甲基化水平为0或缺失值Each sample is shown in one row,each CpG unit is shown in a column.The methylation degree is shown as a gradient varying from yellow to red.White indicates that methylation level of the CpG unit is 0 or missing data图4 高、低脂系肉鸡脂肪组织中TCF21基因启动子区CpG单元分布及其甲基化状态Fig.4 The distribution and methylation status of CpG units in the promoter region of TCF21 in adipose tissue of fat and lean line broilers
根据检测得到的DNA甲基化情况,本研究首先从整体水平分析了高、低脂系肉鸡腹部脂肪组织中TCF21基因启动子及启动子各个区域的DNA甲基化程度(用每个区域内所有成功检测的CpG单元的平均甲基化水平来代表该区域的DNA甲基化水平,图5)。结果显示,TCF21基因启动子的DNA甲基化水平在高、低脂系间差异不显著(P>0.05;图5H),高脂系R2、R3及R2+R3的区域DNA甲基化水平显著或极显著高于低脂系(P<0.05或P<0.001;图5B、C、G),其他区域(R1区域、R4区域、Core区域、R5区域)的DNA甲基化水平在高、低脂系间差异不显著(P>0.05;图5A、D、E、F)。

A~G.TCF21基因启动子R1、R2、R3、R4、Core、R5和R2+R3区域的DNA甲基化分析;H.TCF21基因启动子DNA甲基化分析。ns.差异不显著A-G.DNA methylation analysis of R1,R2,R3,R4,Core,R5 and R2+R3 regions of TCF21 promoter,respectively;H.DNA methylation analysis of promoter of TCF21.ns.Not significant图5 高、低脂系肉鸡脂肪组织中TCF21基因启动子区DNA甲基化水平的比较Fig.5 Comparison of DNA methylation level of TCF21 promoter in adipose tissue between fat and lean broilers
另外,本研究还分析了高、低脂系肉鸡腹部脂肪组织中TCF21基因启动子区每个CpG单元的DNA甲基化水平。结果显示,高、低脂系肉鸡间存在甲基化水平差异的CpG单元有8个,包括CpG_6、CpG_7、CpG_10、CpG_11、CpG_12、CpG_20、CpG_29、CpG_32,33,其中高脂系CpG_6、CpG_7、CpG_10、CpG_12、CpG_20、CpG_32,33单元的甲基化水平显著或极显著高于低脂系,而高脂系CpG_11和CpG_29单元的甲基化水平显著低于低脂系(表2)。
2.4 TCF21基因启动子区DNA甲基化水平与其mRNA 表达水平的相关性分析
首先,从整体水平分析高、低脂系肉鸡腹部脂肪组织中TCF21基因启动子及启动子各个区域的DNA甲基化水平与其mRNA表达水平的相关性。结果显示,TCF21基因启动子R2区域、R3区域及R2+R3区域DNA甲基化水平与TCF21基因mRNA表达水平呈显著的正相关(R2区域:r=0.438,P<0.05;R3区域:r=0.371,P<0.05;R2+R3区域:r=0.489,P<0.05;图6B、C、G)。以上结果表明,TCF21基因启动子R2和R3区域的DNA甲基化对于调控TCF21 mRNA的表达可能具有重要作用。
除此之外,本研究还分析了单个CpG单元的甲基化水平与TCF21基因mRNA表达水平的相关性,结果见表2。高、低脂系肉鸡中显著差异的8个CpG单元的甲基化水平与TCF21 mRNA表达水平相关分析的结果显示:CpG_7、CpG_10、CpG_20的甲基化水平与TCF21 mRNA表达水平呈显著或极显著正相关(P<0.05或P<0.01),CpG_29的甲基化水平与TCF21 mRNA表达水平呈显著负相关(P<0.05)。
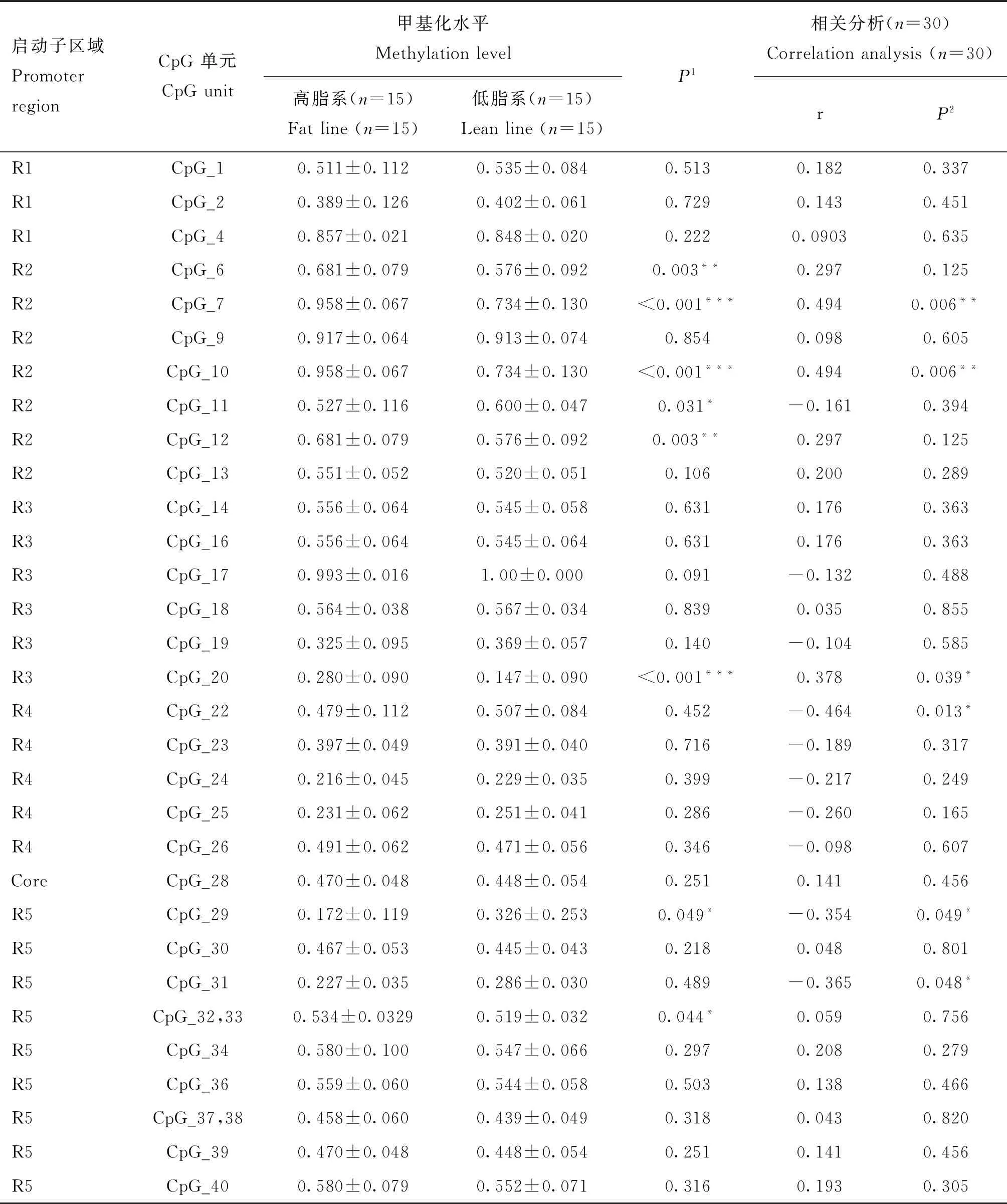
表2 TCF21基因启动子区DNA甲基化状态以及单个CpG单元甲基化水平与其mRNA表达水平的相关性Table 2 The DNA methylation status of TCF21 promoter region and the correlation of the levels of individual CpG unit methylation with TCF21 mRNA expression

A.TCF21基因启动子R1区域DNA甲基化与其mRNA表达的相关性;B.TCF21基因启动子R2区域DNA甲基化与其mRNA表达的相关性;C.TCF21基因启动子R3区域DNA甲基化与其mRNA表达的相关性;D.TCF21基因启动子R4区域DNA甲基化与其mRNA表达的相关性;E.TCF21基因启动子Core区域DNA甲基化与其mRNA表达的相关性析;F.TCF21基因启动子R5区域DNA甲基化与其mRNA表达的相关性;G.TCF21基因启动子R2+R3区域DNA甲基化与其mRNA表达的相关性;H.TCF21基因启动子DNA甲基化与其mRNA表达的相关性A.The correlation between DNA methylation level of R1 region and TCF21 mRNA expression level;B.The correlation between DNA methylation level of R2 region and TCF21 mRNA expression level;C.The correlation between DNA methylation level of R3 region and TCF21 mRNA expression level;D.The correlation between DNA methylation level of R4 region and TCF21 mRNA expression level;E.The correlation between DNA methylation level of Core region and TCF21 mRNA expression level;F.The correlation between DNA methylation level of R5 region and TCF21 mRNA expression level;G.The correlation between DNA methylation level of R2+R3 region and TCF21 mRNA expression level;H.The correlation between DNA methylation level of promoter of TCF21 gene and TCF21 mRNA expression level图6 肉鸡腹部脂肪组织中TCF21基因启动子区DNA甲基化水平与其mRNA表达水平的相关性Fig.6 Correlation between TCF21 promoter DNA methylation level and mRNA expression in abdominal adipose tissue of broilers
2.5 DNA甲基化对鸡TCF21基因启动子活性的影响
本研究发现TCF21基因启动子R2、R3及R2+R3的区域DNA甲基化水平在高、低脂系肉鸡腹部脂肪组织之间差异显著,且R2区域、R3区域及R2+R3区域DNA甲基化水平与TCF21基因mRNA 表达水平显著相关,提示TCF21启动子这些区域的DNA甲基化可能影响其mRNA表达。为进一步分析TCF21启动子R2区域、R3区域及R2+R3区域的DNA甲基化是否影响其转录活性,首先将鸡TCF21基因启动子R2区域、R3区域及R2+R3区域分别克隆到无CpG位点的荧光素酶报告基因载体pCpGL-basic上,将上述3个质粒及pCpGL-basic分别与pRL-TK共转染于鸡ICP1细胞中,转染48 h后收集细胞,检测报告基因活性。结果显示,pCpGL-1500/-500(TCF21基因启动子R2+R3区域)、pCpGL-1500/-1000(TCF21基因启动子R2区域)、pCpGL-1000/-500(TCF21基因启动子R3区域)的报告基因活性显著高于pCpGL-basic(P<0.05,图7A),说明TCF21启动子R2区域、R3区域、R2+R3区域在鸡ICP1细胞中具有转录活性。
随后,将以上3个鸡TCF21启动子报告基因质粒、阳性对照质粒pGL3-P1(该阳性对照质粒是包含鸡PPARγ基因P1启动子的报告基因载体,本实验室前期发现DNA甲基化能显著抑制pGL3-P1的报告基因活性[42]。因此,本研究用该阳性对照质粒来证实DNA甲基化酶处理质粒实验系统的有效性)及阴性对照质粒pCpGL-basic利用CpG甲基转移酶M.SssI处理,作为甲基化组;而未甲基化组则是用RNase Free H2O处理这5种质粒。将甲基化的质粒pCpGL-1500/-500、pCpGL-1500/-1000、pCpGL-1000/-500、pGL3-P1和pCpGL-basic以及他们对应的未甲基化质粒分别与pRL-TK共转染于鸡ICP1细胞中。报告基因活性分析结果显示,甲基化的pGL3-P1的报告基因活性显著低于其对应的未甲基化的报告基因活性(P<0.05,图7B),说明DNA甲基化酶处理报告基因质粒这一试验系统是有效的。此外,甲基化的pCpGL-1500/-500(TCF21基因启动子R2+R3区域)和pCpGL-1500/-1000(TCF21基因启动子R2区域)的报告基因活性显著低于其对应的未甲基化的报告基因活性,报告基因活性分别下调37%和47%(P<0.05,图7B),而pCpGL-1000/-500(TCF21基因启动子R3区域)在甲基化酶处理前后报告基因活性没有显著差异(P>0.05,图7B)。尽管R2+R3区域的DNA甲基化对报告基因活性的抑制作用略弱于单独的R2区域的DNA甲基化对报告基因活性的抑制作用,但差异并不显著(P>0.05,图7C)。以上结果说明R2区域的DNA甲基化会显著抑制其转录活性,而无论是R3区域单独存在还是与R2区域共同存在,R3区域的DNA甲基化均不会对其转录活性造成影响。
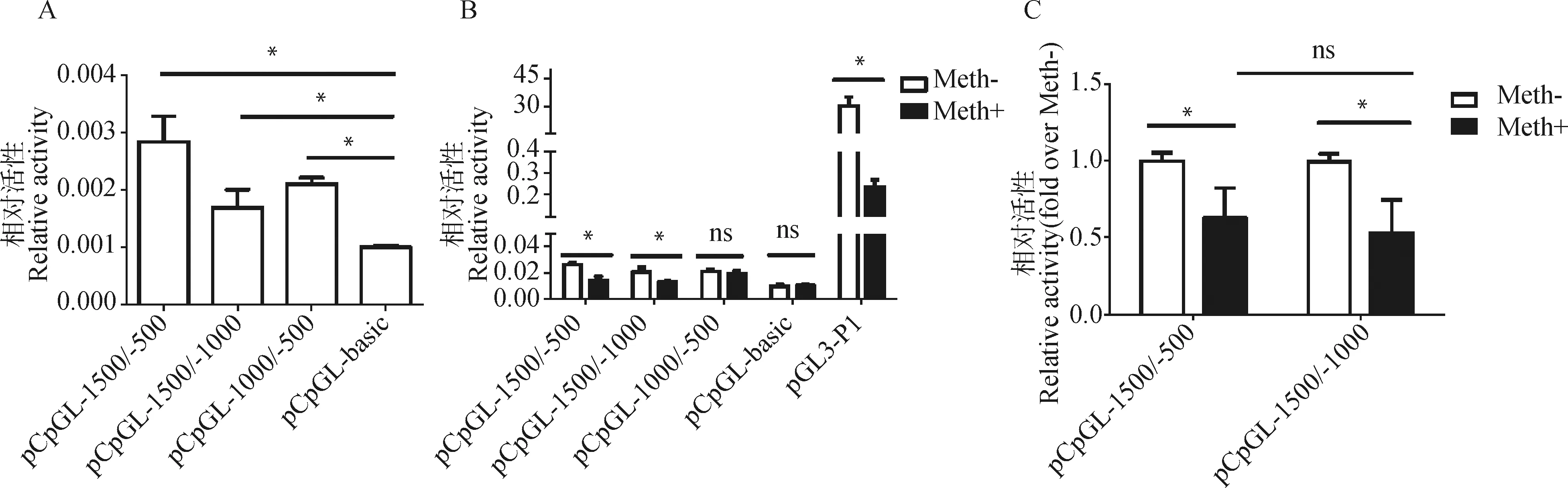
A.TCF21基因启动子报告基因活性;B.TCF21基因启动子甲基化和未甲基化报告基因活性;C.TCF21基因启动子R2+R3区域及R2区域甲基化和未甲基化报告基因活性A.Reporter activity of TCF21 promoter;B.Reporter activity of methylation and unmethylation TCF21 promoter;C.Reporter activity of methylation and unmethylation R2+R3 and R2 regions of TCF21 promoter图7 DNA甲基化对TCF21基因启动子活性的影响Fig.7 Effect of DNA methylation on promoter activity of TCF21
3 讨 论
DNA甲基化作为一种重要的表观遗传学修饰,启动子区发生的DNA甲基化通常与基因的转录沉默有关[43]。越来越多的研究表明,TCF21基因启动子区DNA甲基化水平与其表达水平密切相关。人类上的研究发现,与癌旁组织相比,胃癌组织中TCF21启动子区DNA甲基化水平显著升高,同时其基因表达水平显著降低,用DNA甲基转移酶抑制剂5-AZA-2’-脱氧-胞嘧啶处理胃癌细胞可以上调TCF21的表达[44]。在头部和颈部鳞状细胞癌中,TCF21基因的DNA甲基化及基因表达状态与在胃癌中相同,启动子区的高甲基化抑制了该基因的表达[45]。到目前为止,尚未发现鸡TCF21基因启动子区DNA甲基化与其表达关系相关的研究报道。本研究发现TCF21基因在第24世代高、低脂系肉鸡7周龄腹部脂肪组织中差异表达(图1),这与该群体第19世代的研究结果一致[21]。由于DNA甲基化与基因表达之间存在很强的联系,这促使本课题组探究鸡TCF21基因在高、低脂系腹部脂肪组织的差异表达是否受到其启动子区DNA甲基化的调控。因此,本研究检测了鸡腹部脂肪组织中TCF21基因启动子区的甲基化状态,结果显示,在高、低脂系肉鸡腹部脂肪组织中TCF21基因启动子R2、R3、R2+R3区域的DNA甲基化水平存在显著差异(图5),提示TCF21基因在高、低脂系腹脂中的差异表达与R2和R3区域的DNA甲基化水平有关。随后的研究发现TCF21基因启动子R2、R3、R2+R3区域的DNA甲基化水平与TCF21基因mRNA表达水平确实有关。但值得注意的是,TCF21基因启动子上述区域的DNA甲基化水平与其mRNA表达水平呈显著的正相关(图6)。这一结果与通常所熟知的DNA甲基化抑制基因的表达并不一致。推测原因可能是鸡脂肪组织中TCF21基因的mRNA水平除了受DNA甲基化调控外,还受转录因子、组蛋白修饰、染色质重塑等其它因素的调控。前人相关研究也发现了此类现象。在人的肝癌(HCC)和胃肠道癌(GI)细胞系中,TP73基因的表达就是通过DNA甲基化来激活的,当TP73基因启动子区DNA未甲基化时,转录因子CTCF和p53与TP73启动子不结合,TP73基因的转录受到抑制;当TP73基因启动子区DNA发生甲基化后,CTCF和p53可以与之结合,从而激活TP73基因的表达[46]。研究发现,FoxA2基因启动子区DNA未甲基化时,Polycomb Group (PcG)蛋白作为转录抑制复合物可与FoxA2启动子区结合,引起FoxA2启动子区组蛋白H3K27 me3修饰,进而抑制FoxA2启动子活性与基因表达;当FoxA2基因启动子区DNA发生甲基化后,阻碍了PcG蛋白与FoxA2启动子的结合,解除了PcG蛋白对FoxA2基因转录的抑制作用,使FoxA2表达水平增加[47]。类似的研究发现,RHOC基因启动子区DNA未甲基化时,转录因子KLF4与RHOC启动子不结合,RHOC启动子处于高度浓缩状态,RHOC基因的转录受到抑制;当RHOC基因启动子区DNA发生甲基化后,KLF4可以与之结合,引起RHOC启动子区的染色质发生重塑,染色质由原来高度浓缩的状态变为疏松且开放的状态,从而激活RHOC基因的表达[48]。因此,推测高脂系肉鸡腹部脂肪组织中TCF21基因启动子R2和R3区域的高甲基化可能改变了某些转录因子与该区域的结合,影响了该区域组蛋白的修饰水平,增强了染色质可及性,进而促进了TCF21基因的表达,但具体机制有待进一步研究。
本研究在分析鸡前脂肪细胞中DNA甲基化是否影响TCF21基因启动子的转录活性时发现,鸡TCF21基因启动子R2区域和R2+R3区域的DNA高甲基化导致了报告基因活性的显著降低,而鸡TCF21基因启动子R3区域的DNA高甲基化没有改变报告基因活性(图7B)。这一结果与鸡腹部脂肪组织中TCF21基因启动子R2、R3、R2+R3区域的DNA甲基化水平与TCF21基因mRNA表达水平呈显著正相关的结果并不一致,分析其原因可能有4个:1)两个试验所用的试验材料不同。检测TCF21基因启动子区DNA甲基化水平及mRNA表达水平时所用的试验材料为鸡脂肪组织,而检测DNA甲基化对TCF21基因启动子的转录活性的影响时所用的试验材料为鸡前脂肪细胞(ICP1细胞)。脂肪组织除了包含成熟脂肪细胞和前脂肪细胞外,还含有成纤维细胞、血管内皮细胞和多种免疫细胞[49],而ICP1细胞是单纯的前脂肪细胞。2)两个试验中,TCF21基因启动子DNA所处环境不同。脂肪组织中TCF21基因的启动子是由组蛋白包裹的DNA片段,而在荧光素酶报告基因载体中,TCF21基因的启动子是裸露的DNA片段。3)TCF21基因在鸡脂肪组织中可能受增强子的调控,而本研究在构建荧光素酶报告基因时只是连接了鸡TCF21基因的启动子,并没有连接增强子到报告基因载体中。4)两个试验中,TCF21基因启动子的DNA甲基化模式不同。体内脂肪组织中TCF21启动子区CpG位点的甲基化状态受DNA甲基转移酶、DNA去甲基化酶等表观修饰因子的动态调控,而体外DNA甲基转移酶处理报告基因质粒是对TCF21启动子区的CpG位点进行强行甲基化,这与体内脂肪组织中TCF21基因的甲基化模式是不一样的。
有研究表明,CpG位点的甲基化会影响DNA序列与转录因子的结合状态,进而影响基因的表达[50-52]。本项研究报告基因结果显示,鸡TCF21基因启动子R2区域及R2+R3区域的DNA甲基化会抑制其转录活性,而无论是R3区域单独存在还是与R2区域共同存在,R3区域的DNA甲基化均不会影响其转录活性(图7B、7C)。因此,本研究将目光聚焦在了TCF21基因启动子的R2区域。将R2区域内潜在的转录因子(Pax2、Sox10、FOS、SPIB与FOXP3)与该区域内的与TCF21基因表达显著相关的CpG位点(CpG_7和CpG_10)进行联合分析发现CpG_7位于Pax2的结合位点内,提示CpG_7位点的甲基化可能通过改变转录因子Pax2与TCF21基因启动子R2区域的结合来影响TCF21基因的转录。
综上所述,组织水平的研究结果显示TCF21基因启动子R2和R3区域的DNA甲基化水平与其mRNA表达水平显著相关;细胞水平的研究结果显示TCF21基因启动子R2区域的DNA甲基化会影响其转录活性,但R3区域的DNA甲基化对其转录活性没有影响。
4 结 论
结合组织水平、细胞水平的研究结果,本研究表明:TCF21基因在7周龄高、低脂系肉鸡腹部脂肪组织中的差异表达主要与其启动子R2区域的DNA甲基化水平有关,但具体调控机制有待进一步深入的研究。

