皱皮香猪HAS2基因SNPs的鉴定及生物信息学分析
吴行雕,石道宏,黄世会,牛 熙,李 升,王嘉福,冉雪琴*
(1.贵州大学动物科学学院,贵阳 550025;2.农业生物工程研究院,贵阳 550025)
皮肤是哺乳动物最大的器官,构成机体免受物理、生物和化学损害的第一道屏障。同时皮肤还参与机体感受外界刺激、分泌、排泄、物质的吸收、调节体温、参与新陈代谢和免疫反应等生理功能[1]。猪HAS2基因位于猪4号染色体上,基因全长4 378 bp,共有4个外显子,编码552个氨基酸,其功能是编码透明质酸合成酶2。HAS2是3种 特征性的膜包埋HA合成酶,是原代细胞和完整间皮中含量最丰富的酶类。HAS2负责从细胞内前体合成高分子量的HA,具有维持组织结构和体液平衡的重要作用,在机体组织扩张和生长过程中意义重大[2]。透明质酸(HA)是大多数动物组织细胞外基质(ECM)的线性高分子糖胺聚糖,在调节细胞间黏附[3]、迁移[4]、分化[5]和增殖[6]等方面发挥重要作用。
对沙皮犬和裸鼹鼠皮肤表型的研究证明,沙皮犬的透明质酸合成酶2(hyaluronan synthase 2,HAS2)上游约253 kb处有一段16.1 kb的不稳定重复,导致HAS2基因异常高表达,产生过量的透明质酸,透明质酸沉积,出现大量的皮肤褶皱[7]。裸鼹鼠NMR成纤维细胞分泌超高分子量的透明质酸(HA),是人或小鼠HA的5倍以上。哺乳动物的HAS2蛋白序列高度保守[8],但裸鼹鼠HAS2基因发生了突变,使保守的天冬氨酸突变为丝氨酸,可能是裸鼹鼠HMM-HA过度积累的原因[9]。说明HAS2基因的变异与皮肤皱褶的产生关系密切。
研究表明,对皮肤发生极厚折叠患有黏蛋白沉着症的1名儿童的研究发现,其皮肤中沉积的黏液物质主要为多糖透明质酸(HA)[10]。HAS2的过表达在人、狗、鼠、鸡、猪等生物体内存在且主要与一些疾病、复杂性状及物种进化相关[11]。如HAS2的过表达在22~24期胚胎雏鸡翼芽间质细胞中阻止了在微团培养和随后的软骨形成过程中的凝结事件[12]。在乳腺癌细胞中,高水平的HA及其CD44受体通常与雌激素信号传导的改变有关,HAS2的过表达增加了ERα Ser118的磷酸化以及雌激素的转录活性[13]。此外,HAS2的过表达促进体外乳腺癌细胞的侵袭[14]和体内乳腺肿瘤的生长[15-16]。对HMM-HA具有预防癌症和增强皮肤弹性的研究发现,HMM-HA在裸鼹鼠中是由HAS2基因的一个独特的修饰功能发生改变产生的[17-18]。在大鼠间皮细胞中HAS2的过表达可诱导形成长而多的微绒毛样细胞突起,对大鼠组织和体液的正常功能和维持至关重要[19]。对老年小鼠MV中HA水平随年龄增长而升高机制的研究表明,HAS2的mRNA和蛋白表达增加了,导致HA在脑MV中合成和积累增加,改变了神经炎症的环境,并促进了与年龄相关的脑微血管密度和功能的改变[20]。这些研究结果提示,HAS2的过表达导致HA合成和积累的增加可能与动物疾病相关。
香猪是中国特有的小型地方猪种之一,香猪额头有菱形或“川”字形褶皱,而躯干部一般无明显褶皱[21]。皱皮香猪是从正常香猪中分离出来的变异群体,其皮肤表现为全身密布褶皱。皱皮香猪亲本交配所产F1代仔猪中,大约三分之一个体有皱皮表现,说明皱皮性状可以遗传给后代[22]。皱皮香猪主要的特征是个体躯干部皮肤增厚并出现大量的条纹状褶皱,皮肤粗糙发红无明显弹性且个体生长减慢。为了探究皱皮香猪个体产生皮肤褶皱的原因,本研究主要针对HAS2基因编码区进行研究,探讨香猪皮肤褶皱发生的分子遗传机制。
1 材料与方法
1.1 试验材料
30头皱皮香猪(XPZ)和100头正常香猪(XP)耳组织样品均采自贵州大山地生态养殖有限责任公司的猪场。以上香猪耳组织均采用上海生工生物工程(上海)股份有限公司生产的血液/组织基因组提取试剂盒,参照基因组提取试剂盒说明书提取样品基因组DNA,质检合格后保存于-20 ℃备用。
1.2 主要试剂与仪器
血液/细胞/组织基因组DNA提取试剂盒、2×Taq PCR Master Mix均购自北京天根生化科技有限公司;Thermo Cycler PCR仪、电泳仪和凝胶成像系统均购自Bio-Rad公司;高速台式离心机购自美国贝克曼库尔特公司。
1.3 基因片段扩增和SNP位点分析
在NCBI上下载HAS2基因序列(GenBank登录号:NC_010446.4),采用Primer Premier 5.0设计引物序列,引物由生工生物工程(上海)股份有限公司合成(表1)。以基因组DNA为模板进行PCR检测,使用20 μL反应体系:基因组DNA 1 μL,10 pmol·L-1的上、下游引物各0.5 μL,2×Taq PCR Master Mix 10 μL,ddH2O 8 μL。PCR扩增条件:95 ℃预变性10 min;95 ℃变性30 s,(51~61)℃退火30 s,72 ℃延伸30 s,共34个循环;72 ℃延伸10 min;4 ℃保存。PCR产物进行1.5%琼脂糖凝胶电泳检测,胶回收后,扩增片段由擎科生物科技有限公司进行核苷酸序列测定。
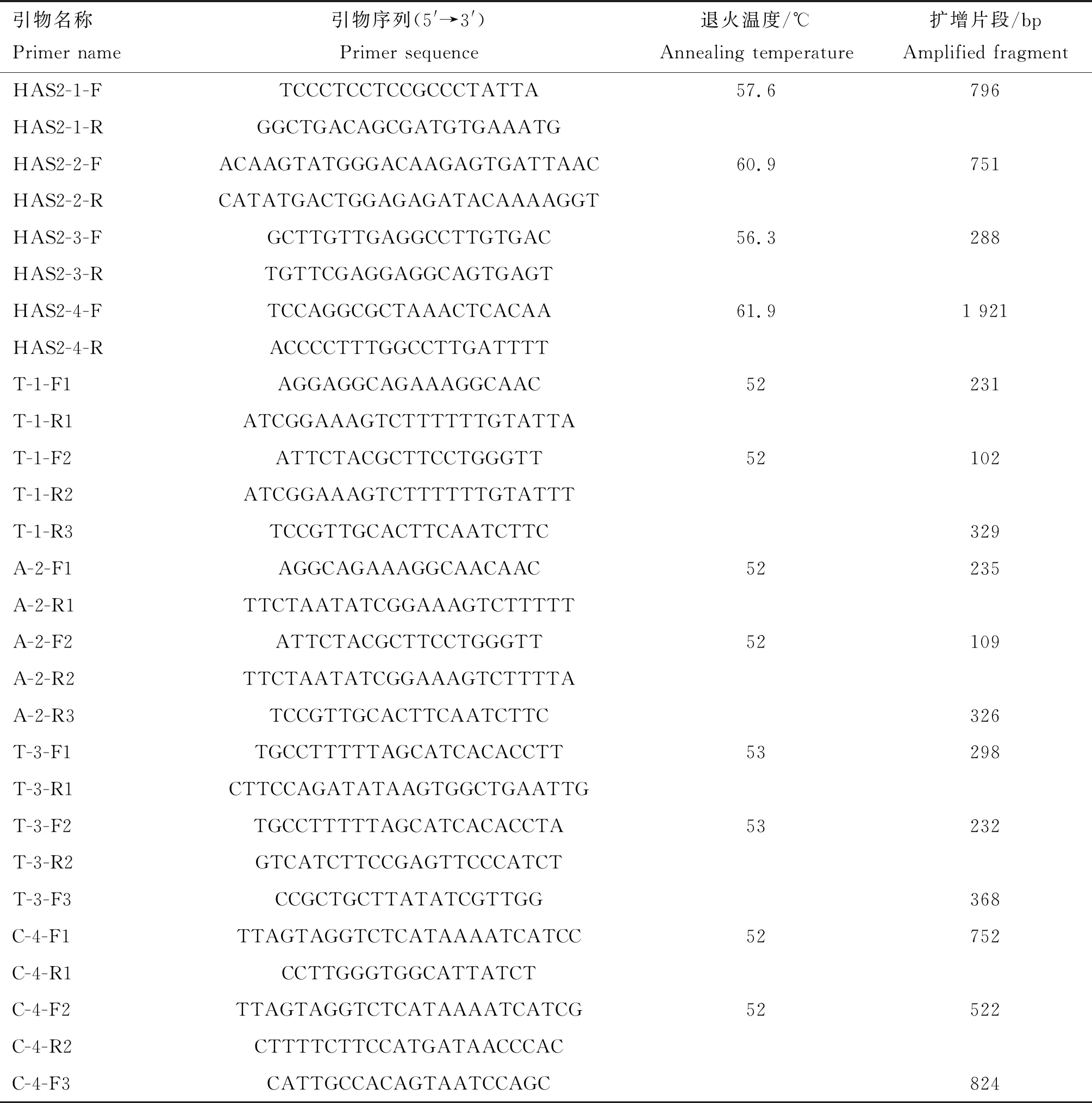
表1 引物序列Table 1 Primer sequence
1.4 HAS2基因mRNA二级结构和蛋白质高级结构预测
利用在线软件RNAfold(http://rna.tbi.univie.ac.at/cgibin/RNAWebSuite/RNAfold.cgi)对HAS2基因突变前后编码区序列mRNA二级结构进行分析;利用在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测和分析HAS2基因编码区突变前后蛋白质的二级结构;利用在线软件SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测HAS2基因编码区突变前后蛋白质的三级结构。
1.5 HAS2基因密码子偏好性的分析
利用CondoW软件和Codon Usage Database数据库(htt://www.kazusa.or.ip/codon/)对HAS2基因编码区序列密码子进行分析。
1.6 遗传多态性分析
应用Megalign和Seqman软件对香猪HAS2基因原序列与测序峰图进行序列比对分析,确定SNPs位点。应用Excel软件分别计算不同位点在受试群体中的基因型频率、等位基因频率、有效等位基因数(Ne)、群体遗传纯合度(Ho)和多态信息含量(PIC),运用在线软件SHEsis(http://analysis.bio-x.cn/myAnalysis.php)和Paploview(Version 4.2)软件计算SNPs的连锁不平衡参数,分析多态位点是否偏离哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)状态,并构建单倍型。
1.7 基因变异的群体遗传学分析
采用SPSSv20.0卡方检验分析4个SNPs位点在群体间的分布差异。等位基因频率计算公式为P=X/M。式中,P表示SNP位点基因型频率,X、M分别表示基因型数和样本总数。
2 结 果
2.1 基因编码区扩增
以香猪HAS2基因DNA为模板对第1~4外显子进行PCR扩增,扩增产物经1.5%的琼脂糖凝胶电泳检测(图1),应用HAS2-1引物对扩增796 bp的外显子1区域,HAS2-2引物对扩增751 bp的外显子2区域,HAS2-3引物对扩增288 bp的外显子3区域,HAS2-4引物对扩增1 921 bp的外显子4区域。
PCR检测片段的大小与预期目的片段大小一致,特异性良好,达到测序标准。目的片段经胶回收后测序,测序结果与GenBank数据库中HAS2基因(NCBI accession No.:AEMK02000022)4个外显子收录的序列一致。
2.2 碱基序列和变异位点分析
将普通香猪和皱皮香猪PCR扩增产物胶回收克隆后进行测序,应用DNAStar软件中Seqman程序将测序结果与NCBI中公布的猪HAS2基因(NCBI accession No.:AEMK02000022)进行序列比对,在猪HAS2基因外显子区挖掘得到4个SNPs位点。结合测序峰图(图2),4个SNPs位点参照猪HAS2基因mRNA完整序列(RefSeq:NM_214053.1)分别命名为T221A、A228G、T183C和C537T。T221A位于第1外显子中,定位于CDS区第211位碱基,碱基T突变为A,可导致亮氨酸替换为赖氨酸。A228G 位于第1外显子中,定位于CDS区第228位碱基,碱基A突变为G为同义突变。T183C和C537T位点分别定位于第2外显子CDS区第183位和第4外显子CDS区第537位碱基,碱基T突变为C、C突变为T,都为同义突变位点。
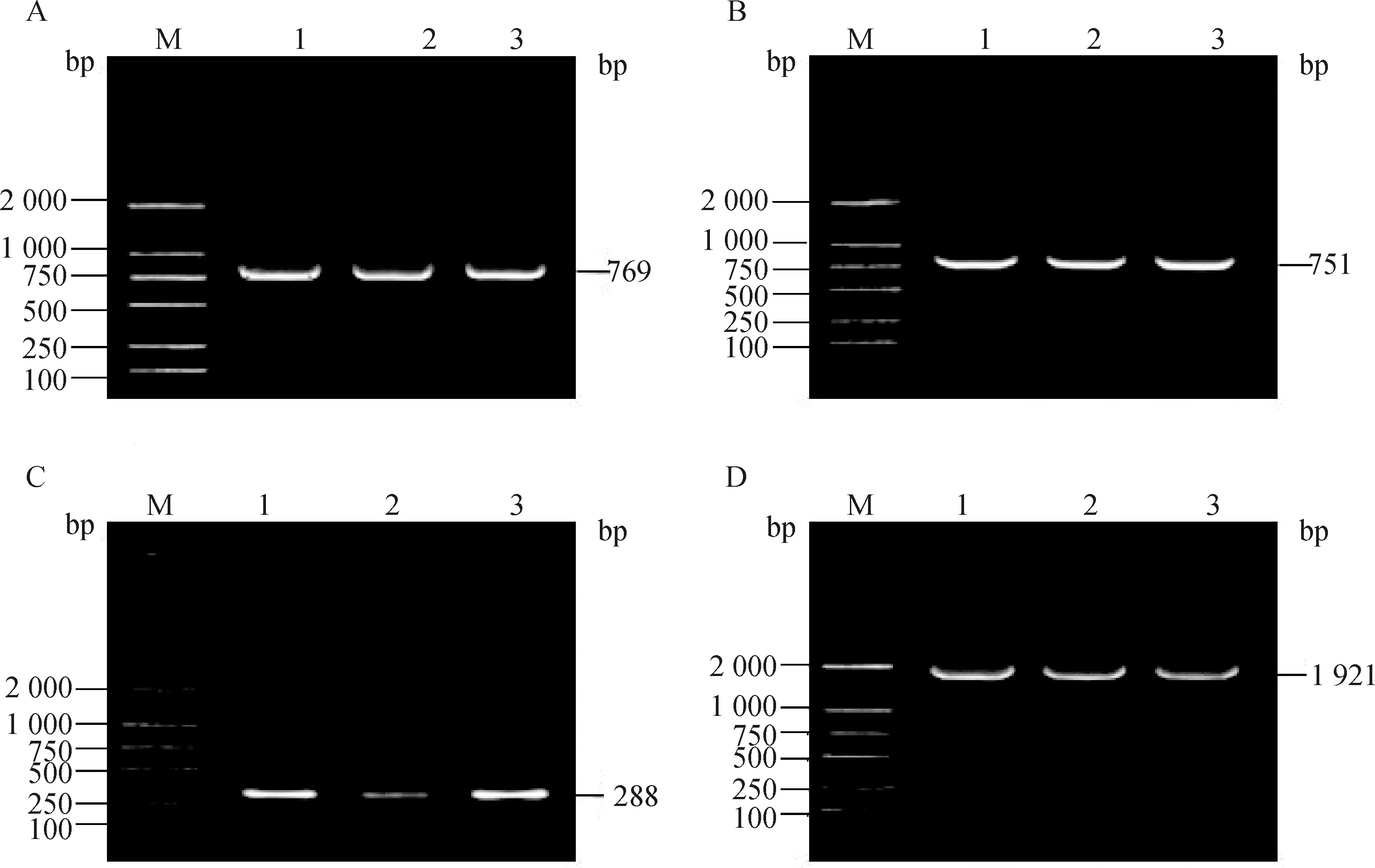
A.第一外显子;B.第二外显子;C.第三外显子;D.第四外显子。M.DNA相对分子质量标准;1.普通香猪;2~3.皱皮香猪A.Exon 1;B.Exon 2;C.Exon 3;D.Exon 4.M.DL2000 marker;1.XP;2-3.XPZ图1 香猪HAS2基因外显子区PCR扩增产物琼脂糖电泳检测Fig.1 Detection of exon regions in HAS2 gene of Xiang pip using PCR method by agarose gel electrophoresis
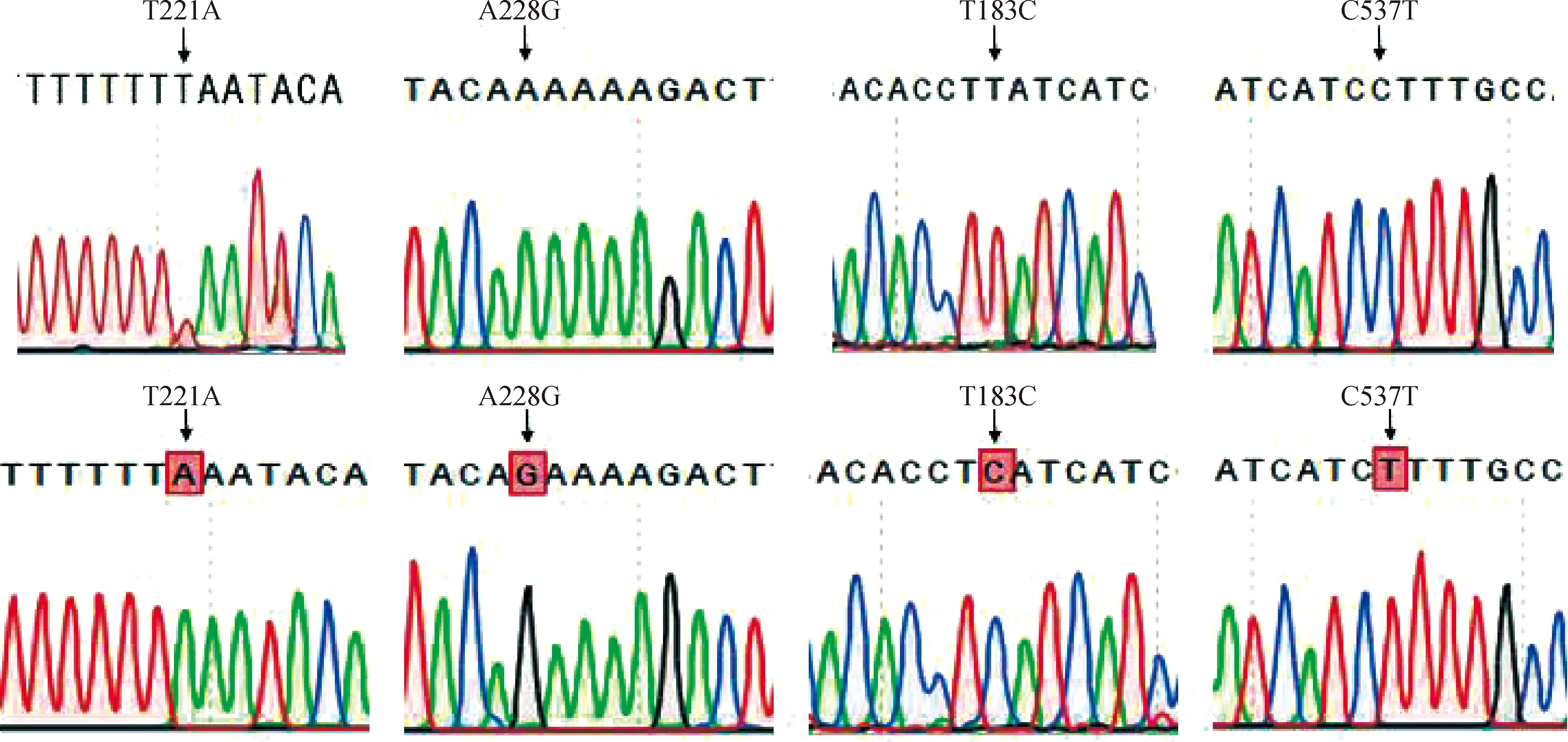
图2 HAS2基因SNPs鉴定Fig.2 SNPs identification of HAS2 gene
2.3 HAS2基因SNP位点对mRNA二级结构的影响
HAS2基因外显子1上的T221A和A228G 2个 突变位点组合对mRNA序列二级结构影响的预测结果见图3。T221A和A228G 位点在mRNA二级结构中都位于环上,TA组合mRNA序列结构的自由能为-573.29 kJ·mol-1,TG组合的自由能为-580.89 kJ·mol-1,AA组合的自由能为-571.03 kJ·mol-1,AG组合的自由能为-572.66 kJ·mol-1,稳定性为:AA>AG>TA>TG,TG与参考基因组收录的序列相同,突变碱基使mRNA的自由能和稳定性降低。
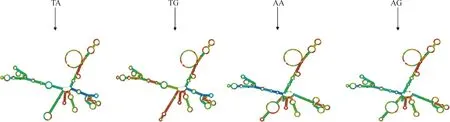
图3 HAS2基因T221A和A288G位点对mRNA二级结构的影响Fig.3 The effects of T221A and A288G loci of HAS2 gene on the secondary structure of mRNA
2.4 HAS2基因变异对蛋白质结构的影响
对T221A位点突变导致氨基酸序列出现亮氨酸替换为赖氨酸后蛋白质一级结构(表2)、二级结构(表3)和三级结构(图4)的变化进行预测,亮氨酸替换为赖氨酸后,蛋白质一级结构的等电点由9.37变为9.49,不稳定系数由51.97变为50.69,脂肪系数由75.19变为73.06,总平均亲水性由-0.345变为-0.387。蛋白质二级结构中的α螺旋由35.52%变为32.97%,自由卷曲由43.17%变为44.51%,β转角由6.56%变为6.59%,延伸链由14.75%变为15.93%,三级结构预测结果(图4)与二级结构发生变化相一致。
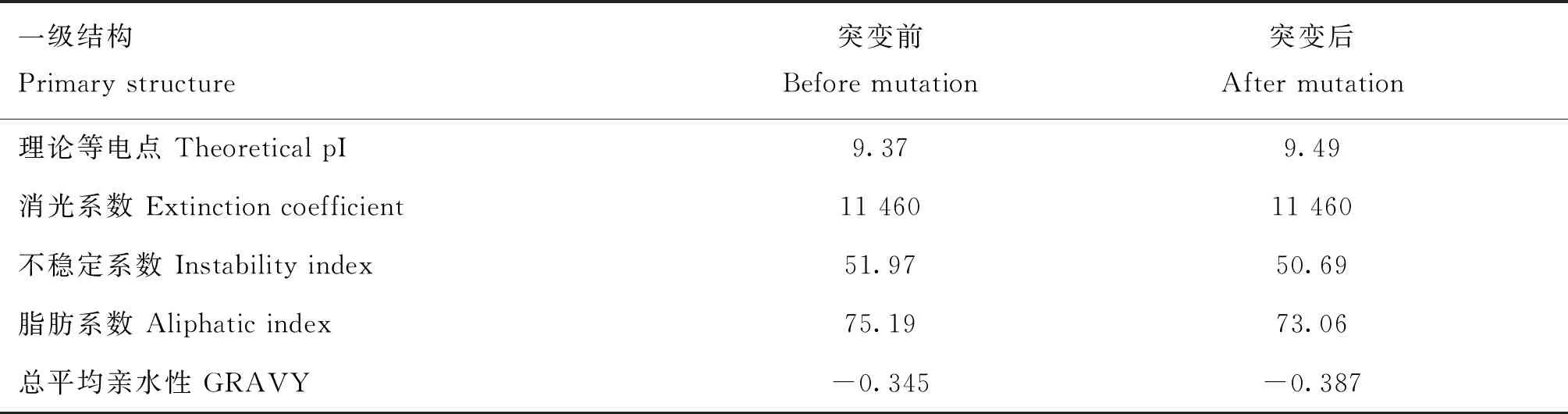
表2 T221A错义突变对HAS2蛋白质一级结构的影响Table 2 Effect of T221A missense mutation on the primary structure of HAS2 protein
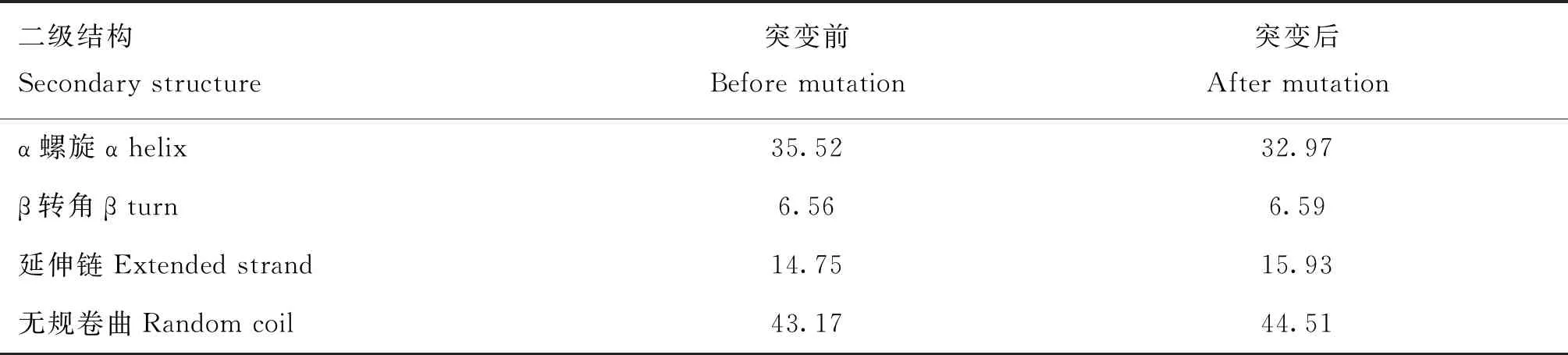
表3 T221A错义突变对HAS2蛋白质二级结构的影响Table 3 Effect of T221A missense mutation on the secondary structure of HAS2 protein %
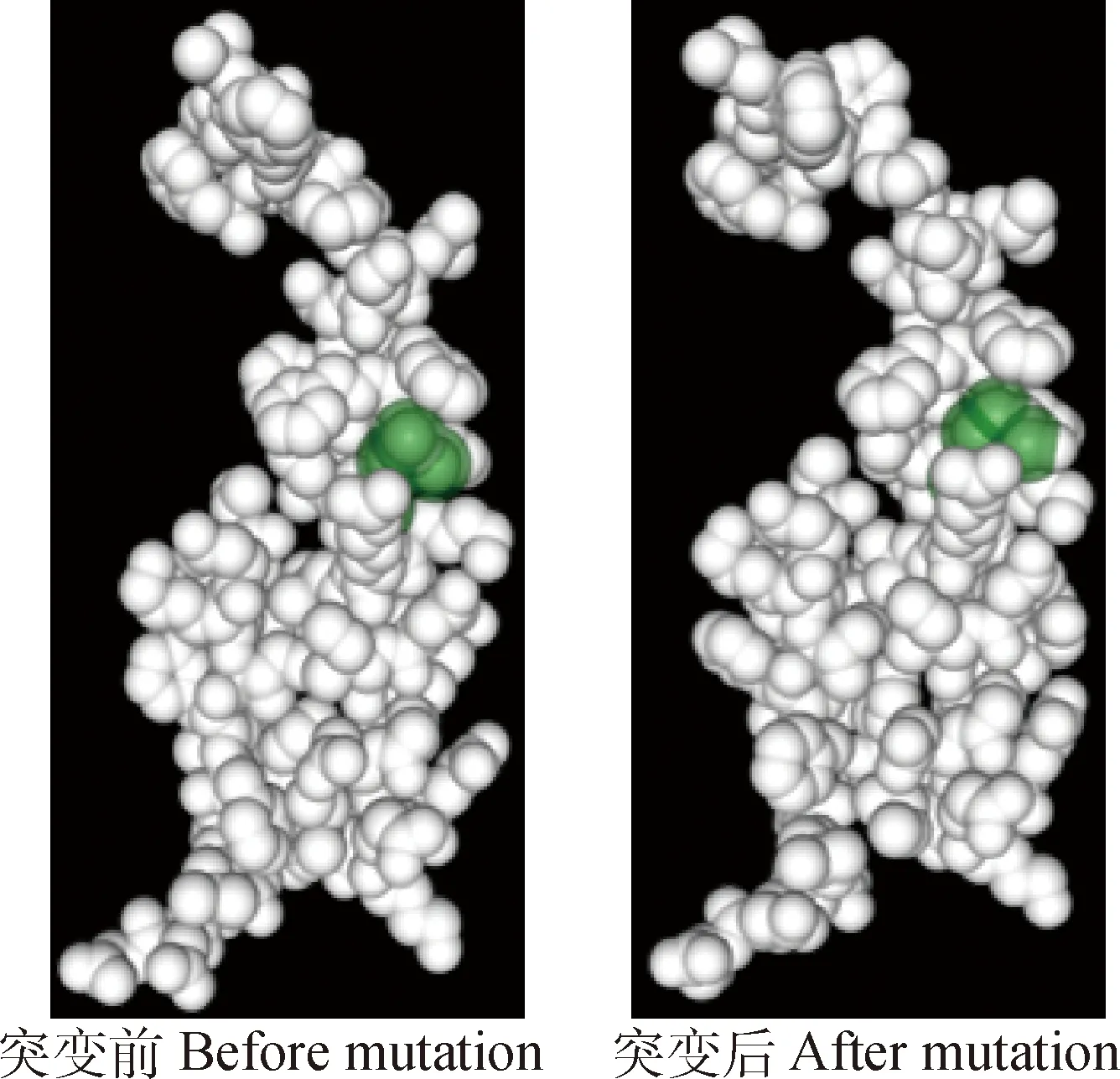
图4 T221A位点错义突变对HAS2蛋白质三级结构的影响Fig.4 Effect of T221A missense mutation on the tertiary structure of HAS2 protein
2.5 密码子偏好性分析
A228G、T183C和C537T位点分别位于HAS2基因外显子1、2和4中产生同义密码子突变:CAA→CAG、CTT→CTC和TCC→TCG。使用CondonW软件对香猪HAS2基因的密码子特性进行分析。RSUC值即单个密码子使用频率占总体的百分比,当某一密码子的RSCU大于1时,代表该密码子为使用相对较多的密码子,反之亦然。通过密码子(codon usage database)数据库查找猪的2 953个CDS区的1 168 059个密码子,A228G位点谷氨酰胺同义密码子中CAA(RSCU=1.45)相对CAG(RSCU=0.5)偏好性较强,T183C位点亮氨酸同义密码子CTT(RSCU=0.65)和C537T位点丝氨酸同义密码子TCC(RSCU=0.42)无偏好性。
2.6 SNPs位点的基因型频率及遗传多态性分析
对各SNP位点进行AS-PCR方法检测,扩增产物经2%的琼脂糖凝聚电泳分离(图5)。4个SNPs位点经测序所得的基因型与AS-PCR所得基因型完全一致。依据AS-PCR引物设计策略将F1/R2扩增出的片段定义为T基因,F2/R2扩增出片段定义为A基因。T221A位点基因型在香猪中以TA型为主,计算等位基因频率(表4),皱皮香猪群的A等位基因频率显著高于普通香猪群(P<0.05)。A228G位点基因型在香猪中以AA和AG型为主,皱皮香猪群的G等位基因频率极显著高于普通香猪群(P<0.01)。T183C和C537T两个位点在香猪中均以TC/CT型为主,C/T等位基因频率差异不显著(P>0.05)。
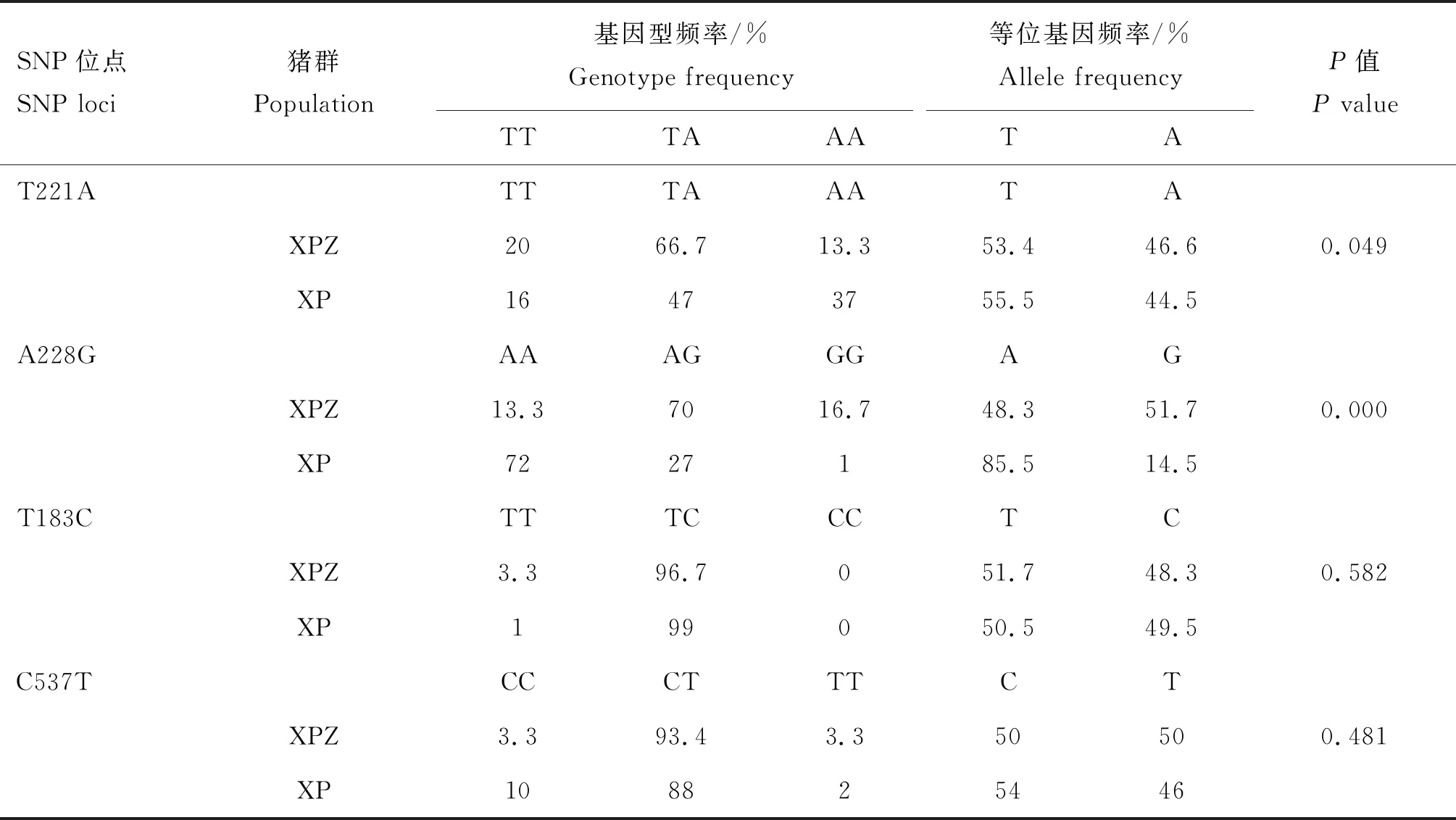
表4 两个猪群SNPs位点的基因型频率和等位基因频率Table 4 Genotype frequency and allele frequency of SNP loci in two pig populations
对T221A、A228G、T183C和C537T位点的多态性进行分析(表5),试验群体中4个SNPs位点的纯合度均较高,香猪和皱皮香猪中 T221A、T183C和C537T位点的多态信息含量分别为0.363 7和0.375 0、0.374 9和0.373 9、0.373 4和0.375 0,均表现为中度多态(0.25
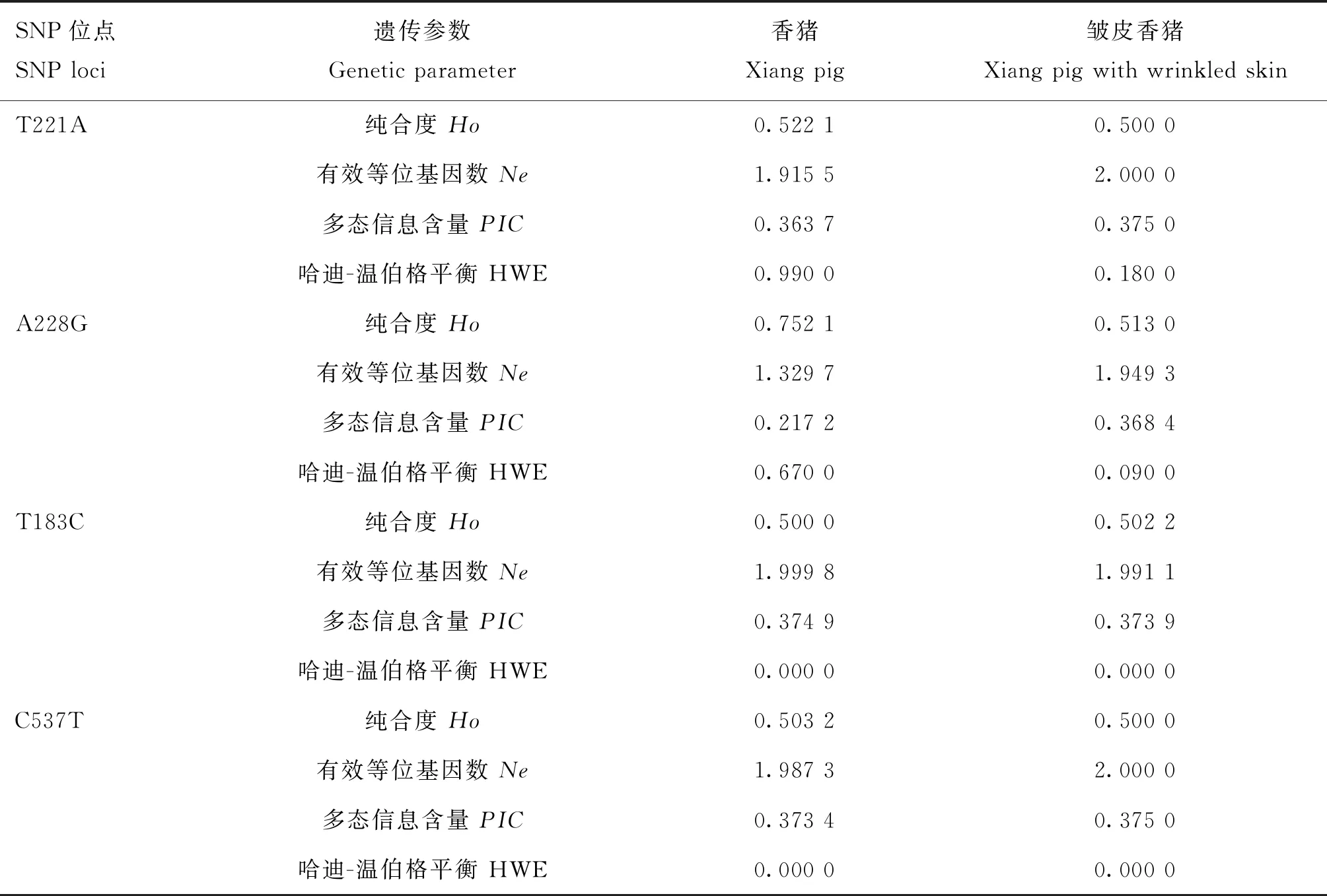
表5 HAS2基因4个SNPs位点的多态性参数分析Table 5 The genetic parameters at 4 SNPs loci of HAS2 gene
2.7 连锁不平衡分析与单倍型构建
采用SHEsis在线软件对HAS2基因T221A和A228G位点进行连锁不平衡参数估计及单倍型构建。结果显示,2个SNPs位点间仅在皱皮香猪群体中处于连锁不平衡状态(r2=0.253,表6),2个位点间可构建4种单倍型:A-A、A-G、T-A和T-G(表7),皱皮香猪中以T-A和T-G单倍型为主,频率分别为27.5%和27.5%,T-A单倍型频率在2个群体间的差异极显著。

表6 HAS2基因2个SNPs位点间的连锁不平衡分析Table 6 Linkage disequilibrium parameters estimation between 2 SNPs loci of HAS2 gene

表7 HAS2基因2个SNPs位点间的单倍型构建Table 7 Haplotype establishment in 2 SNPs loci of HAS2 gene
3 讨 论
研究猪皮肤性状、生长发育和皮肤病理变化等生命规律可为人类医学相关研究提供重要的借鉴。猪和人的DNA相似度高达83%,猪皮肤在形态结构上跟人类皮肤相近,可作为人类皮肤代替物[23]。如用猪皮作为人类烧伤皮肤的异种植皮来源,猪皮可作为人类皮肤替代物进行药物试验或模拟治疗[24]。为了更好地了解猪皮肤的性状表型和生长发育规律,本研究以深入了解皱皮香猪皮肤褶皱的变化规律和探究其分子遗传控制机理为出发点,开展相关猪皮肤褶皱的研究工作。通过特异性PCR 方法克隆HAS2基因的外显子编码区,应用生物信息学方法分析测定基因编码区的碱基变异,在普通香猪和皱皮香猪资源群体中共筛选到HAS2基因的4个SNPs位点,分别为T221A、A228G、T183C和C537T,其中T221A属于错义突变,可导致亮氨酸(脂肪族类氨基酸)替换为赖氨酸(带正电荷的碱性氨基酸)。本研究利用AS-PCR对4个SNPs位点进行群体验证,在T221A和A228G两个位点检测到有多态性,在T183C和C537T位点没有检测到多态性。皱皮香猪中HAS2基因外显子1的两个碱基发生变异,即T221A和A228G,在皱皮香猪中的发生频率明显高于普通香猪。其中,T221A位点基因型在香猪群体中以TA型为主(P<0.05),皱皮香猪A等位基因的频率明显高于普通香猪;A228G位点基因型在香猪群体中以AA型为主(P<0.01),皱皮香猪G等位基因的频率显著高于普通香猪;T183C和C537T位点基因型在香猪群体中均以杂合TC基因型为主,皱皮香猪C和T等位基因频率与普通香猪没有明显差异(P>0.05)。单个SNP基因座一般只有二态,采用多个SNPs位点进行单倍型分析,可提高分子标记与QTL的连锁程度,比单个SNP位点的研究更有价值[25]。在本研究中,T221A和A228G位点在皱皮香猪群体中紧密连锁(r2=0.253)。
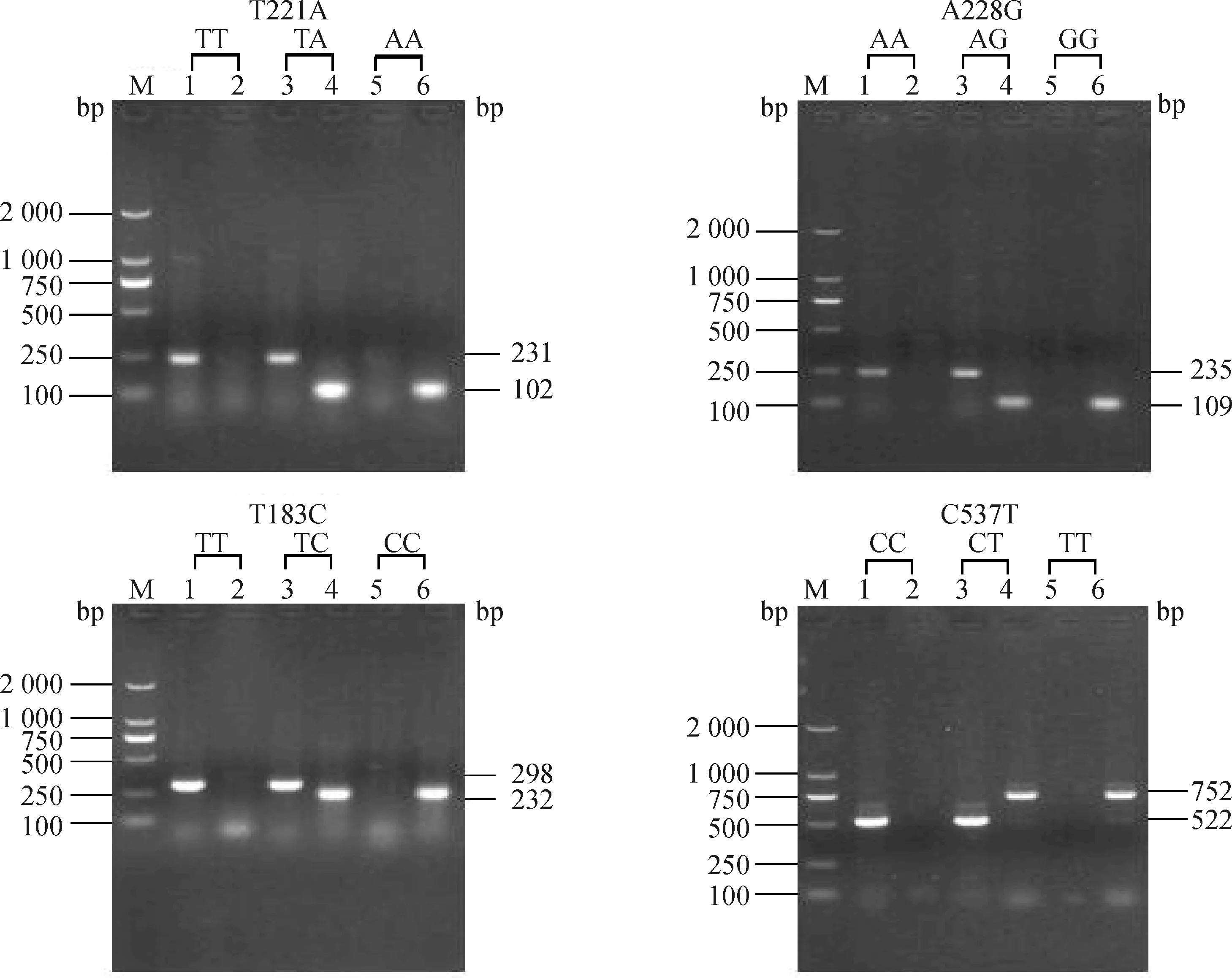
M.DNA相对分子质量标准;1~6.AS-PCR引物扩增产物M.DL2000 DNA marker;1-6.The amplified products by AS-PCR primer图5 AS-PCR扩增Fig.5 AS-PCR amplification
最近研究表明,基因mRNA一级结构和二级结构稳定性的变化在翻译过程中具有调节作用[26],研究发现该调节过程形式较为复杂,但最终表现为对蛋白质表达量显著正相关调控,且这种正相关不受mRNA结构、丰度等其它因素的影响[27]。本研究中,T221A和A228G位点突变后的碱基可降低皱皮香猪HAS2基因mRNA的自由能值和二级结构的稳定性,同时发生的氨基酸替换增加了蛋白的电荷量,可能引起蛋白二级结构和三级结构发生变化,影响酶的活性,进而影响HA的合成,可能与皱皮香猪全身性皮肤的不均匀增厚并发生褶皱有关。通过查找同源基因比对和NCBI中的SNP数据库发现,T221A、A228G和C537T变异位点在猪和其它物种HAS2基因中没有被报道过,推测3个SNPs位点是新发现的猪变异位点。在检测到的4个SNPs位点中,T183C位点是已知的。T183C位点位于猪chr4:17596662上,编号为rs319553912。该变异位点在其它猪种和物种HAS2基因中有被标记,如在欧洲猪、二花脸猪、浦东白猪以及人、猫、鼠、狗、牛等中均被检测到。推测T183C位点在猪和其它物种中普遍存在且突变没有引起氨基酸改变,可能对遗传性状表型的影响较小[28-29]。群体检测结果表明,T221A和A228G位点在普通香猪与皱皮香猪群体中具有变异程度大、多态含量丰富的特点,便于群体中有利基因型的定向选择。其在今后可作为皱皮香猪的分子标记,以剔除群体中的皱皮基因。
用微卫星标记进行了猪皮肤褶皱和厚度性状的连锁分析,发现在二花脸猪的F2代资源群体4号染色体上的107 cM处有1个主效QTL位点与皮肤褶皱性状相关[30]。沙皮犬全基因组单核苷酸多态性分析表明,在13号染色体HAS2基因的上游约253和350 kb处有一段16.1 kb的不稳定重复序列,该独特区域包含一个或多个改变HAS2表达的调控元件[31]。似乎随着复制拷贝数的增加,复制中潜在增强子元件的拷贝数也会增加,可能导致HAS2基因异常高表达,产生过量的HA,导致透明质酸沉积,出现大量的皮肤褶皱[32]。在裸鼹鼠HAS2基因外显子2和4上发现2个SNPs,导致细胞质结构域高度保守的两个天冬氨酸被丝氨酸替换致使HAS2分子产生HMM-HA,导致HA在皮肤中过度积累而引起皮肤表型的改变[33]。这些研究结果提示,在皱皮香猪HAS2基因外显子2上发现的2个碱基变异可能与皱皮香猪全身性皮肤不均匀增厚并发生褶皱有关。
研究发现,影响皮肤褶皱形成的原因很多,在雌性个体中,HAS2基因的表达调控雌激素的水平,而雌激素水平影响着皮肤皱褶的形成[34]。人HAS2基因编码一种制造透明质酸的酶,透明质酸浓度的变化与许多病理情况有关,包括皱纹、创伤、几种炎症性疾病和恶性肿瘤[35]。皮肤细胞外基质的改变也可能与皮肤褶皱有关,外源性透明质酸片段通过与受体蛋白如CD44和RHAMM结合来影响细胞行为[36]。在炎症和特定组织重构过程中,TSG-6蛋白可催化IαI重链结构域共价转移至HA导致细胞周围环境的物理化学控制发生变化[37-38],HA片段在与蛋白质的结合相互作用中竞争,改变生物基质的完整性。HA片段可以取代与细胞表面受体相互作用的大分子物质,导致受体聚集和信号改变[39],片段也可以通过交替的受体[40-41]发出信号。因此,HA可被视为细胞微环境破坏过程中的生物传感器,改变高刺激和低刺激组的细胞反应机制。在组织重塑过程中,包括皮肤褶皱的形成、伤口愈合和肿瘤发生都与HA含量和大小的变化有关[42-44]。这些研究表明,引起HAS2基因过表达导致HA在皮肤细胞外基质或组织中积累的影响因子与皮肤病或其它疾病的发生发展有着密切的关系,提示皱皮香猪HAS2基因发生单碱基变异可能通过密码子的偏好和mRNA的稳定性影响基因的表达量从而影响酶的活性,进而影响HA的合成,可能与皱皮香猪全身性皮肤不均匀增厚并发生褶皱有关。
4 结 论
本研究结果提示,在皱皮香猪中发现了3个新的SNPs位点,分别是位于外显子1上的T221A错义突变(导致亮氨酸替换为赖氨酸)、A228G及外显子4上的C537T同义突变,2个外显子突变可引起mRNA自由能和蛋白结构的变化。T221A和A228G位点在香猪群中呈多态性变化且等位基因频率在皱皮香猪与普通香猪群体中存在明显差异,皱皮香猪A和G等位基因频率显著高于普通香猪,T221A和A228G位点构成的单倍型T-A在皱皮香猪群体中紧密连锁。HAS2基因的T221A和A228G位点变异可能导致透明质酸合成酶2过表达产生过量的透明质酸,引起猪皮肤产生褶皱。两个位点可作为影响皱皮香猪皮肤褶皱性状的分子标记。

