过敏性鼻炎患者外周血调节性B细胞的变化
范湘宜,汪曌,陈冬
(1.锦州医科大学附属第一医院耳鼻咽喉头颈外科,辽宁 锦州 121000;2.同济大学附属上海市第四人民医院耳鼻咽喉科,上海 200000)
过敏性鼻炎(allergic rhinitis,AR)是一种主要由免疫球蛋白E(IgE)介导的鼻粘膜炎性疾病[1]。全球超过5亿人患有过敏性鼻炎,AR可使人们产生打喷嚏、流鼻涕、鼻塞和鼻瘙痒等症状,甚至诱发过敏性哮喘,严重影响人们的日常生活[2]。
传统观点认为过敏性鼻炎的免疫学机制主要由Th1/Th2细胞的失衡造成,Treg及Th17等辅助性T细胞也参与其中[3],但具体机制尚不明确。最近,一种能够分泌白细胞介素10(IL-10)抑制炎症反应的特定的B细胞亚群被发现,被称为调节性B细胞[4]。其可以通过产生IL-10、TGF-β、BAFF等有调节功能的细胞因子,或通过细胞间直接接触的方式来调节T细胞免疫应答[5]。但调节性B细胞在AR中的具体作用机制鲜有报道。
本研究应用流式细胞术检测过敏性鼻炎患者外周静脉血Breg细胞的比例,探讨Breg细胞的变化在AR中的作用。
1 对象与方法
1.1 研究对象
选取就诊于锦州医科大学附属第一医院对尘螨过敏的AR患者,AR的诊断依据《变应性鼻炎及其对哮喘的影响》(ARIA)指南[6],即具有阵发性打喷嚏、鼻痒、流清水样鼻涕和鼻塞等典型症状,且血清特异性IgE(sIgE)检测尘螨阳性。纳入标准:年满18岁;进行过sIgE检测。排除标准:并发哮喘、鼻息肉、鼻窦炎等症状;1个月内曾患呼吸道感染疾病;近2周内服用过抗过敏药物者;患结核、肝炎等传染性疾病及其他全身性疾病。同时招募无上述典型临床症状且sIgE阴性的志愿者作为对照。每名患者及志愿者均需签署知情同意书。本实验经由锦州医科大学附属第一医院伦理委员会同意并备案。
1.2 主要实验试剂及仪器
FcR阻断剂(Human TruStain FcX)、APC/Cy7偶联抗人CD19抗体(APC-Cy7 CD19)、PE/Cy7偶联抗人 CD24抗体(PE-Cy7 CD24)、PerCp/Cy5.5偶联抗人CD27抗体(Percp-Cy5.5 CD27)均购自美国Biolegend公司。FACS Verse(3-laser,8color)流式细胞仪购自美国BD公司。
1.3 分组及临床标本收集
AR患者作为实验组(AR 组),健康志愿者作为对照组(HC组)。每名患者和健康对照者均抽取3 mL EDTA抗凝外周血,混匀抗凝,2 h内处理。
1.4 方法
流式细胞术检测外周血CD19+CD24+CD27+Breg细胞占CD19+Breg细胞的百分比
采集AR患者和健康对照者3 mL外周静脉血于EDTA抗凝管中,应用Ficoll法分离外周血单个核细胞(PBMCs),加入Human TruStain FcX震荡均匀,室温避光孵育15 min。分别加入APC/Cy7偶联抗人CD19抗体、PE/Cy7偶联抗人 CD24抗体、PerCp/Cy5.5偶联抗人CD27抗体,轻轻震荡混匀,室温避光孵育15 min。采用1×PBS清洗,室温1400 rpm洗涤5 min,弃上清。加1×PBS重悬至300 μL进行流式细胞检测。同时设置空白对照、各荧光抗体单标对照组,所有对照组样本按照荧光抗体标记样本操作流程依次进行。
1.5 统计学方法
采用统计软件SPSS 20.0分析数据,流式数据分析及代表图采用Flowjo(version 10.6),统计作图采用GraphPad Prism(version 6.0)。HC组和AR组年龄差异采用两独立样本t检验,健康人和AR患者性别差异采用χ2检验。健康人和AR患者之间Breg细胞含量用两独立样本非参数检验比较(Mann-WhitneyU检验):取P<0.05为差异具有统计学意义。
2 结 果
2.1 临床资料
通过纳入标准和排除标准及sIgE检测筛选出30例尘螨过敏的AR患者(AR组)和30例健康对照者(HC组)。AR组平均年龄(41.37±10.53)岁,HC组平均年龄(40.90±13.45)岁,差异无统计学意义(P=0.882);AR患者(男/女:18/12)和健康对照者(男/女:13/17)间性别差异亦无统计学意义(P=0.301),见表1。

表1 AR组和HC组的临床资料比较
2.2 AR组与HC组外周血中CD19+CD24+CD27+Breg细胞比例比较
采用流式细胞技术检测AR组和HC组外周血中CD19+CD24+CD27+Breg细胞占CD19+B细胞的百分比(见图1)。AR组Breg(CD19+CD24+CD27+)细胞百分比(中位值M=17.95%)较HC组(中位值M=24.66%)降低(P<0.01,见图2),结果见表2。

表2 AR组与HC组实验数据比较汇总表
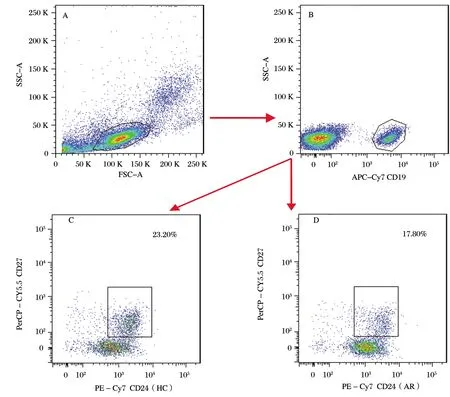
A:门内包含所有的外周血淋巴细胞;B:门内包含所有的CD19+B细胞;C(HC组)和D(AR组):门内包含所有的Breg(CD19+CD24+CD27+)细胞
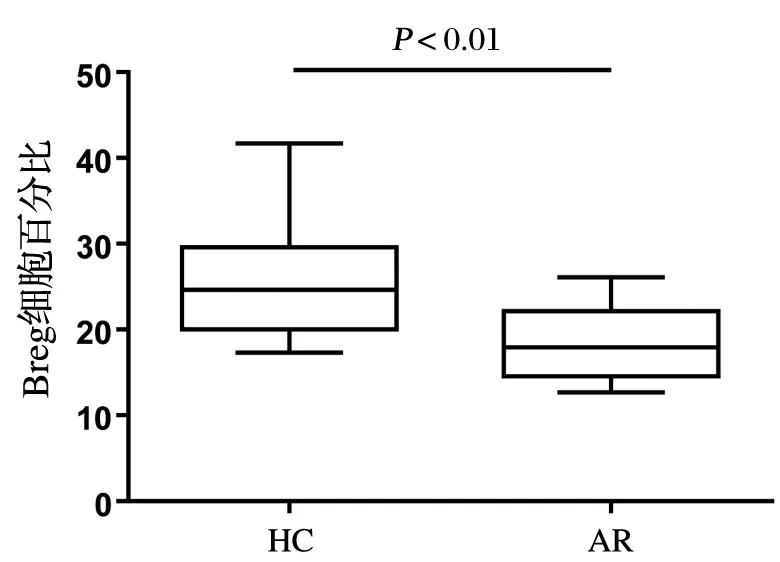
图2 HC组与AR组外周血中CD19+CD24+CD27+Breg细胞百分比的比较
3 讨 论
过敏性鼻炎是由多种炎症介质、细胞因子、趋化因子、神经肽和细胞等形成的一个复杂的网络共同体,引起鼻黏膜高反应。过敏性疾病的发病机制纷繁复杂,随着研究的不断深入,人们发现能够通过产生细胞因子或细胞间的直接接触来调节T细胞免疫应答的B细胞被称为调节性B细胞[7]。但是目前Breg细胞在AR中的研究甚少,具体机制尚不清楚。Breg细胞表面标志复杂多样,目前尚无特异性表面标志,并且不断有新的Breg细胞亚群被发现。迄今为止,已经描述了具有许多表型和效应子功能相似性的多个人类和小鼠的Breg细胞亚群,包括B10细胞,CD5+B1a细胞、CD5+CD1dhiB细胞、CD19+CD138+浆母细胞、CD1dhiCD5+CD19+B细胞、CD19+CD24+CD38+B细胞及CD19+CD24+CD27+B细胞等,在人类中主要是CD19+CD24+CD38+和CD19+CD24+CD27+两大类Bregs细胞[8]。经过大量文献检索及阅读,发现在过敏性疾病中对CD19+CD24+CD27+Breg的研究较多,因此,本实验检测的是CD19+CD24+CD27+Breg细胞亚群在AR外周血的比例变化。
Breg细胞在自身免疫疾病性疾病模型中具有调节功能,包括类风湿性关节炎、系统性红斑狼疮、多发性硬化等。有实验证实,类风湿性关节炎患者Breg细胞数量减少并伴有功能的减弱,与活动程度呈负相关。这种现象的产生是由于类风湿关节炎患者的Breg细胞失去了抑制Th17细胞的分化和将幼稚T细胞转化为功能性调节性T细胞的能力[9]。系统性红斑狼疮患者外周血CD19+CD24hi+CD27+Breg细胞水平明显下降,经药物治疗后,CD19+CD24hi+CD27+Breg细胞水平明显增加[10]。在对多发性硬化患者的研究中发现,其Breg细胞明显低于健康人,且与病情的严重程度相关,疾病越重 Breg细胞比例越低[11]。调节性B细胞通过控制各种效应细胞的比例和功能来减少免疫反应的发展,因此越来越受到关注。
过敏性疾病亦存在免疫失衡,在过敏性小鼠模型研究中证明,调节性B细胞可以通过foxp3阳性调节性T细胞预防和逆转过敏性气道炎症[12]。此外,AR鼠黏膜中Breg细胞比例低于正常对照组小鼠,提示在AR发生发展中,Breg细胞起到负性调节作用。Breg的增多可能通过抑制Th2反应来抑制AR的症状[13]。本实验结果显示,AR患者外周血中CD19+CD24+CD27+Breg细胞比例明显低于HC组,差异具有统计学意义(Z=4.251,P<0.01),与以上研究结果相似,提示Breg细胞在AR发生发展中起到重要作用。
Breg细胞能抑制效应T细胞如Th1和Th17细胞分化,同时促进Treg细胞扩增,参与Th17/Treg细胞免疫失衡的调节,抑制树突状细胞和巨噬细胞活化。这些效应除了由分泌细胞因子如IL-10、IL-35等介导外,还可以通过细胞之间膜结合分子包括PD-1、Fas、MHC-II、CTLA-4、ICOS等介导[14]。本实验虽发现AR患者外周血中 Breg 细胞的比例减少,但参与其免疫调节的相关因子有哪些以及具体的作用机制尚不明确,有待进一步研究。

