AR患者外周血中Th17细胞表面程序性细胞死亡受体-1的表达变化
柳先知,翟亚莉,陈冬
(1.锦州医科大学附属第一医院耳鼻咽喉头颈外科,辽宁 锦州 121000;2.商丘市第三人民医院耳鼻咽喉科,河南 商丘 476000)
过敏性鼻炎(AR)是指机体接触过敏原后由免疫球蛋E(IgE)为主要介导的鼻部变态反应性疾病,主要表现有鼻塞、鼻痒、连续性打喷嚏及大量水样涕[1]。目前AR的全球患病率约为10%~25%,对人们的生活质量及健康产生重大影响,已成为各国亟待解决的全球性社会问题。AR主要是一种 I 型变态反应性疾病,传统观念认为Th1/Th2细胞免疫失衡在AR的发病机制中起着重要的作用[2],而近年来研究发现,其他辅助性T细胞如Th17 细胞及其分泌的细胞因子在以Th2细胞免疫反应占优势的过敏性炎症中也发挥了重要作用,调节Th1/Th2细胞平衡[3]。
程序性死亡受体-1(programmed cell death-l,PD-1)是近来发现的B7-CD28 超家族的一员,主要是负性共刺激信号,对T细胞的失活及凋亡状态进行精细调控,可以直接抑制致病性效应T细胞[4]。有研究表明Th17细胞数量受其表面因子调控,PD-1是其中最重要的负性调控因子之一,PD-1负调节Th17细胞,其在自身免疫性疾病和过敏性疾病中发挥致病作用[5-6]。然而关于Th17细胞表面的PD-1的表达变化在AR中研究甚少。
本研究旨在应用流式细胞术检测PD-1在Th17细胞表面的表达水平及Th17的细胞比例变化,研究AR中Th17 细胞的变化情况及其表面PD-1表达水平的变化。
1 材料和方法
1.1 一般资料
选取于锦州医科大学附属第一医院就诊的过敏性鼻炎患者30例为实验组,健康者20例为对照组,所选研究对象需符合以下纳入和排除标准,签署知情同意书,并经锦州医科大学附属第一医院伦理委员会同意备案。
纳入标准:(1)AR组:符合中国过敏性鼻炎诊治指南(2018年)[7]诊断标准的过敏性鼻炎患者;(2)HC组:不符合上述诊断标准的健康人员。
排除标准:(1)近1个月内患有呼吸道感染性疾病者;(2)近2周内服用过免疫抑制剂、抗组胺药或糖皮质激素等抗过敏药物者;(3)患结核、肝炎等传染性疾病、严重的血液系统疾病及其他全身性疾病者。
1.2 主要实验试剂及仪器
Cell Activation Cocktail(withBrefeldin A),APC-Cy7 anti-human CD4,Brilliant Violet 421 anti-human IL-17A,Brilliant Violet 510 anti-human CD127(IL-7Ra),PE anti-human CD279(PD-1),PE Mouse IgG1 κisotype Ctrl,APC Mouse IgG1 κ isotype Ctrl以上试剂均购自美国Biolegend有限公司。FACS Verse(3-laser,8color)流式细胞仪购自美国BD公司。
1.3 实验方法
1.3.1 密度梯度离心法分离PBMC:患者和健康对照者均抽取2 mL EDTA抗凝外周血,混匀抗凝。将外周静脉血应用密度梯度离心法提取单个核细胞(PBMC),对PBMC进行台盼蓝染色和细胞计数。
1.3.2 PD-1标记的Th17细胞(CD4+IL-17A+)的荧光抗体染色:标记流式管,加入PBMC悬液100 μL,各流式管分别加入3 μL Fc Receptor Blocking Solution,室温避光孵育15 min。管中以2 μL/mL分别计算加入细胞刺激剂Cell Activation Cocktail(with Brefeldin A),于37 ℃,5% CO2环境孵育5 h。孵育结束后,取出各流式管,分别加入APC-Cy7-anti-humanCD4,PE-anti-human PD-1各5 μL,轻弹管壁混匀,室温避光孵育15 min。孵育结束后加入1 mL 1×PBS重悬细胞,室温1400 rpm×5 min洗涤1次,弃上清液。分别加入200 μL 1×Cytofix/Cytoperm,4 ℃ 孵育20 min。结束后加入1 mL Perm/Wash重悬细胞,室温3000 rpm ×5 min洗涤1次,弃上清。加入BV421-anti-human IL-17A 抗体,4 ℃避光30 min。结束后加入1 mL 1×PBS,室温1400 rpm×5 min洗涤1次,弃上清液。流式细胞仪检测。
四色标记样本检测之前,需设置空白对照、各荧光抗体单标对照组和同型对照,对照组包括:(1)空白对照:不加任何荧光抗体;(2)APC-Cy7-anti-humanCD4单标:只加入 APC-Cy7-anti-humanCD4 荧光抗体;(3)BV421-anti-human IL-17A单标:只加入BV421-anti-human IL-17A 荧光抗体;(4)PE-anti-human PD-1 单标:只加入 PE-anti-human PD-1 荧光抗体;(5)同型对照:PD-1的同型抗体PE Mouse IgG1 κ isotype Ctrl,余抗体正常添加(所有对照组样本按照四色标记样本操作流程依次进行)。
1.4 统计学方法

2 结 果
2.1 AR组与HC组的临床资料比较
AR组中男性为12例,女性为18例;HC组中男性为8例,女性为12例,年龄均在15~68岁,两组在年龄及性别方面的比较,均无统计学差异(P>0.05),结果见表1。
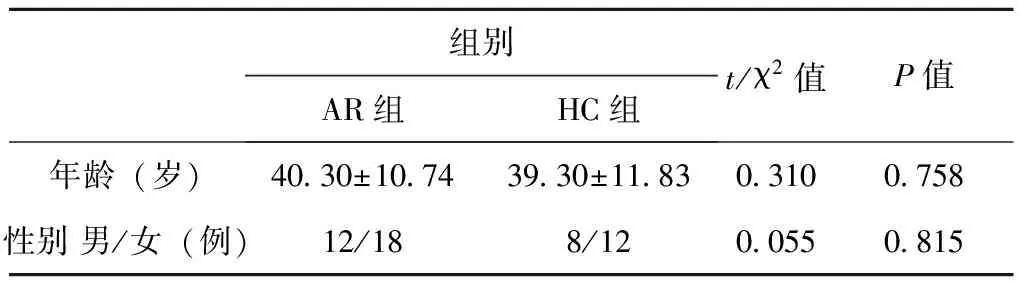
表1 AR组和HC组的临床资料比较
2.2 AR组与HC组外周血中Th17细胞的比例变化
采用流式细胞技术检测 AR组和HC组外周血中Th17细胞数量百分比。AR组 Th17(CD4+IL-17A+)细胞百分比(中位值M=2.51%)较 HC 组(中位值M=1.13%)升高(P<0.001,图1)。
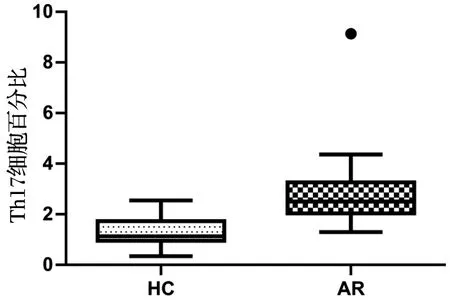
·为数据离群值
2.3 PD-1在AR组和HC组外周血Th17细胞表面的表达
采用流式细胞技术检测 AR组和HC组外周血中Th17细胞表面PD-1的表达水平,与HC健康对照组相比,AR患者中Th17细胞表面PD-1表达降低(Z=-5.941,P<0.05),差异具有统计学意义。典型流式细胞仪检测结果见图2、图3、表2。

表2 HC组与AR组实验数据比较汇总表
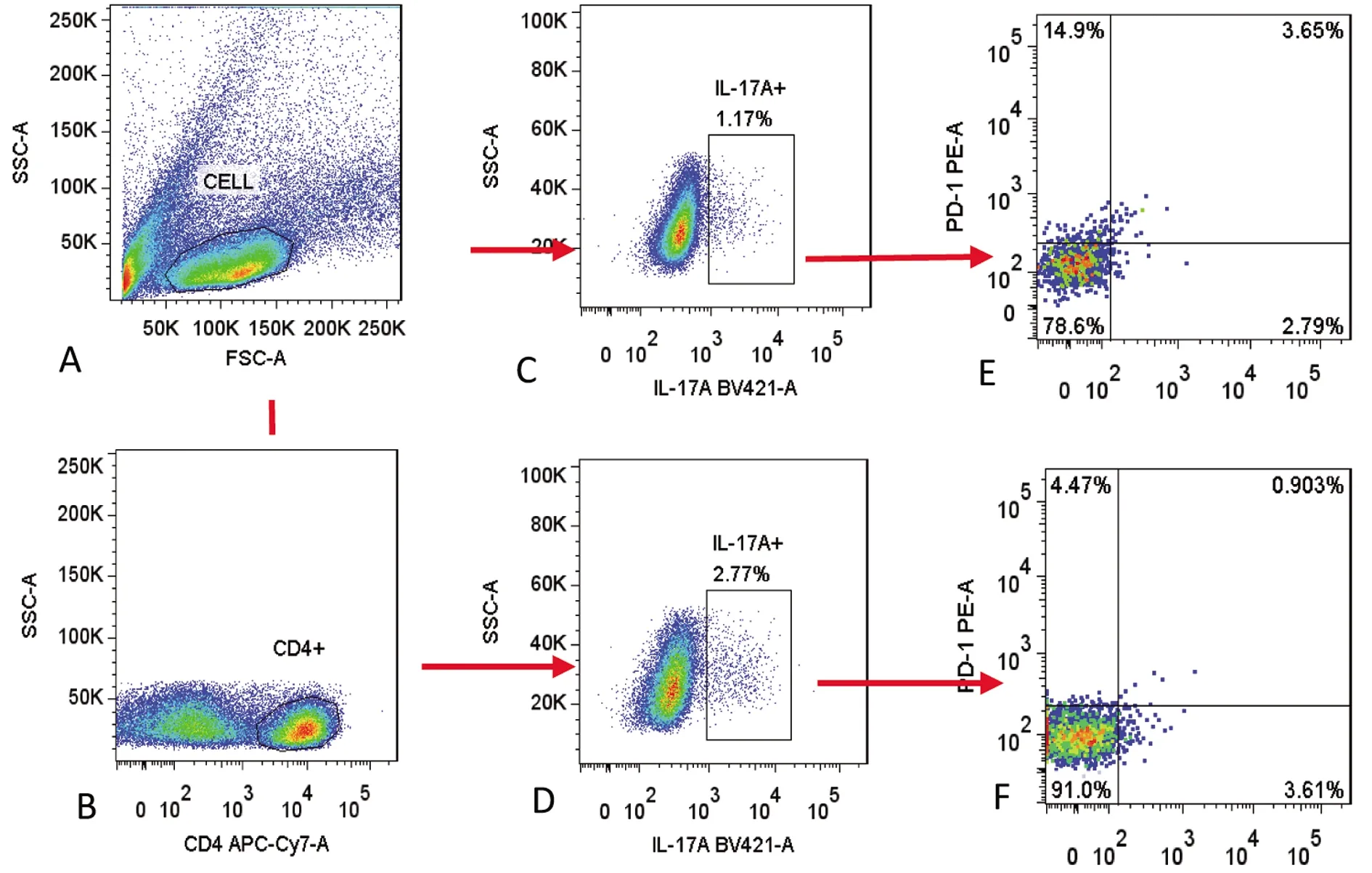
流式细胞技术检测CD4+ IL-17A+ T 细胞占 CD4+ T细胞的百分比,PD-1+的CD4 + IL-17A + Th17 细胞分别占 CD4 +IL-17A +Th17细胞总数的百分比;A:P1 门内包含所有的外周血淋巴细胞;B:P2门内包含所有的CD4+T细 胞;C(HC组)和D(AR组):P3门内包含所有的Th17(CD4+ IL-17A+)细胞;E(HC组):为PD-1+ Th17(CD4+ IL-17A+)细胞占Th17(CD4+ IL-17A+)细胞的百分比;F(AR组):PD-1+Th17(CD4+ IL-17A+)细胞占 Th17(CD4+ IL-17A+)细胞的百分比
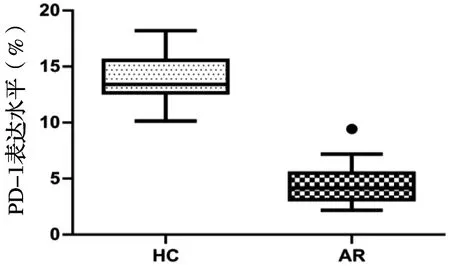
图3 PD-1在Th17细胞表达水平的比较
2.4 在AR组中进行PD-1与Th17细胞的Sperman相关性分析
AR患者中PD-1与Th17(图4,r=-0.623,P<0.001)细胞比例呈负相关。
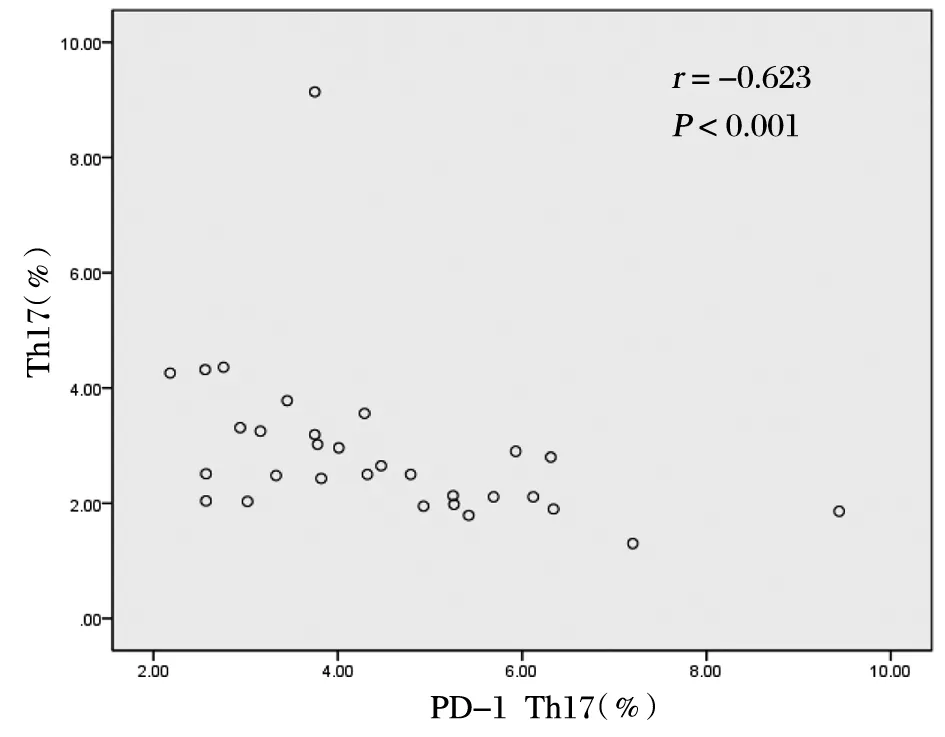
图4 PD-1与Th17细胞百分比的相关散点图
3 讨 论
过敏性鼻炎被认为是各种炎症介质、细胞因子、趋化因子、神经肽,以及粘附分子和细胞等形成的一个复杂的网络共同体,而引起的特异性、非特异性的鼻黏膜高反应的变应性疾病。经典研究认为Th1和Th2细胞应答的免疫失衡是变应性气道炎症的发病机理的中心[8]。新近发现的Th17细胞是区别于Th1和Th2 细胞的不同亚型,在过敏及自身免疫性疾病的免疫失衡中发挥重大作用。有研究发现过度增加的Th17细胞数目或Th17功能过度活化将激发变应性疾病(包含过敏性鼻炎和哮喘)的发生与发展[9],我们的研究结果也证明在Th17细胞在AR发病机制中有着至关重要的作用,进一步观察了Th17细胞表面的PD-1在AR患者外周血中的表达变化,为阐明AR患者Th17细胞免疫失衡的调控因子提供了实验依据。
AR实验组中Th17细胞比例增加和过度活化。既往研究表明,Th17细胞是具有优先合成IL-17家族细胞因子(尤其是IL-7A和IL-17E)的新型CD4+T亚型,它们被认为在炎性疾病的发病机理中起着至关重要的作用[10-11]。Liu Y等人的研究结果表明在卵清蛋白或屋尘螨诱导的AR鼠模型的鼻灌洗液中,发现IL-17A水平和Th17细胞频率升高[12]。这些发现表明Th17细胞免疫失衡与AR发病机制密切相关。
本研究证实在AR中Th17细胞数量增加,其表面PD-1表达降低,PD-1表达水平与Th17细胞数量呈负相关,PD-1为负性调节因子,可促进细胞凋亡,对免疫耐受系统进行精细调控。Th17细胞上PD-1表达水平下降,可导致PD-1对Th17细胞增殖的抑制作用减弱,即Th17细胞增殖能力增加,导致其分泌的细胞因子产生变化,引起免疫功能失衡[13]。因此,在AR中,存在Th17细胞免疫失衡以及PD-1表达异常。
本实验结果提示AR患者外周血中PD-1 在Th17 细胞表面的表达水平明显减少。而这一研究结果同L Yang研究的自身免疫性关节炎结果相似,其研究还观察到PD-1与配体结合后,通过抑制PI3K/AKT通路的活性抑制Th17的免疫应答功能[14]。McAlees[15]对哮喘小鼠模型的研究中,在阻断PD-1后,可以增加Th17细胞的免疫应答反应,从而增加了动物模型的气道高反应性。在过敏性哮喘中发现Th1、Th17分化主要由mTORC1支持,T细胞的活化遵循经典的mTOR途径并且依赖PI3K/AKT路径,因此,PD-1可能通过直接抑制mTORC1而影响Th17细胞的分化[16-17]。
我们推测Th17细胞表面的PD-1作为共刺激因子参与AR的发病机制,但是其具体作用机制还不甚清楚,仍需做进一步探究。

