不同病例来源肺炎克雷伯菌的致病性及其遗传进化关系分析
孙弋雅,周方圆,周明玉,刘海月,王大为,刘英姿
(1.锦州医科大学;2.锦州医科大学医疗学院,辽宁 锦州 121000)
肺炎克雷伯菌(klebsiella pneumoniae,KP)是最早在19世纪末由Friendiander发现,它属于肠杆菌科,克雷伯菌属,广泛存在于水和土壤中,近年来成为仅次于大肠杆菌的最重要的条件性致病菌,可以感染人类及各种动物。当机体免疫力下降时在全身各个部位可发生感染[1],除了最常见的呼吸系统、泌尿系统感染,还可引发肝脓肿、脑脓肿、脑膜炎、眼炎等疾病[2]。近些年,由于抗菌药物的广泛使用,导致肺炎克雷伯菌的耐药越来越严重,所以,本病不仅多发而且敏感药物越来越少[3-4]。目前针对该菌的致病因子和耐药性的研究已有一些报道,但关于其致病力、亲缘关系、耐药性的关系研究还不多见,因此,本研究针对临床不同病例来源肺炎克雷伯菌,开展致病性及其遗传进化关系分析,为探索肺炎克雷伯菌的传播来源和致病机制提供基础。
1 材料与方法
1.1 菌株来源
选取锦州医科大学附属第一医院发热患者、硫化氢中毒患者、脑梗死患者、脑血管病患者及胆肠吻合口结石患者病例的检验样品,检验科通过细菌学分离培养得到5株疑似肺炎克雷伯菌,菌株编号、来源与科室见表1。

表1 菌株编号及来源
1.2 实验动物
18~22 g SPF级昆明小鼠42只,购自锦州医科大学动物实验中心;3日龄海兰褐健康雏鸡42只,购自锦州某鸡白痢净化种鸡场,经过常规细菌学和常见病毒核酸检测呈阴性,饲养于兽医楼小动物饲养室,环境温湿度条件和饲料营养按照雏鸡饲养标准进行。
1.3 主要仪器试剂
普通营养琼脂培养基、麦康凯培养基、革兰氏染色液(青岛海博生物技术有限公司);阴性细菌鉴定卡、0.45% NaCl溶液(法国BIOMERIEUX公司);细菌基因组DNA提取试剂盒及胶回收试剂盒(杭州博日科技有限公司);DM2000 DNA Marker、2×Taq Master Mix(北京康为世纪生物科技有限公司);Gill green核酸染料(华越洋生物科技有限公司);VITEK 2 Compact 全自动微生物分析系统(法国生物梅里埃公司)。
1.4 试验方法
1.4.1 细菌分离纯化、观察及生化试验:按常规微生物检验方法,应用普通琼脂培养基和麦康凯培养基对检验样品进行细菌培养和纯化。选取疑似菌落,进行革兰氏染色镜检,观察形态。对纯培养物进行保种,使用无菌棉拭沾取3~5个菌落,接种到菌落冻存管中,放入冰箱-80 ℃保存备用。生化试验采用VITEK 2 Compact全自动细菌鉴定仪进行生化鉴定,具体方法步骤按说明书进行。
1.4.2 细菌16S rRNA的PCR检测及其序列遗传进化关系分析:按细菌基因组DNA提取试剂盒操作提取分离纯化后的细菌基因组DNA,使用16S rRNA通用引物(由上海生工生物公司合成)进行目的片段的PCR扩增,引物序列为:27F:5’ AGAGTTTGATCCTGGCTCAG 3’;1492R:5’ TACGGTTACCTTGTTACGACTT 3’。PCR反应总体积为30 μL,2×Taq Master Mix缓冲液15 μL,DNA模板3 μL,上下游引物各1 μL,ddH2O 10 μL。反应条件:95 ℃预变性5 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,30个循环,72 ℃总延伸10 min。反应结束后,将PCR产物经1.5%琼脂糖凝胶电泳,对符合目的大小的片段进行凝胶回收,并送至上海生工生物公司测序。使用比对软件DNAMAN(Version 9)、MEGA 5.0等与标准肺炎克雷伯菌序列进行比对分析,并对所分离的5株菌株以及部分动物源菌株进行同源性分析,绘制进化树。
1.4.3 致病性试验
1.4.3.1 接种菌液的制备:选取本实验鉴定纯化的肺炎克雷伯菌5株,编号为KP1、KP2、KP3、KP4、KP5复苏培养,使用灭菌后的镊子夹取一个磁珠放入无菌营养肉汤培养基中,37 ℃ 160 rpm培养。待菌液浑浊后,用校正后的麦氏比浊仪调至0.5麦氏单位(1.5×108CFU/mL),吸取一定菌液至灭菌后的EP管中,10 000 rpm离心5 min,弃上清液,用无菌PBS溶液重悬沉淀,重复3次,最后用PBS制成菌悬液备用。
1.4.3.2 致病性试验:分别将42只小鼠和雏鸡随机分为7组,分别为感染组(KP1~KP5组)、空白对照组和健康对照组,分笼隔离饲养。小鼠和雏鸡感染组每只腹腔分别注射0.3 mL和0.5 mL菌悬液,空白对照组分别注射0.3 mL和0.5 mL无菌PBS溶液,健康对照组不作处理。接种后分别在相同环境下隔离饲养,记录小鼠和雏鸡临床症状、死亡情况;对所有小鼠和雏鸡进行剖检并观察各器官病理变化,同时采集组织样本进行病理组织切片制作,观察病理组织学变化。无菌采集肝脏、脾脏、肾脏等发病器官,进行细菌学检查。
1.4.4 药物敏感性试验:使用VITEK 2 Compact 全自动微生物分析系统和Kirby-Bauer 纸片扩散法进行菌株的药敏试验,具体方法按说明书进行。
1.5 统计学方法
实验数据采用Excel 2003处理,应用SPSS 21.0统计学软件进行卡方分析,以P<0.01表示差异有统计学意义。
2 结 果
2.1 分离培养结果
5株分离菌株编号为KP1、KP2、KP3、KP4、KP5,在普通培养基上生长为中等大小、光滑、具有黏性的乳白色菌落。当菌落距离近时,可相互融合成为菌苔,见图1A;在麦康凯培养基上形成中等大小、光滑、圆凸的粉红色菌落,见图1B;革兰氏染色后,在显微镜下可观察到菌株呈革兰氏阴性,两边钝圆的短粗杆菌,单个或双链存在,见图1C。

图1 肺炎克雷伯菌生长状态和形态结构
2.2 生化试验结果
根据VITEK 2 Compact全自动细菌鉴定仪鉴定结果显示,5株分离菌株均属于肺炎克雷伯菌肺炎亚种,与肺炎克雷伯菌鉴定标准相似度为99%以上,分离菌株dGLU、dMAL、dMAN、dMNE均为阳性,5株分离菌株的生化实验结果均符合肺炎克雷伯菌生化试验特性。
2.3 细菌16S rRNA扩增结果及序列遗传进化关系分析
分离纯化后的菌株经PCR扩增和凝胶电泳后,在1450 bp处出现特异性条带,与目的大小相符,见图2。PCR产物经测序后拼接得到目的序列,不同分离菌株经Blast比对与肺炎克雷伯菌同源性高于99%,即确定5株细菌均为肺炎克雷伯菌。不同分离菌株同源性比对结果显示KP1~KP4同源性为98.85%,其中KP1&KP2&KP4同源性高达99.56%,KP1~KP5同源性为93.42%;遗传进化树结果同样证明KP1~KP4亲缘关系较近,KP1-KP4与KP5亲缘关系较远,见图3。
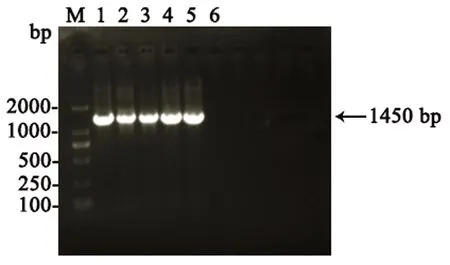
M:DM2000 marker;1-5:检测样本;6:阴性对照
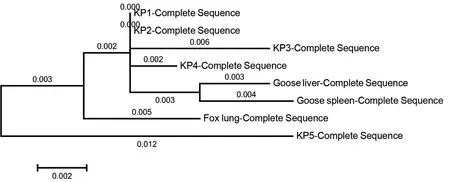
图3 KP1~KP5遗传进化树
2.4 致病性实验结果
连续1 w观察小鼠和雏鸡的状态,见表2。小鼠和雏鸡感染组(KP1~KP5)均有发病,发病率为100%,死亡率在50%~100%不等;KP3脑梗死病例分离菌株致死率最高为100%,显著高于其它各组(P≤0.01);KP5胆肠吻合口结石病例分离菌株致死率最低仅为50%,雏鸡KP1组死亡率介于中等水平为83.3%。健康组和空白对照组小鼠和雏鸡均未发病。小鼠和雏鸡感染组细菌学检查阳性率为100%。发病小鼠表现为饮食饮水量下降、聚堆、行走困难、眼角有黄色分泌物、四肢末端充血、肛门有粪便黏住、皮下充血水肿、见图4。主要剖检变化为:肺脏充血淤血,肝脏淤血变性,肾脏出血变性,脾脏出血坏死,脑实质充血,见图5。发病雏鸡典型症状表现为饮食饮水量下降,畏寒,聚堆,鼻腔和嘴有黄色透明液体分泌,四肢末端充血,见图6。典型剖检变化肺脏充血淤血,肝脏变性坏死,白细胞渗出,包膜纤维素性炎症,肾脏出血变性,脾脏出血坏死,脑膜下白细胞渗出,见图7。

图4 KP1~KP5组发病组小鼠典型临床症状
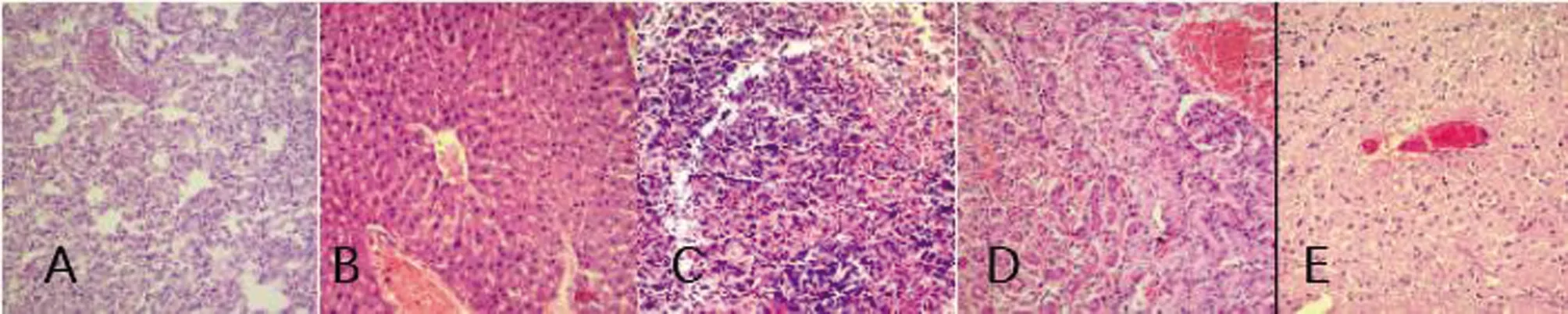
A:肺脏充血淤血;B:肝脏淤血变性;C:肾脏出血变性;D:脾脏出血坏死;E:脑实质充血

图6 KP1~KP5组发病组雏鸡典型临床症状
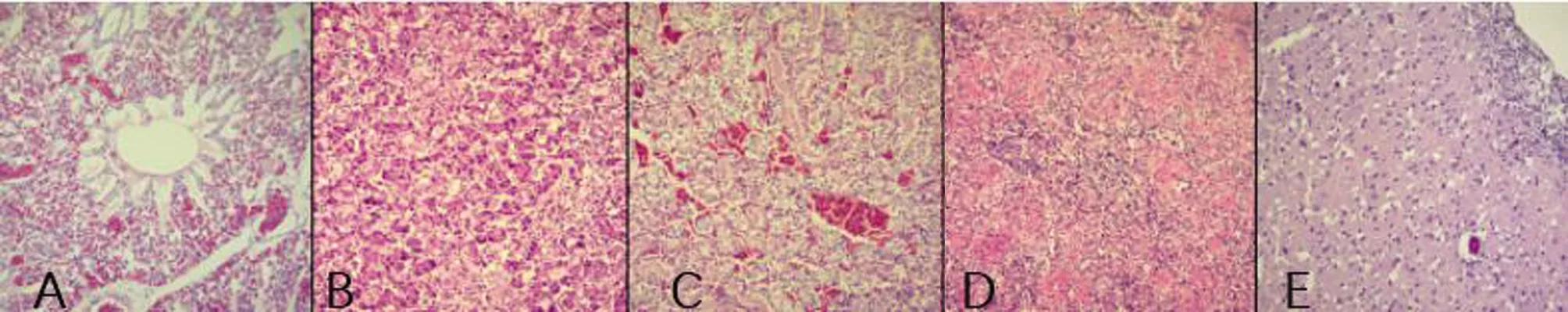
A:肺脏充血淤血;B:肝脏变性坏死;C:肾脏出血变性;D:脾脏出血坏死;E:脑膜下白细胞渗出
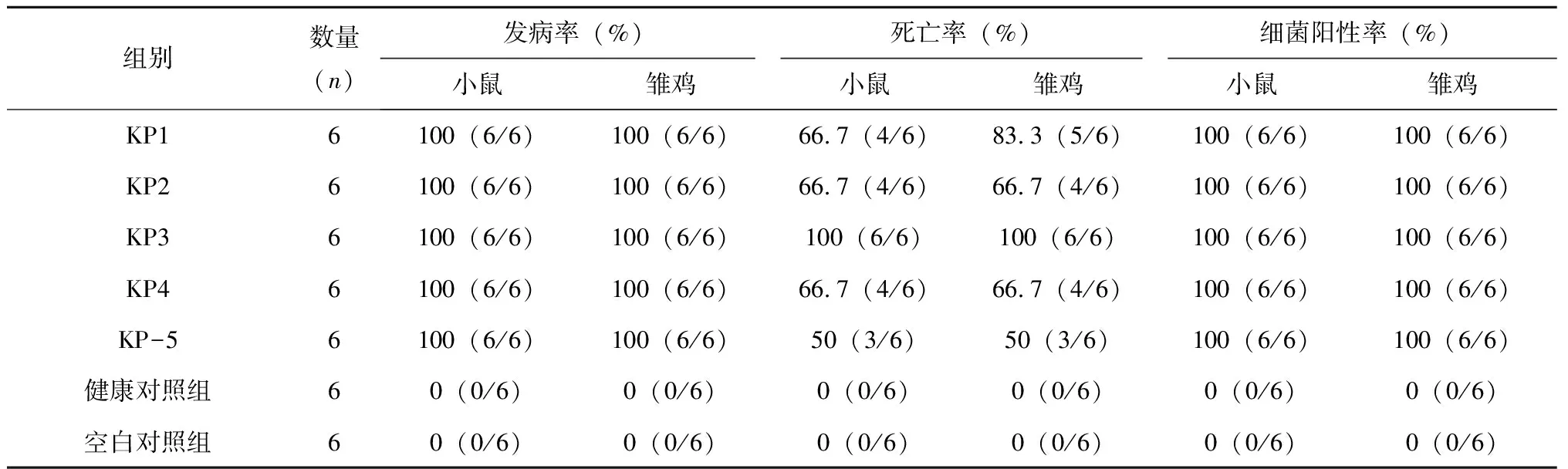
表2 小鼠和雏鸡致病性试验结果
2.5 药敏试验结果
对不同病例来源所分离的5株肺炎克雷伯菌进行药敏试验,其中KP3和KP5两株为产超广谱β-内酰胺酶菌,KP2、KP3和KP5表现出多重耐药性,KP1和KP4较少表现出耐药性,见表3。
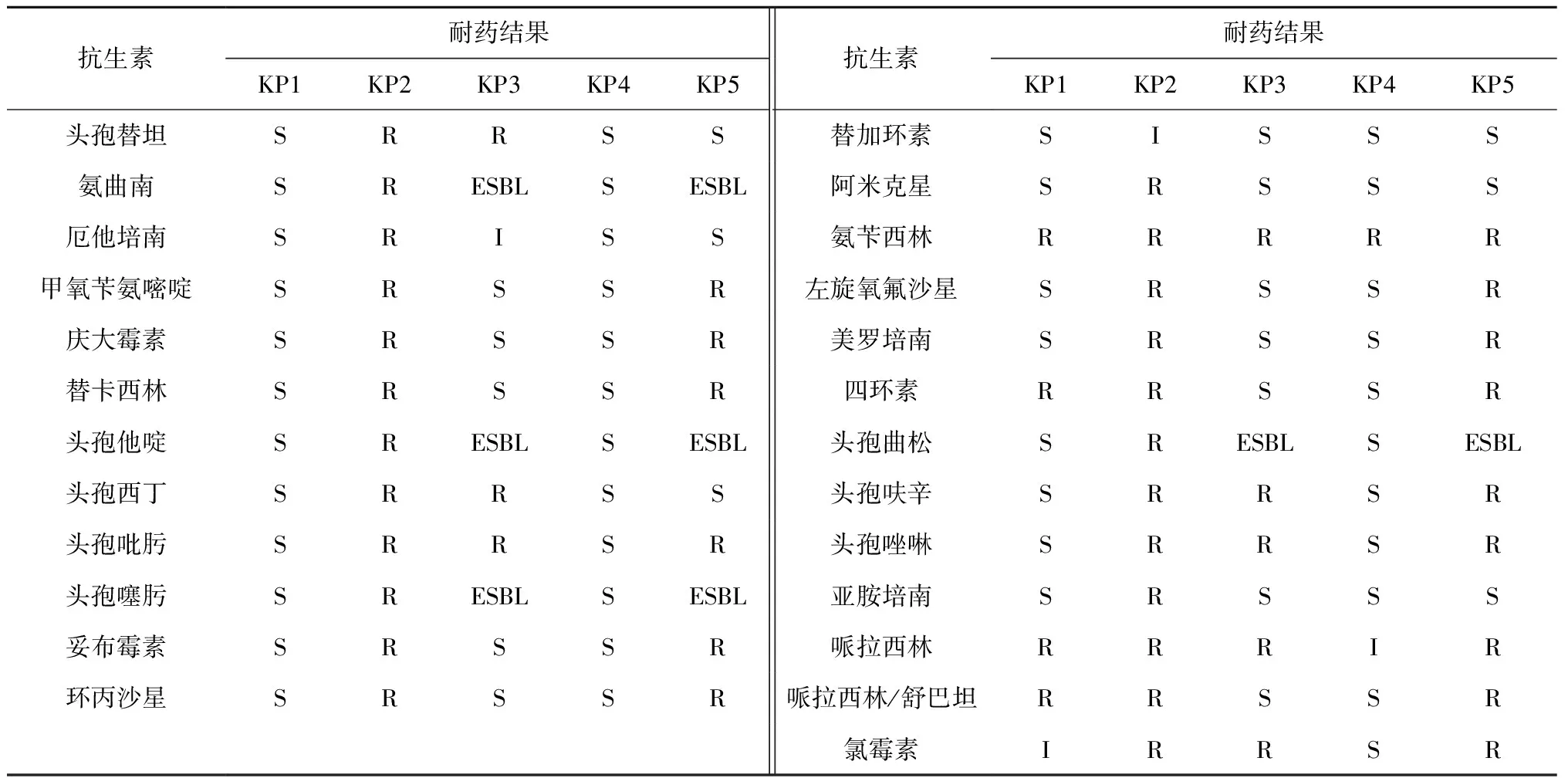
表3 5株肺炎克雷伯菌分离菌药敏结果
3 讨 论
根据相关文献报道,肺炎克雷伯菌主要通过荚膜多糖(CPS)、脂多糖(LPS)、菌毛、铁载体系统和外膜蛋白、孔蛋白、尿囊素代谢等致病因子导致人和动物发病。在营养不良和各种疾病导致免疫功能低下时引起呼吸道感染、肺炎、泌尿系感染、肝脓肿、眼内炎、脑脓肿等多种病症。以小鼠为动物模型开展肺炎克雷伯菌致病性的研究较多[5-6],但鲜有对不同病例来源菌株的致病力差异及其亲缘关系的研究报道;有大量文献报道关于不同哺乳动物和禽类来源肺炎克雷伯菌分离鉴定和致病性的研究,而未见有针对小鼠以外的其它动物开展人源肺炎克雷伯菌致病性研究。因此,本研究从锦州医科大学附属第一医院采集感染科发热患者、重症监控科硫化氢中毒患者、神经内科脑梗死患者、重症监控科脑血管病患者及胆肠吻合口结石患者不同来源的病例样品,成功分离鉴定到5株肺炎克雷伯菌,分别以小鼠和雏鸡为模型对其致病性进行研究。结果显示,5株不同病例来源菌株均可引起小鼠和雏鸡100%的发病率,死亡率也高达50%~100%。其中脑梗死病例分离菌株致死率最高为100%,胆肠吻合口结石病例分离菌株致死率最低为50%。患病小鼠和雏鸡表现的典型症状相似,均表现为饮食饮水量下降、聚堆、行走困难、眼角有黄色分泌物,四肢末端充血;且典型病理剖检变化均为肺脏、肝脏、脾脏、脑充血出血,雏鸡还可见肝包膜纤维素性炎症。研究结果一方面说明不同病例来源肺炎克雷伯菌的致病性存在明显差异,但为什么脑梗死病例来源菌株致病力最强还需要扩大样本并进行深入研究。另一方面,说明不同病例来源肺炎克雷伯菌对小鼠和禽类均具有致病性,即说明该菌可通过鼠类和禽类进行疾病传播,因此在防控过程中必须重视对鼠类和禽类传播途径的控制。此外还可应用小鼠和禽类作为多种病例来源肺炎克雷伯菌的动物模型,以此开展致病机制、耐药性、新药开发等研究。
本研究显示,不同病例来源的分离菌株亲缘关系有明显差异,来源于感染科发热KP1、重症监控科硫化氢中毒KP2、神经内科脑梗死KP3、重症监控科脑血管病KP4的菌株同源性较高,为98.85%,尤其是KP1、KP2、KP4同源性为99.56%,但KP1-KP5同源性为93.42%,说明KP1-KP4与胆肠吻合口结石KP5亲缘关系较远,而KP1-KP4均为肠道系统以外的器官病例,可能均为肺炎克雷伯菌继发感染,是否存在院内感染的情况需要深入研究;而胆肠吻合口结石病例KP5为单独分支来源,是否与肠道系统微生物菌群有关也有待深入研究。综合致病性差异结果,发现亲缘关系远近和致病性不完全成正相关,同源性较高但不同菌株也可能有较大的致病性差异,亲缘关系较远的菌株致病性不一定存在明显差异。
克雷伯菌的耐药性越来越严重且存在地区和时空的差异性[7-8],本研究结果表明,不同病例来源肺炎克雷伯菌的耐药性存在较大差异,在5株不同病例来源所分离的肺炎克雷伯菌中神经内科脑梗死KP3和KP5两种菌株为产超广谱β-内酰胺酶菌,KP2、KP3和KP5 3种菌株表现出多重耐药性,KP1和KP4两种菌株表现耐药性较少。结合上述致病性和亲缘关系研究结果,发现耐药性与致病性和亲缘关系没有必然联系,与何红、陈娜、宋晓超等研究结果一致[9-12]。虽然有许多关于耐药性与毒力因子之间的关系研究[13-15],但其必然联系仍不明确,因此,针对肺炎克雷伯菌的同源性、血清型、毒力因子、致病力、耐药性及耐药基因以及与感染病例免疫指标、血液生化指标等之间的联系均需要进一步研究。

