烟曲霉Cyp51A和Cyp51B生物学功能差异性分析
房凌旭 梁海 王鹏远 卢中一 陈芳艳 韩黎
(1.深圳市前海蛇口自贸区医院口腔科,深圳 518067;2.深圳大学高等研究院深圳市海洋微生物组工程重点实验室,深圳 518060;3.中国人民解放军疾病预防控制中心消毒与感染控制科,北京 100071)
烟曲霉(Aspergillusfumigatus)是自然界中广泛存在的曲霉属真菌,其对化疗患者、血液干细胞和器官移植患者等免疫力低下人群具有条件致病性。现有研究显示,由烟曲霉感染引起的患者死亡率较高,例如侵袭性肺曲霉病致死率超过30%[1-2]。唑类药物是临床上治疗烟曲霉感染的一线药物,其作用机制是通过自身的唑环结构结合烟曲霉麦角甾醇合成通路中关键催化酶——羊毛甾醇14-α-脱甲基酶(sterol 14 α-demethylase,Cyp51)活性中心的血红素,从而抑制该酶对底物的催化作用,一方面导致烟曲霉细胞膜中麦角甾醇含量下降,另一方面导致麦角甾醇合成通路中有毒性的中间产物积累,最终抑制烟曲霉生长[2]。然而,由于Cyp51(及其在酵母等属中的直系同源蛋白Erg11)是抗人类及植物多种致病真菌药物的主要靶点,临床和农业中唑类药物被广泛应用,这导致烟曲霉对唑类药物的耐受水平不断升高,且产生这种现象的主要机制与Cyp51有关[3]。
Cyp51的两个旁系同源蛋白Cyp51A和Cyp51B是烟曲霉的两个保守蛋白[4]。其中,烟曲霉Cyp51A的功能研究较为详细,例如该蛋白氨基酸位点G54、L98、Y121、G138、M220和G448的突变可导致蛋白结构变化,从而降低该蛋白与唑类药物的结合能力,最终导致烟曲霉对唑类药物耐受水平的升高[5]。特别是烟曲霉Cyp51A的TR34/L98H突变型和TR46/Y121F/T289A突变型被认为是临床和环境中烟曲霉的重要耐药机制[6-7]。此外,转录调控子SREBP和蛋白酶RbdB等关键调控蛋白的突变可引起烟曲霉cyp51A表达水平升高,进而导致菌株对唑类药物产生耐受性[8-9]。然而,烟曲霉Cyp51B的生物学功能研究却鲜有报道[10-11]。通常认为,烟曲霉Cyp51B具有脱甲基酶的功能,可能是一种功能冗余蛋白[12]。然而, Cyp51B在曲霉属真菌中广泛存在,这提示在曲霉属最近共同祖先中Cyp51B可能已存在;另一方面,镰刀菌属等真菌中存在多个Cyp51旁系同源蛋白,且这些蛋白已出现功能分化[12]。因此,烟曲霉Cyp51A和Cyp51B在长期演化过程中可能产生功能差异,但是目前为止对烟曲霉Cyp51A和Cyp51B功能比较的研究仍鲜有报道。
本研究通过系统发生分析、基因编辑技术、唑类药物敏感性检测、高温敏感性检测和大蜡螟幼虫致病力实验等综合分析烟曲霉Cyp51A和Cyp51B功能的差异性,为解析这些重要药物靶点生物学功能,进而科学防控烟曲霉感染和耐药提供理论依据。
1 材料和方法
1.1 实验材料和仪器
实验菌株 烟曲霉菌株CEA17ΔKu80由法国巴斯德研究所Jean Paul Latgé教授惠赠。本研究中将该菌株定义为野生株(WT);此外,本研究在该菌株基础上分别敲除cyp51A和cyp51B的编码基因获得突变株Δcyp51A和Δcyp51B。
培养基 马铃薯葡萄糖培养基(PDA)和沙堡弱培养基(SDA)购买自青岛海博生物公司。基础营养培养基(MM)由本实验室配制,主要成分包括微量元素溶液、20×盐溶液、葡萄糖和琼脂[13]。
实验仪器 9700型PCR扩增仪(ABI公司);A2型二级生物安全柜(Thermo公司);HNY-200B振荡摇床(欧诺公司);凝胶成像仪(天呈科技公司);恒温培养箱(黄石器械厂);5804R和5417R型台式离心机(Eppendorf公司);DYY-7C型转印电泳仪电源及配套电泳槽(北京六一公司)。
1.2 实验方法
构建系统发生树 本研究中Cyp51A、Cyp51B和Erg11序列均从NCBI数据库(https://www.ncbi.nlm.nih.gov/)中获取。在构建系统发生树时使用MUSCLE(V3.8.1551)对蛋白序列进行序列对齐[14];随后使用TrimAI(V1.4)进行序列剪切[15];最后利用IQ-Tree(V1.6.5)构建系统发生树[16],系统发生树构建模型为LG+G4。
构建突变盒 采用Overlap PCR技术构建含潮霉素突变盒,使用的高保真酶Prime STAR GXL购自于大连宝生物公司。PCR体系为:1 μL Prime STAR GXL DNA Polymerase;4 μL dNTP Mixture;10 μL 5×Primer STAR GXL Buffer;1.5 μL正向引物(10 μmol/L);1.5 μL反向引物(10 μmol/L);30 μL灭菌去离子水;1 μL DNA模板(2.5~10 ng)。PCR反应条件:98℃ 5 min;(98℃ 10 s,60℃15 s,68℃ 1 kb/min)30循环;68℃ 4 min。使用的相关引物见表1。

表1 本研究中构建突变盒的引物Tab.1 Primers used to construct mutant cassette in this study
烟曲霉原生质体制备及转化 烟曲霉原生质体制备及转化的方法参考前人报道[13]。具体实验步骤为,将约106个烟曲霉CEA17ΔKu80的孢子接种至PDA液体培养基,经37℃过夜培养后,用灭菌纱布收集菌丝。随后在30℃下将菌丝在细胞壁消化体系中孵育3 h,并使用40 μm孔径细胞网筛去除未消化菌丝后获得烟曲霉原生质体。用洗脱液将上述原生质体洗脱至1.5 mL离心管离心收集,随后用200 μL储存液重悬原生质体,并加入构建的突变盒,置于冰上孵育25 min。最后,在上述孵育物中加入1 mL PEG6000溶液和筛选高渗培养基,经37℃培养96 h后,挑取单菌落验证基因敲除情况。
大蜡螟幼虫致病力实验 选取重量为0.3~0.35 g大蜡螟幼虫进行分组,每组16只。使用含有0.01% Tween 20的无菌磷酸盐缓冲液将5×107个/mL烟曲霉孢子重悬。使用微量注射器将10 μL上述孢子悬液注射入大蜡螟左排最下端腹足。同时设置两个对照组,其中一组大蜡螟被注射10 μL含有0.01% Tween 20的无菌磷酸盐缓冲液(PBST),另一组大蜡螟不做任何处理。注射完成后置于37℃遮光培养,每12 h记录大蜡螟存活情况。
1.3 统计分析
本研究中数据经GraphPad Prism(V 5.01)进行统计分析,One-way ANOVA比较多组数据,P<0.05时,表示差异具有统计学意义。
2 结果和分析
2.1 分析烟曲霉Cyp51A和Cyp51B的进化关系
为分析烟曲霉Cyp51A和Cyp51B的进化关系,本研究选取曲霉属和镰刀属真菌的Cyp51A和Cyp51B,以及酵母属和念珠菌属真菌的Erg11(作为外支)构建系统发生树。如图1结果显示,虽然烟曲霉Cyp51A和Cyp51B氨基酸序列相似度高达69.9%,但两者分别分布于真菌Cyp51A和Cyp51B聚成的两大分支,并且Cyp51A和Cyp51B与Erg11存在较远进化距离,提示Cyp51与Erg11亲缘关系较远。以上结果提示Cyp51A和Cyp51B分化有可能早于曲霉属等真菌最近共同祖先的出现。
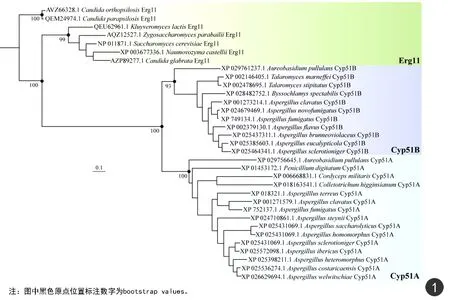
图1 根据Cyp51B、Cyp51A和Erg11氨基酸序列构建的系统发生树Fig.1 Phylogenetic analysis of Cyp51B, Cyp51A, and Erg11
2.2 构建和验证烟曲霉cyp51A和cyp51B基因敲除菌株
为研究烟曲霉Cyp51A和Cyp51B生物学功能差异,本研究利用同源重组原理敲除烟曲霉菌株CEA17ΔKu80的cyp51A和cyp51B的编码基因,原理如下:通过Overlap PCR技术构建含潮霉素筛选标记的突变盒,该突变盒包括靶基因(本研究中为烟曲霉cyp51A或cyp51B)上游同源臂、下游同源臂和潮霉素耐药基因(见图2A);再将该突变盒转化至烟曲霉原生质体,该突变盒将有一定几率原位替换靶基因。如图2B和2C显示,本研究成功构建了用于烟曲霉cyp51A和cyp51B基因敲除的突变盒,并分别转化至用烟曲霉CEA17ΔKu80制备的原生质体中,应用潮霉素筛选培养基初筛转化子,再进行PCR验证。在成功敲除cyp51A或cyp51B编码基因的突变株中未检测到cyp51A或cyp51B编码基因的片段(见图2Ca),但可检测到潮霉素基因片段(见图2Cb)。研究过程中发现,无法获得cyp51A和cyp51B双基因敲除株,可能是同时敲除会导致菌株死亡,提示烟曲霉Cyp51A和Cyp51B在麦角甾醇合成通路中功能具有重叠性。
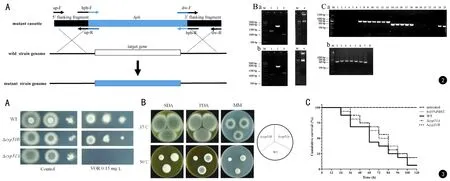
图2 利用同源重组原理敲除烟曲霉cyp51A和cyp51B. a中hph指潮霉素耐药基因,5’ flanking fragment和3’ flanking fragment分别指靶基因上游同源臂和下游同源臂; Ba中泳道1~4分别为Cyp51A编码基因的上游同源臂、潮霉素耐药基因和下游同源臂,以及这些片段拼接后的突变盒; Bb中泳道1~4分别为敲除cyp51B编码基因扩增的上游同源臂、潮霉素耐药基因和下游同源臂,以及这些片段拼接后的突变盒; Ca中泳道1~12是检测转化子中的cyp51A编码基因,泳道13是阳性对照;泳道14~24是检测转化子中的cyp51B编码基因,泳道25是阳性对照; Cb中泳道1~6是检测转化子中是否存在潮霉素耐药基因,泳道7是阳性对照,泳道8是阴性对照图3 Δcyp51A和Δcyp51B生物学功能差异性分析. A.检测Δcyp51A和Δcyp51B对伏立康唑的敏感性,VOR:伏立康唑; B.检测Δcyp51A和Δcyp51B对温度的敏感性; C.检测Δcyp51A和Δcyp51B对大蜡螟幼虫的致病力Fig.2 Knockout of cyp51A and cyp51B in Aspergillus fumigates by homologous recombination technology. A. hph refers to the hygromycin resistance cassette; 5’ flanking fragment and 3’ flanking fragment refer to the upstream and downstream homology arms of target gene, respectively; Ba. panel 1-4 refer to the upstream homology arm, hygromycin resistance cassette, downstream homology arm, and mutant cassette, respectively, for construction of Δcyp51A mutant; Bb. panel 1-4 refer to the upstream homology arm, hygromycin resistance cassette, downstream homology arm, and mutant cassette, respectively, for construction of Δcyp51B mutant; Ca. cyp51A and cyp51B fragments were detected in the Δcyp51A (panel 1-12) and Δcyp51B (panel 14-24) mutants, respectively; panel 13 and 25 are positive controls; Cb. fragments of the hygromycin resistance cassette were detected in Δcyp51A and Δcyp51B mutants (panel 1-6); panel 7 and 8 refer to the positive and negative controls, respectively Fig.3 Functional analysis of Δcyp51A and Δcyp51B in Aspergillus fumigatus. A. voriconazole susceptibility of the Δcyp51A and Δcyp51B mutants; B. high temperature susceptibility of the Δcyp51A and Δcyp51B mutants; C. virulence characterization of the Δcyp51A and Δcyp51B mutants in the Galleria mellonella infection model
2.3 研究烟曲霉cyp51A和cyp51B生物学功能差异性
鉴于真菌Cyp51是唑类药物的靶点,本研究首先检测了Δcyp51A和Δcyp51B对唑类药物敏感性。如图3A显示,虽然在无药时Δcyp51A、Δcyp51B与WT相比,宏观菌落形态和生长速率无显著性差异,但是Δcyp51A对0.15 mg/L伏立康唑的耐受水平显著低于WT和Δcyp51B;而与WT相比,Δcyp51B对伏立康唑的耐受水平略有下降。本研究还发现在50℃下Δcyp51B在SDA、PDA和MM上的生长趋势明显弱于WT和Δcyp51A,而Δcyp51A与WT的生长能力无明显差异,提示Cyp51B在烟曲霉对高温环境耐受中具有重要作用(见图3B)。鉴于高温耐受性是烟曲霉有别于其他曲霉的关键特征,且该能力可能与烟曲霉的致病力有关,本研究随后以大蜡螟幼虫模型检测了Δcyp51A和Δcyp51B的致病力,结果显示,与WT相比,Δcyp51A(P=0.327)和Δcyp51B(P=0.2589)对大蜡螟幼虫的致病力差异均无统计学意义;此外,Δcyp51A和Δcyp51B之间的致病力差异也无统计学意义(P=0.9127)。
3 讨 论
Cyp51是保守存在于真菌麦角甾醇合成通路中的关键限速酶,其作为重要的抗真菌药物靶点长久以来得到学者广泛关注[17]。现已知多种真菌基因组中存在Cyp51旁系同源蛋白,例如指状青霉(Penicilliumdigitatum)中保守存在Cyp51A和Cyp51B,禾谷镰刀菌(Fusariumgraminearum)中甚至存在Cyp51A、Cyp51B和Cyp51C 3个旁系同源蛋白[12]。一般认为,这些Cyp51的同源蛋白由基因复制产生,并在漫长演化过程中在种群中固定和扩散。系统发生分析显示,包括烟曲霉在内的真菌Cyp51A和Cyp51B聚成两个主要分支,呈现明显进化距离,提示这两类旁系同源蛋白在曲霉属等真菌演化时间较长,因而生物学功能可能产生分化。
本研究成功构建烟曲霉cyp51A和cyp51B的单个基因敲除菌株,但无法获得上述两个基因的双敲菌株,提示Cyp51A和Cyp51B在烟曲霉麦角甾醇合成通路中均可行使羊毛甾醇催化活性;其他研究也显示,禾谷镰刀菌被单独敲除cyp51A、cyp51B或cyp51C基因后,其麦角甾醇的含量无显著性差异[12],以上结果共同说明真菌Cyp51同源蛋白在麦角甾醇合成通路中具有功能冗余性。本研究发现,与WT相比,Δcyp51A和Δcyp51B对伏立康唑耐受水平下降,产生这种现象的原因可能与Cyp51总表达量下降有关[18]。此外,Δcyp51A对伏立康唑耐受的下降程度显著高于Δcyp51B,暗示伏立康唑对烟曲霉Cyp51B的结合能力可能高于Cyp51A。Andrew等[19]研究中也发现,体外纯化后的烟曲霉Cyp51B结合伏立康唑能力显著高于Cyp51A。然而,看似矛盾的是,临床和环境中分离到的唑类耐药烟曲霉往往与自身Cyp51A的氨基酸位点突变有关[20]。对此矛盾的一种解释是,烟曲霉Cyp51B是麦角甾醇合成通路中主要催化酶,对非同义突变的容错率较低,而Cyp51A则是烟曲霉适应环境条件的可调控蛋白;因此,当唑类药物优先与烟曲霉Cyp51B结合后,药物筛选压力更易导致Cyp51A可弹性的表达和突变。实际上,其他研究中发现cyp51B的编码基因在烟曲霉中是持续性表达,而cyp51A的编码基因是诱导性表达,这也从侧面支持了本研究的这一解释[21]。
与通常的认识不同,本研究首次发现Cyp51B并非仅是Cyp51A的功能冗余蛋白,而是在漫长的演化过程中分化出独特的功能。我们发现Δcyp51B的高温耐受性在多种培养基中均显著低于Δcyp51A和WT,显示Cyp51B可能在烟曲霉适应高温环境的抗逆性中具有重要作用。烟曲霉的高温耐受能力是其区别于其他曲霉的重要鉴定指标。有研究显示,烟曲霉耐热能力可能与其致病力有关[22];此外,烟曲霉的耐热能力也可能是其在农业堆肥中获得种群优势,进而得到播散的重要原因[23]。因此,对于烟曲霉高温耐受基因和调控信号通路的研究在寻找药物靶点和防治烟曲霉相关疾病等领域有重要前景。有趣的是,在其他研究中显示,酿酒酵母麦角甾醇合成通路中多个基因的缺失也可显著改变突变株对温度的适应能力[24]。这些结果暗示真菌的麦角甾醇合成通路可能与其温度敏感性有重要联系,但该假设仍需在镰刀菌属等其他真菌中进行验证。本研究推测cyp51B编码基因的缺失可能通过影响烟曲霉麦角甾醇合成通路中间代谢产物含量,进而改变了烟曲霉对高温的适应能力。另一种可能是,烟曲霉Cyp51A与Cyp51B相比,其酶活性在高温下降低,进而干扰了麦角甾醇合成通路,造成烟曲霉生长减弱。此外,虽然前人认为真菌的耐热能力可能与其致病力有关[23,25],但本研究在大蜡螟幼虫致病力模型中未发现Δcyp51B与Δcyp51A和WT相比在致病力上有显著区别,因此烟曲霉高温耐受性与其致病力的联系仍需进一步研究。
综上所述,虽然烟曲霉Cyp51A和Cyp51B在麦角甾醇合成通路功能具有冗余性,但烟曲霉Cyp51A与Cyp51B具有明显的进化距离,提示在漫长演化过程中两种蛋白功能已分化。此外,Cyp51A和Cyp51B在烟曲霉对唑类药物耐受性和高温耐受性等方面均有功能差异性。

