定量PCR检测联合G试验及GM试验对侵袭性真菌感染早期诊断的价值
尚元元 李可心 马春梅 李莎莎 扈容英 杨文君
(1.宁夏医科大学总医院,银川 750004; 2.宁夏医科大学,银川 750004)
侵袭性真菌感染(invasive fungal infection,IFI)是真菌侵入人体组织、器官或血液,并进行生长和繁殖久之造成机体组织及器官损伤、功能障碍的真菌感染性疾病,常发生于ICU、呼吸科及烧伤科的重症疾病中[1]。近年来,IFI呈逐年上升趋势,由于不同真菌感染其潜伏期及发病状态不同,早期易被基础疾病掩盖,加之IFI早期快速诊断方法尚未完善,常规组织病理取材及实施难度较大且有创,病原微生物培养周期较长,且敏感度易受培养环境等多方面的影响,易延误病情,错失最佳治疗时间[2]。IFI病死率居高不下,尤其对免疫力低下患者的生命造成严重威胁,早诊断、早治疗具有重要的临床意义,探究具有高灵敏度和特异性的诊断检测方法是IFI临床研究的重点。目前,IFI的临床诊断中以G试验和GM试验应用最为广泛,具有早期诊断和判断疗效的作用,但临床实践[3]表明,G试验及GM试验结果中假阳性及假阴性无法规避,因此对其临床应用有一定的限制。随着分子生物学技术的进步,IFI早期诊断有了新的思路和方向,实时荧光定量(realtime fluorescence quantitative PCR,RTFQ-PCR)检测具有较高的敏感性和特异性,可以克服现有诊断中的多种难题,为初步探讨RTFQ-PCR检测联合G试验及GM试验对IFI早期诊断价值,笔者对宁夏医科大学总医院60例IFI高危患者进行临床分析,旨在为定量RTFQ-PCR应用于IFI的早期诊断提供客观依据。现汇报如下。
1 材料与方法
1.1 一般资料
纳入2014年4月—2015年10月我院(宁夏医科大学总医院)ICU、呼吸科及烧伤科等IFI高发科室中60例IFI高危患者,所有IFI高危患者均按照《重症患者侵袭性真菌感染诊断与治疗指南》(2007 版本)[4]进行诊断及治疗。
1.2 诊断标准
参照欧洲癌症研究和治疗组织/侵袭性真菌感染协作组和美国国立变态反应和感染病研究院真菌病研究组(EORTC/MSG)共识组制订的侵袭性真菌感染的修订定义及中华医学会重症医学分会制定的《重症患者侵袭性真菌感染诊断与治疗指南》[5],制定的IFI诊断标准分为4种:确诊、临床诊断、拟诊及排除IFI组,其中以确诊、临床诊断及拟诊IFI组为阳性病例,排除IFI组作为阴性对照病例。
1.3 纳入及排除标准
纳入标准 ①IFI高危患者;②医院伦理委员会知情同意批准者;③家属及其委托代理人知情同意并自愿参与者;④自主配合且对研究相关步骤及项目无异议者;⑤基础疾病病情稳定无生命威胁者。
排除标准 ①不属于纳入标准条件范围内者;②入组前未进行相关针对性治疗者;③入组前使用可能影响实验结果的药物或治疗者;④病历资料不全者;⑤中途退出或转院者。
1.4 样本采集
按RTFQ-PCR检测、GM试验和G试验要求分别采取血清和肝素抗凝的血浆标本各2 mL,离心后取其血清保存在-80℃冰箱,以留备进一步试验,实验前将血清4℃解冻。同时对60例患者的痰、血、支气管肺泡灌洗液等进行真菌培养及真菌涂片,真菌培养样本于我院真菌和真菌病研究中心和临床检验室根据形态、生理生化特性及分子生物学进行鉴定。
1.5 主要试剂与仪器
Platelia曲霉诊断试剂盒购自美国Bio-Rad公司,GKT25M Set 动态真菌检测试剂盒购自北京金山川科技发展公司,QIAamp DNA Blood Mini Kit 试剂盒、引物和探针购自生工公司,白念珠菌核酸检测试剂盒购自泰普生物科学有限公司,ABI7500荧光定量 RTFQ-PCR仪 (美国ABI公司),MB-80微生物动态快速检测系统(北京金山川公司),T01- JSQ24-D12T01智能恒温仪(美国DU PONT公司), ELX808细菌内毒素检测仪(厦门鲎试剂生物科技股份有限公司)。
1.6 方法
真菌培养 根据标本种类的不同接种在不同培养基上,25℃、37℃培养,每24 h观察1次结果,根据菌落生长的形态,生长特点及色素进行初级鉴别,如果生长为酵母菌的,进一步将酵母菌接种于科玛嘉显色培养基上进行分离鉴定,不能显色的酵母类及非酵母类真菌根据其镜下菌丝、孢子特征或进一步小培养的生长特点进行鉴定,仍不能确定的采用全自动微生物分析仪(VITEK 2 COMPACT)进行鉴定。
RTFQ-PCR检测 釆用定量RTFQ-PCR Taq Man探针法,以真菌高度保守的18S rRNA为目的基因,设计合成相应特异性引物和探针,上游引物:5'-GTGAATCATCGAATCTTTGAAC-3';下游引物:5'-TCCTC-CGCTTATTGATATGC-3';TapMan探针:5'-FAM-ATTGCTTGCG-GCGGTAACGTCC-TAMRA-3',探针特异性很高,可特异性的结合目的基因,阳性对照品为含目的基因质粒,目的基因来自美国菌种保藏中心(ATCC)的原始菌株。反应程序为:37 ℃ 2 min;94 ℃ 2 min;94 ℃ 20 s,55 ℃ 45 s,10个循环;94 ℃20 s,55 ℃ 45 s,30个循环。曲霉基因检测试剂盒(RTFQ-PCR-荧光探针法)反应程序:95 ℃ 15 min; 94 ℃ 15 s,55 ℃45 s,40个循环。结果判读:Ct值在15~35范围内为阳性标准,Ct 值超出35为阴性标准[6]。为防止实验中出现假阳性结果,实验中设立对照,分别是标准品系列,空白和阴性对照。同时收集患者的实验室、组织病理、影像学及危险因素等临床资料。将研究对象分为4个级别:确诊、临床诊断、拟诊及排除IFI组,其中以确诊、临床诊断及拟诊IFI组作为阳性病例,排除IFI组作为阴性对照病例。
G试验检测 IFI高危患者60例(同上述定量RTFQ-PCR检测)的血清标本,采用GKT-1M动态真菌检测试剂盒,混匀后3 000 r/min 离心1 min,取富含血小板血浆100 μL,取上清液200 μL,切勿有气泡,立即插入检测系统中,2~3 h即可出结果,检测结果由MB-80微生物动态检测系统自动计算出待测血清中BG浓度。操作严格按照试剂盒说明书进行。参照试剂盒说明书的标准范围,BG试验阳性定义为血清中BG浓度≥100.0 pg/mL[7]。
GM试验检测 IFI高危患者60例(同上述定量RTFQ-PCR检测)的血清标本,采用曲霉菌抗原酶免试剂盒(96T)检测,将于100℃水浴离心后的50 μL标本上清液与50 μL结合液加入含抗半乳甘露聚糖单克隆抗体EB-A2的微孔板,封板后 37℃孵育 90 min;加入显色液后避光放置30 min;加入终止液后在自动定量酶标仪 450 nm/630 nm 处读取吸光度值,参照美国FDA建议将阈值I大于0.5定义为阳性[8]。
1.7 统计学处理
应用SPSS17.0软件进行数据处理,评价RTFQ-PCR定量检测、G及GM检测的诊断价值并进行ROC曲线分析。评价3种诊断方法的相关性、一致性及联合诊断的敏感性和特异性。P<0.05为差异有统计学意义。
2 结 果
2.1 基本情况
60例患者中男性42例,女性18例,年龄12~72(46.73±6.38)岁。IFI临床诊断情况:共有38例诊断为院内侵袭性真菌感染,其中确诊3例,男女比例(2∶1),临床诊断27例,男女比例(7∶2),拟诊8例,男女比例(3∶5),排除22例,男女比例(8∶3)。
2.2 检测结果
真菌培养结果 38例诊断为院内IFI的患者(包括确诊、临床诊断和拟诊),真菌培养阳性19例,标本来自于痰液,支气管、肺泡灌洗液,血液,尿液、腹水、鼻窦抽取液、肠道黏膜及深部组织;每例标本均先行真菌直接涂片,后行真菌培养,2例深部组织同时行病理检查。其中曲霉9例(4例为支气管、肺泡灌洗液,其中有2例在痰液中也找到了真菌,3例为痰液,1例来自鼻窦抽取液,1例为支气管镜穿刺组织),占47%;白念珠菌4例(1例为静脉血,1例为尿液,1例为腹水, 1例为肾脏穿刺活检组织),占22%;热带念珠菌3例(1例为支气管、肺泡灌洗液,1例为尿液,1例为腹水),占16%;光滑念珠菌1例(标本为尿液),占5%;季也蒙念珠菌1例(标本为腹水),占5%;混合感染1例(包括念珠菌和曲霉,标本为痰液),占5%。2例深部组织病理检查,在组织病理切片中找到了真菌的菌丝和孢子。
G试验、GM试验、RTFQ-PCR检测及联合检测检出阳性率 结果显示,G试验IFI确诊组、临床诊断组、拟诊组及排除组检出阳性率分别为100%、70.37%、75.00%和54.55%;GM试验IFI确诊组、临床诊断组、拟诊组及排除组检出阳性率分别为66.67%、70.37%、62.50%和45.45%;RTFQ-PCR检测IFI确诊组、临床诊断组、拟诊组及排除组检出阳性率分别为100%、81.48%、87.50%和22.73%。结果见表1。
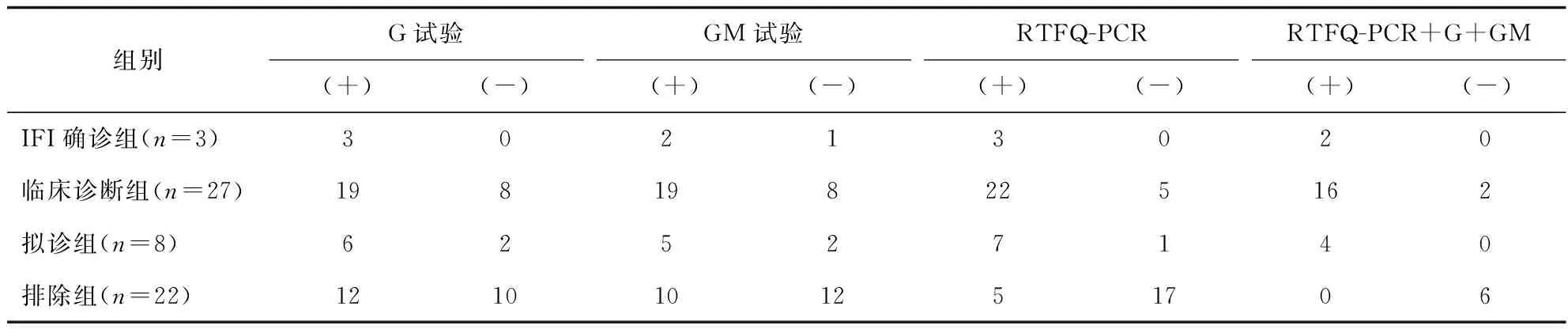
表1 G试验、GM试验及RTFQ-PCR检测及联合检测检出阳性率比较Tab.1 Comparison of positive rates of G test, GM test and RTFQ-PCR detection and combined detection
G试验、GM试验、RTFQ-PCR检测及联合检测诊断IFI价值分析 以IFI确诊、临床诊断及疑诊组合计38例为IFI真阳性,以排除组22例为真阴性,RTFQ-PCR+G+GM联合检测阳性以3种检测结果均为阳性进行计数,经过SPSS17.0统计分析显示,G试验、GM试验、RTFQ-PCR检测、RTFQ-PCR+G+GM联合检测敏感度、特异性、阳性预测、阴性预测值、符合度结果见表2。采用SPSS17.0进行 ROC曲线分析(见图1),结果显示,G试验、GM试验及RTFQ-PCR检测在诊断IFI中均具有较高的临床价值(P均<0.05)(见表3)。
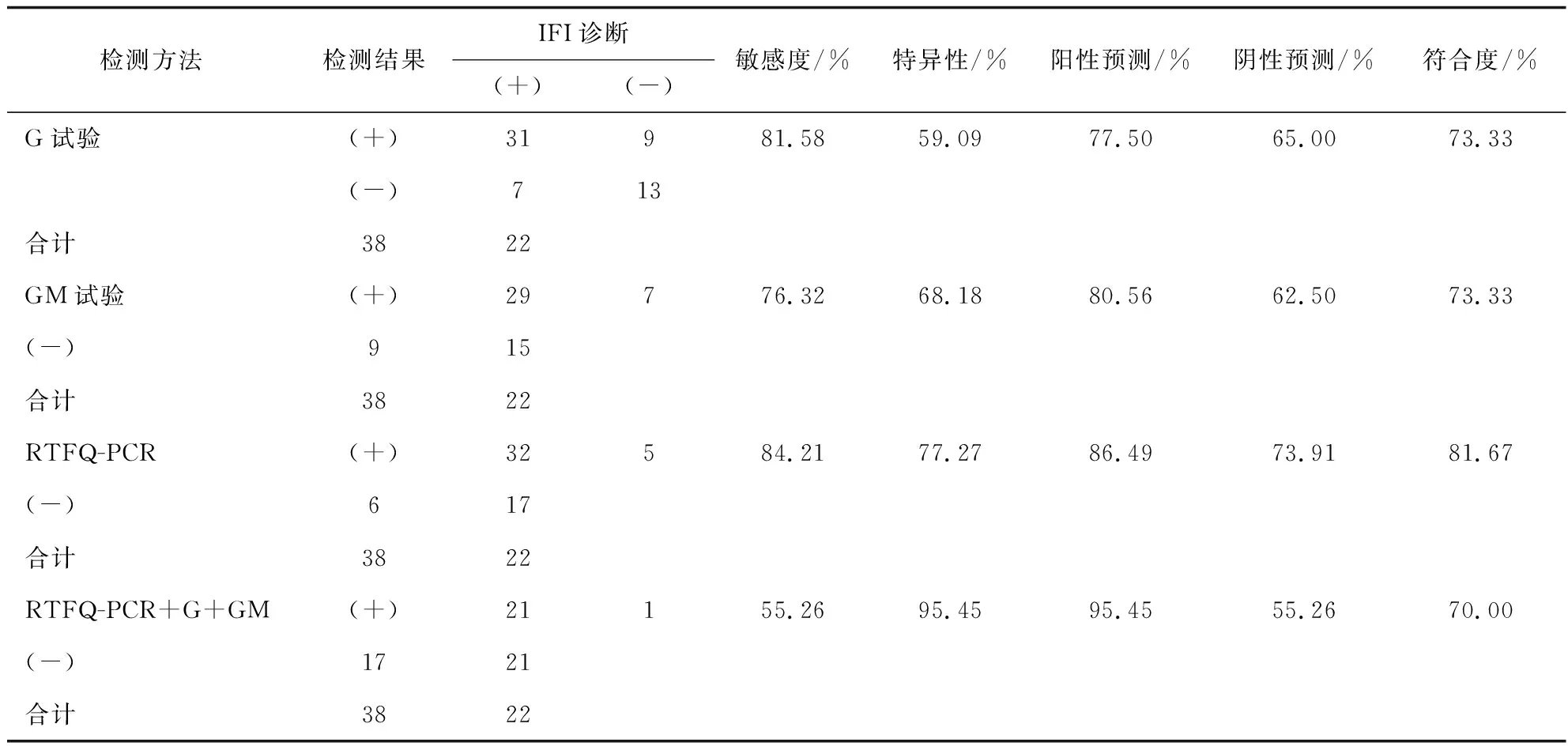
表2 G试验、GM试验、RTFQ-PCR检测及联合检测诊断IFI价值分析Tab.2 G test, GM test, RTFQ-PCR test and combined detection of IFI
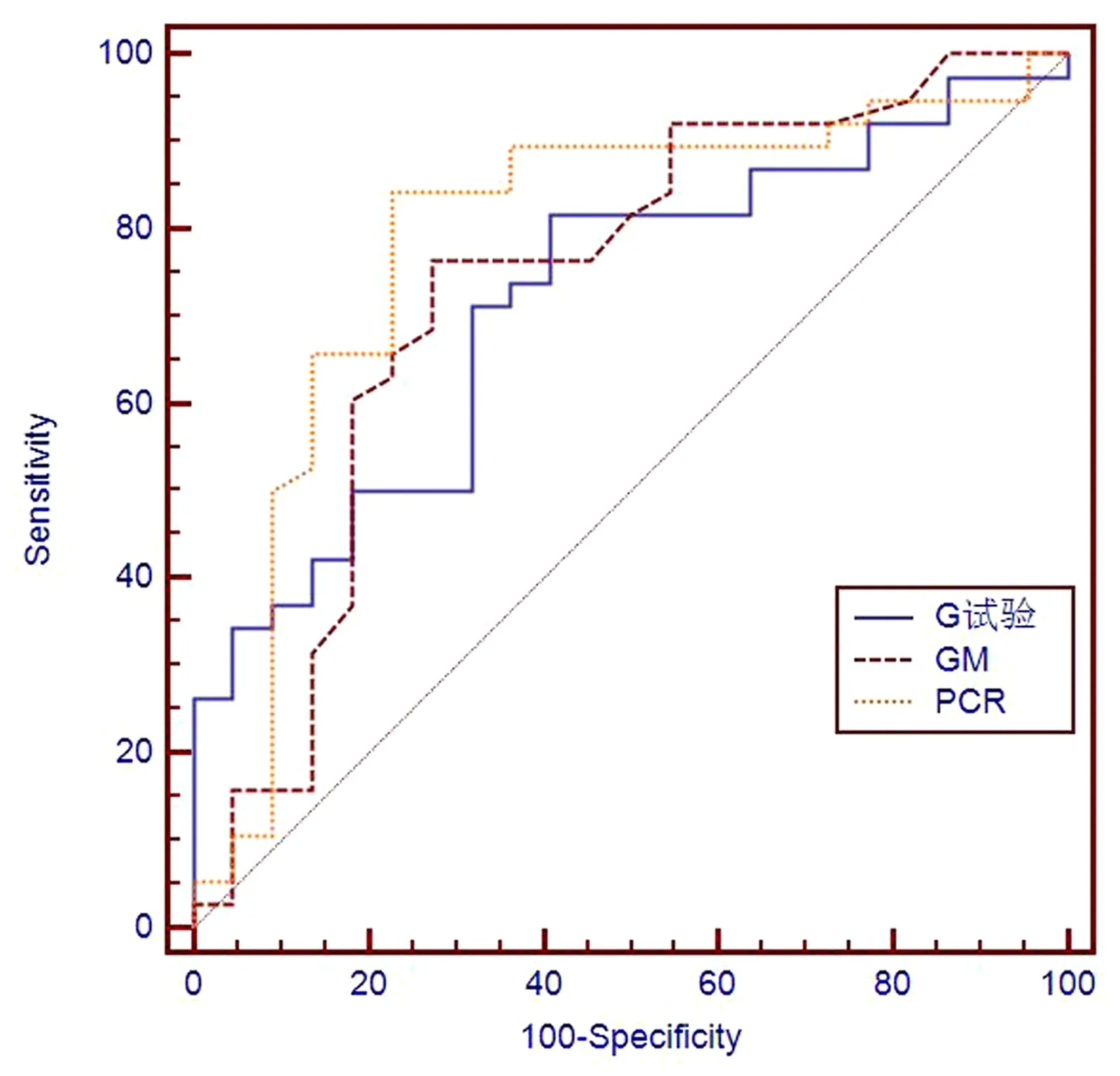
图1 ROC曲线分析Fig.1 ROC curve analysis
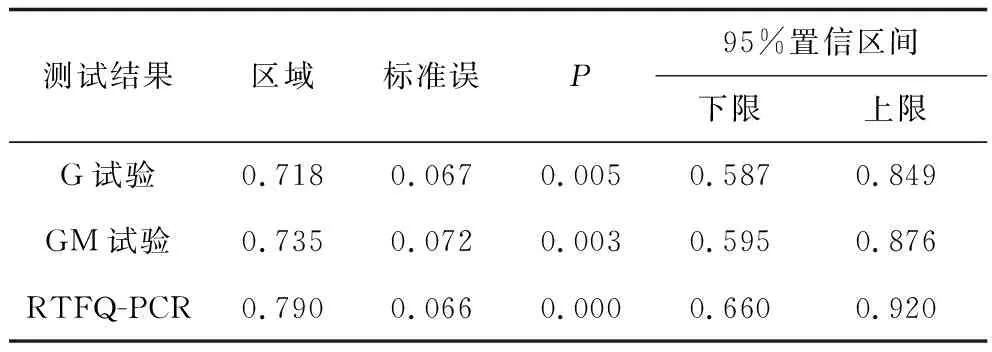
表3 G试验、GM试验、RTFQ-PCR检测诊断IFI临床价值ROC曲线分析Tab.3 G test, GM test, RTFQ-PCR detection and diagnosis of IFI analysis
3 讨 论
侵袭性真菌感染(invasive fungal infection, IFI)是指真菌侵犯皮下组织、黏膜和内脏所引起的真菌感染性疾病[9]。近年来,随着广谱抗生素、抗肿瘤药物、糖皮质激素和免疫抑制剂在临床上的广泛应用,器官移植及各种创伤性检查和治疗手段及导管技术的活跃开展,自身免疫性疾病、艾滋病、恶性肿瘤和糖尿病等基础疾患及人口老龄化等因素,使免疫受损人群不断增加,IFI发病率逐年上升[10]。据最新报道念珠菌感染已上升至院内血源感染的第四位,死亡率第一位;曲霉已为第二位常见侵袭性真菌病,死亡率达60%~90%[11],如此庞大的数字足以引起医患重视。所以IFI的早期诊断对于临床具有极其重要的临床价值和意义。
近年来,IFI的血清学检测取得了较大发展,目前己用于临床快速早期诊断。血清学检测包括真菌(1,3)-β- D葡聚糖(BG)检测和半乳甘露聚糖(GM)检测[12]。(1,3)-β-D葡聚糖是真菌细胞壁的组成成分,可用于诊断多种真菌感染,包括念珠菌,曲霉菌和镰刀菌属,但接合菌和隐球菌除外。当真菌进入人体血液或深部组织后,经吞噬细胞的吞噬、消化等处理后,(1,3)-β-D葡聚糖可从胞壁中释放出来,从而使血液及其他体液中(1,3)-β-D葡聚糖含量增高[13]。而且各项研究[14]显示,(1,3)-β-D葡聚糖水平可随病情而动态变化,对判断病情和疗效有一定意义。在黄耀光等[15]的相关研究中, G试验在侵袭性肺部真菌感染(invasive pulmonary fungal infection,IPFI)患者诊断中, 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF) G试验阳性率为77.31%,血浆G试验阳性率为76.47%,均具有较高的灵敏度。张小华等[16]在对ICU中139例IPFI患者研究中指出,BALF G试验诊断敏感性为80.00%,二者与本研究G试验诊断IFI 81.58%的敏感度基本一致,此外张小华等在研究中还表示,BALF G试验在IPFI诊断中具有20.00%的漏诊率和9.09%的误诊率。而在本研究中G试验诊断特异性较差,且假阳性率高达40.91%,与有关报道基本一致。本研究中GM试验诊断IFI敏感度为76.32%,与陆书华等[17]研究基本一致,且较G试验灵敏度稍差,但其特异性有所上升,且假阳性率有所降低,假阳性率为31.82%。由于二者在IFI诊断中敏感度均不是十分理想,故多个研究支持在实际的临床操作中采用二者联合检测,相关报道[18]表示,二者联合检测其敏感度和特异性有效提高。笔者对此类文献进行分析发现,二者联合检测多以二者结果其一或同时表现为阳性即为阳性标准,在此情况下可知其较高的假阳性率仍不可避免。
随着分子生物学技术的不断进步,IFI早期快速诊断有了新的思路和方向,与传统的培养及表型鉴定相比,分子诊断技术大大缩短了诊断所需时间,同时提高了敏感性和特异性,且操作简便、易于重复[19]。RTFQ-PCR是近年来发展较为迅速,且广泛应用于医疗、农业、食品安全等方面研究的分子生物学技术,在医疗诊断中具有以下优点:①高度自动化,全封闭状态下对扩增产物进行检测,高效解决实验中污染问题,避免出现假阳性结果;②更强的特异性;③对初始基因精确定量,高度的敏感度;④与传统的病理诊断和培养相比,RTFQ-PCR耗时短,发出实验室检查报告仅需2 h[20]。在实际的临床诊疗中时效性具有重要的意义和作用,RTFQ-PCR完全满足临床诊疗需求,并且通过本研究发现,RTFQ-PCR检测IFI在确诊组、临床诊断组、拟诊组及排除组明显提高了IFI临床诊断敏感性和特异性。此外,本研究在联合检测中以RTFQ-PCR+G+GM三种检测结果均为阳性进行计数,研究结果显示,RTFQ-PCR+G+GM联合检测敏感度为55.26%,特异性95.45%,阳性预测值95.45%,阴性预测值55.26%,符合度为70.00%。由于联合检测阳性标准影响,联合检测在IFI中的诊断敏感性较低,在临床实际操作过程中可能存在漏诊情况,但RTFQ-PCR+G+GM联合检测完全改善了假阳性率高这一普遍问题,本研究中RTFQ-PCR+G+GM联合检测有效提高了IFI诊断的准确性。经ROC曲线分析,G试验、GM试验、RTFQ-PCR检测在IFI诊断中均具有较高的临床应用价值,RTFQ-PCR检测(AUC=0.790)优于G试验(AUC=0.718)和GM试验(AUC=0.735)。
综上所述,G试验、GM试验、RTFQ-PCR检测在IFI诊断中均具有较高的临床应用价值,但G试验、GM试验在IFI诊断中假阳性率较高,故在单种方式检测中推荐RTFQ-PCR检测,而RTFQ-PCR+G+GM联合检测则能够明显提高IFI临床诊断准确性。

