HPK1在肿瘤和免疫中的研究进展
褚玉平,晁 旭,唐海龙,贾双双,刘 骁,高广勋
造血祖细胞激酶1 (hematopoietic progenitor kinase 1,HPK1)是有丝分裂原激活蛋白激酶(mito‐gen - activated protein kinase kinase kinase kinase,MAP4K)家族成员之一,是一组催化蛋白质中丝氨酸或苏氨酸残基磷酸化的激酶。MAP4K 家族激酶包括MAP4K1/HPK1、MAP4K2/GCK、MAP4K3/GLK、MAP4K4/HGK、MAP4K5/KHS 和MAP4K6/mink 等,与哺乳动物ste20 丝氨酸/苏氨酸蛋白激酶家族同源。MAP4K家族激酶具有高度相似的蛋白质结构,在调节细胞存活、细胞迁移、细胞凋亡和自噬中发挥重要作用[1]。HPK1参与多种细胞信号级联反应,包括抗原受体信号、细胞凋亡、生长因子信号和细胞因子信号调控。本文将以HPK1 蛋白结构为基础,重点介绍其在疾病病理过程中的调控作用。
1 HPK1蛋白的分子结构、分布与表达
1.1 HPK1 蛋白的分子结构 HPK1 由N 端的ste20样激酶结构域、4 个富含脯氨酸基序,分别为P1、P2、P3 和P4 的中心结构域和远端Citron 同源结构域组成。HPK1 中心结构域包含caspase-3 裂解位点,caspase-3 激活受到严格控制,与单核细胞分化有关[2]。脯氨酸基序能够结合含有SH3结构域的蛋白,如Grb2 和Gads[3]。全长HPK1 在造血细胞中可同时活化JNK和NFkB通路并与多种接头蛋白相互作用;但在凋亡细胞中,HPK1 在DDVD 基序(cas‐pase-3识别位点)处被裂解为N末端(HPK1-N)结构域与C 末端(HPK1-C)结构域,HPK1-C 结构域对NF-kB 通路有抑制作用,而HPK1-N 结构域保留了激活JNK的能力,但不能结合接头蛋白[4]。
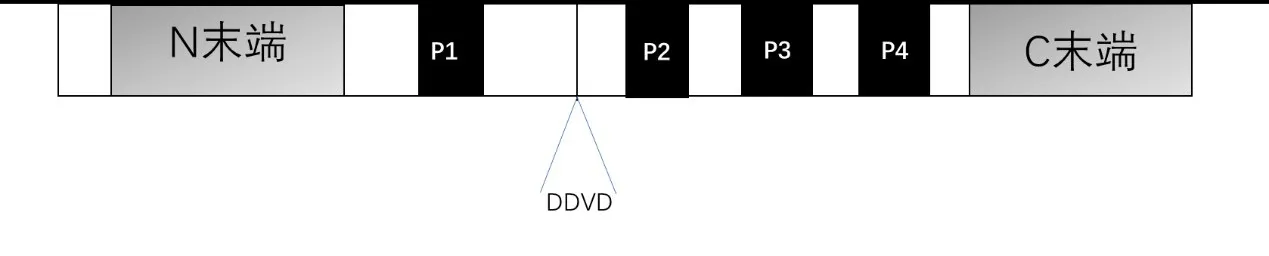
图1 HPK1的结构图
1.2 HPK1蛋白分布与表达 研究表明,HPK1在骨髓、胎肝、淋巴结、胎盘、脾脏和胸腺中高表达,在肺、肾、乳腺和小肠中低表达。HPK1在大脑、心脏、肝脏、肌肉、胰腺、前列腺、睾丸和甲状腺等器官中几乎没有表达[5]。值得注意的是HPK1 表达于所有类型的造血细胞和免疫细胞,如造血祖细胞(包括早期造血祖细胞)、巨噬细胞、树突状细胞、中性粒细胞、单核细胞和肥大细胞,特别是T 细胞(包括原始CD4+T 细胞、记忆CD4+T 细胞和CD8+T 细胞)、B细胞和NK细胞等[6]。
2 HPK1的生物学功能
2.1 HPK1调控细胞功能HPK1是T细胞和B细胞激活的负性调节因子。其负性调节主要通过二聚体的形成和广泛的分子内及分子间重塑来进行[7]。但HPK1缺乏并不影响T细胞和B细胞的发育[8]。
2.1.1 HPK1 负性调控T 细胞功能HPK1是T细胞受体(T cell receptors,TCR)诱导T细胞活化的负性调节因子。HPK1激酶功能的降低与T 细胞激活水平的升高密切相关,表现为T 细胞增殖能力增强以及持续的TCR诱导的钙流动和促炎细胞因子,如IL-2、TNF 水平的持续升高[9]。在肿瘤的临床前模型研究中,降低HPK1 激酶活性可增强T 细胞抗肿瘤能力[10],人和小鼠肿瘤中HPK1表达升高与T细胞耗竭呈正相关[11]。因此,抑制HPK1活性可以抑制T细胞耗竭。HPK1 激酶完全激活需要Thr165 和Ser171残基磷酸化,Ser171残基可以在TCR激活后以依赖于PKD1 的方式被磷酸化,Thr165 残基在TCR 激活后可能是一个自动磷酸化位点[12]。接头蛋白SLP76是TCR 信号转导的关键调控因子,对T细胞发育也非常重要[13]。当TCR激活后,HPK1激酶活性会完全激活,胞浆HPK1被招募到细胞膜上,Tyr381被磷酸化,为接头蛋白SLP76 创造了一个结合位点[14]。活化的HPK1 磷酸化位于SLP76 的Ser376 残基,导致TCR 信号复合体的不稳定,阻碍下游T 细胞激活和增殖。 廖学斌团队[11]证明了HPK1 通过HPK1-NFkB-Blimp1轴介导T细胞功能障碍,图2。
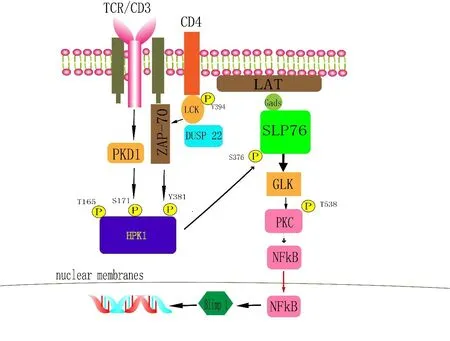
图2 HPK1负性调控T细胞功能示意图
2.1.2 HPK1 负性调控B 细胞功能HPK1 也是B 细胞受体(B cell receptors,BCR)诱导B 细胞活化的负性调节因子。由图3可知HPK1调节BCR的方式与TCR 类似。B 细胞连接蛋白(B cell linker protein,BLNK)是一种调节BCR 下游信号的接头蛋白,BLNK 在 结 构 上 与SLP - 76 同 源。 HPK1 诱 导 的BLNK 在Thr152 处的磷酸化诱导其与BLNK/14-3-3结合,并被一种E3连接酶泛素化,随后发生蛋白降解,进而抑制BCR 信号转导[15]。在生发中心B 细胞中,AKT 优先靶向负调控HPK1,产生负反馈,抑制了上游的BCR 信号。AKT 抑制降低这种负反馈,增强生发中心B 细胞中BCR-近端激酶以及下游BCR信号分子的激活[16],图3。
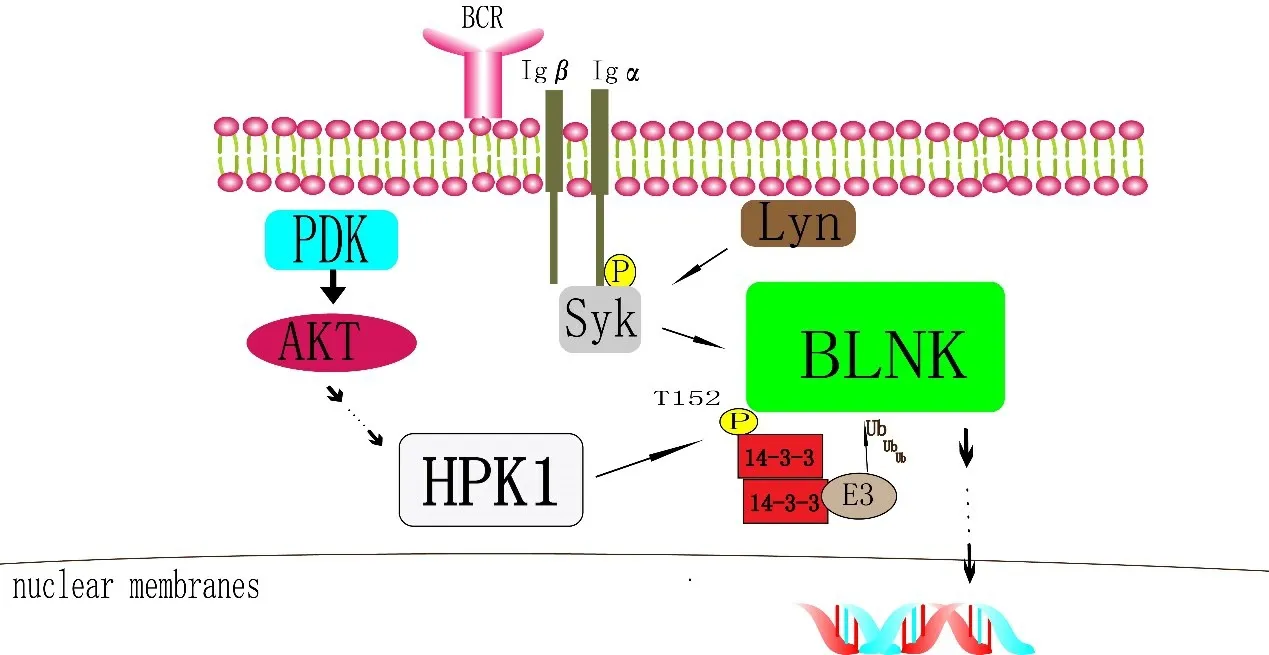
图3 HPK1负性调控B 细胞功能示意图
2.2 HPK1 负性调节免疫功能 HPK1 激酶活性在免疫功能负性调节中起关键作用[17]。MAP4K1KOT细胞TCR 激活阈值降低,增殖活性显著提升,Th1细胞分泌能力增强。在小鼠实验性自身免疫性脑脊髓炎模型中,MAP4K1-/-小鼠在用髓鞘少突胶质细胞糖蛋白衍生的多肽免疫时,出现严重的自身免疫相关症状,超过60%的MAP4K1-/-小鼠在6个月大时出现脾脏肿大,并且在脾、肺、肝和肾等多个脏器中发现有淋巴细胞浸润[18]。遗传学研究发现,靶向阻断HPK1等位基因可以使T细胞和骨髓来源的树突状细胞免疫功能显著增强[9,19]。综合表明,HPK1是TCR 诱导的T细胞活化的负调节因子,也是维持外周免疫耐受的重要分子之一。
3 HPK1参与病理过程调控
3.1 HPK1 与自身免疫性疾病 有学者在自身免疫性疾病研究中,发现HPK1 与系统性红斑狼疮(systemic lupus erythematosus,SLE)有关。和健康对照组相比,SLE 患者CD4+T 细胞中HPK1 mRNA 和蛋白水平降低。含有Jumonji 结构域的蛋白3(ju‐monji domain containing 3,JMJD3)与HPK1 启动子结合减少导致SLE CD4+T 细胞中HPK1 启动子H3K27me3富集增加,抑制HPK1转录[20]。在SLE 患者中HPK1 的表达受抑制与JMJD3 结合减少以及H3K27me3 在HPK1 启动子上富集增加有关,导致SLE患者T细胞过度激活。银屑病关节炎是一种免疫介导的慢性炎症性关节病,HPK1 在银屑病关节炎疾病患者的外周血白细胞中表达水平降低可能与银屑病关节炎的发病相关[21]。目前,在银屑病关节炎疾病中HPK1的研究还较少,仍需进一步研究。
3.2 HPK1 与炎症 在单核细胞分化过程中,全长HPK1 会 被caspase-3 裂 解 为HPK1-N 和HPK1-C,HPK1-N 可以促进祖细胞向单核细胞方向分化[2]。在小鼠原代祖细胞分化过程中阻断caspase 活性会导致HPK1-N水平降低,JNK活性受到抑制,单核细胞分化减弱。对MAP4K1-/-小鼠中性粒细胞的功能分析表明,HPK1 在CXCL1 诱导淋巴细胞功能相关抗原1(lymphocyte function-associated antigen 1,LFA-1)介导的中性粒细胞与细胞间黏附分子1黏附中起关键作用。对小鼠提睾肌观察证实,在MAP4K1-/-小鼠中CXCL1 诱导的白细胞黏附存在缺陷。无论在体外还是体内,β2 整合素介导白细胞的黏附、扩散和中性粒细胞的定向迁移都涉及HPK1。阴囊内注射肿瘤坏死因子α后,MAP4K1-/-小鼠的中性粒细胞黏附和渗出严重受损[22-23]。 这些研究均提示HPK1在急性炎症过程中与LFA-1介导的中性粒细胞功能密切相关
3.3 HPK1 与肿瘤 研究发现,HPK1 与胰腺癌、乳腺癌、结肠癌等多种恶性肿瘤的发生发展相关。
3.3.1 HPK1 与胰腺癌 研究发现,HPK1 蛋白表达缺失与胰腺上皮内肿瘤的进展和侵袭性胰腺导管腺癌的发生密切相关[24]。在超过95% 的胰腺癌中,由于蛋白酶体途径介导的降解导致HPK1 缺失。HPK1 可以抑制细胞增殖,增加细胞周期蛋白依赖性激酶抑制剂p21和p27的表达。致癌受体酪氨酸激酶Axl可以和HPK1相互作用,HPK1可以下调Axl的表达并缩短其半衰期。HPK1 介导的Axl 降解可以被内吞途径抑制剂抑制,如亮肽素、巴氟霉素A1和莫能菌素。在用Axl配体生长停滞特异性6处理的胰腺癌细胞中,HPK1加速Axl从质膜向内体的运动,还增加了Axl 与Cbl 原癌基因的结合。HPK1 通过其C末端结构域与Axl相互作用,使Axl蛋白表达下调。HPK1功能缺失可能导致Axl过表达,从而增强胰腺导管癌中Axl依赖的下游信号转导和肿瘤侵袭。HPK1通过内吞途径针对Axl进行泛素化降解,降低胰腺癌侵袭能力及其下游AKT 和ERK 信号转导。通过TCGA 数据库发现低HPK1 和高Axl 表达水平的肿瘤患者生存期短于低Axl 或高HPK1 表达的患者,综合表明,在胰腺癌中HPK1是一种通过内吞途径靶向Axl降解的肿瘤抑制物[8]。
3.3.2 HPK1 与乳腺癌 Wang 等人[25]首次报道HPK1 的表达与乳腺癌,特别是浸润性导管癌发生发展的潜在联系。由表1和表2可知在雌激素受体(estrogen receptor, ER)阳性组中,HPK1 阳性与总生存率(overall survival,OS)增高相关,在浸润性导管癌组中HPK1 表达水平低于正常乳腺组织;HPK1表达与ER阳性呈显著负相关,与生存期呈正相关。这些数据提示HPK1 可能对肿瘤细胞有抑制作用。在国内也有乳腺癌与HPK1 相关报道,在乳腺癌小鼠肿瘤模型中发现乳腺癌细胞株HPK1 过表达可抑制乳腺癌细胞的增殖、迁移并诱导凋亡[26]。国内研究也表明,在乳腺癌组织中HPK1 表达显著降低[27]。表1 和表2 数据引自Molecular medicine re‐ports, 2017, 16: 4634-4642。

表1 浸润性导管癌患者HPK1蛋白表达与ER表达的关系
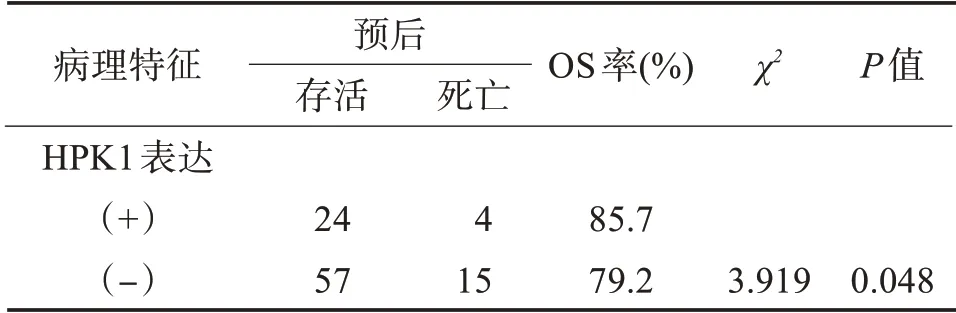
表2 浸润性导管癌ER阳性患者中HPK1表达与预后的相关性
3.3.3 HPK1 与其他肿瘤 在膀胱癌中发现hsamiR-96可能通过上调胰岛素受体底物1和HPK1水平来影响膀胱癌细胞的生长。虽然在膀胱癌中HPK1的表达上调,但其磷酸化过程可能受到抑制,从而阻断了MAPK/ERK 通路[28]。程序性细胞死亡因子4 通过抑制HPK1 的表达阻断c-jun 的激活进而抑制AP-1 依赖的转录,来抑制结肠癌细胞的肿瘤进展及远处转移[29]。在急性髓细胞白血病(acute myeloid leukemia,AML)中发现全长HPK1 是维生素D 诱导的AML 细胞分化的正调控因子,但裂解的HPK1 片段则会抑制AML 细胞的分化[30],表明HPK1 在AML 细胞分化中具有双重作用。在黑色素瘤小鼠模型中,MAP4K1-/-小鼠较正常对照组肿瘤生长速度明显降低,并且浸润性T 细胞的衰竭程度降低,活性或增殖性更高[11]。
3.3.4 HPK1 与肿瘤免疫治疗 将MAP4K1KOT 细胞注射到T 细胞缺陷的Lewis 肺癌小鼠模型中,小鼠表现出强大的T 细胞介导的抗肿瘤免疫[9]。MAP4K1-/-小鼠模型也显示免疫细胞活化和抗肿瘤活 性 增 强[31]。 通 过MAP4K1-/-小 鼠 发 现HPK1 在CD8+T 细胞中的激酶依赖性作用,HPK1 激酶功能的丧失增强了T 细胞受体信号和细胞因子的分泌。MAP4K1-/-小鼠伴随着效应CD8+T细胞功能增强,病毒清除和抑制肿瘤生长作用显著增强[10]。在人乳腺癌的小鼠模型上接受Her2 嵌合抗原受体T 细胞(chimeric antigen receptor T-cell,CAR -T)治 疗,MAP4K1KOCAR-T 细胞体内抗肿瘤效果较PDCD1KOCAR-T 细胞明显提升,肿瘤生长受到明显抑制[11]。HPK1小分子抑制剂化合物K可以使TCR对病毒和肿瘤抗原的敏感性增加,与抗PD1抗体协同增强抗原特异性T 细胞反应,并且可以促进DC 的成熟,动物模型研究也显示小分子抑制剂化合物K和抗PD-1 联合使用可以改善免疫反应和增强抗肿瘤效果[32]。在小鼠结肠腺癌模型中口服HPK1抑制剂与抗PD1药物联合使用较单用抗PD1抗体产生的抗肿瘤的疗效增强,并且没有对体质量产生显著的变化。联合阻断PD-L1 可进一步增强T 效应细胞功能,从而产生比单一靶点阻断更好的抗病毒和抗肿瘤免疫[33]。上述研究表明,MAP4K1KOT 细胞较PDCD1KOT细胞具有更强大的抗肿瘤免疫,联合使用HPK1抑制剂和抗PD1药物可以增强抗肿瘤的疗效。
4 小结与展望
目前,肿瘤免疫治疗已成为肿瘤治疗的重要方法之一,与手术、放化疗和靶向治疗相互补充。对已经发生转移的肿瘤患者,免疫疗法有望成为最有效的治疗方式之一。在肿瘤的发生过程中,往往T 细胞、B 细胞以及树突状细胞的功能决定免疫功能的强弱,HPK1 是T 细胞、B 细胞及树突状细胞激活的负性调节因子,抑制其功能可增强免疫细胞杀伤肿瘤细胞能力,阻断HPK1激酶和抗PD-1/PD-L1具有协同抗肿瘤效应,这些都为肿瘤的治疗提供了新的思路,有望为药物的研发和疾病的治疗提供新的靶点。目前,阻断HPK1在动物模型上取得良好效果,未来靶向HPK1 的策略可从以下几方面展开,①CAR-T 细胞上的应用:基于HPK 敲除的CAR-T 项目正在开展临床研究,初步结果提示,MAP4K1KOCAR-T细胞在多种肿瘤中表现出较好的安全性、有效性和抗肿瘤能力,有望未来为临床上应用提供理论基础。②联合应用:包括与其他临床一线治疗药物或靶向PD-1/PD-L1 治疗联合应用来提高肿瘤的治疗效果,延长患者生存率。③药物研发:蛋白水解靶向嵌合体和小分子抑制剂是当下药物研发的热点,HPK1 可以为药物的研发提供新的靶点。④恢复肿瘤微环境免疫“正常化”:肿瘤微环境中免疫细胞浸润的数量,杀伤能力以及HPK1 表达等都将不同程度影响肿瘤微环境中免疫细胞抗肿瘤能力,靶向HPK1 有望恢复肿瘤微环境免疫功能的“正常化”。考虑到HPK1 在人体的正常生理功能方面也十分重要, 其临床应用仍存在着许多问题与挑战, 需进一步通过临床试验和真实数据研究来完善。

