多系统萎缩患者的尿动力学特点及临床应用
邢添瑛,贾春松,欧彤文
多系统萎缩(multiple system atrophy,MSA)是一类散发的致死性神经变性病,临床表现主要为帕金森综合征、小脑共济失调和不同程度的自主神经症状。较早发生或较严重的自主神经功能障碍是多系统萎缩诊断的重要依据[1]。神经源性下尿路功能障碍是MSA 患者最常见的自主神经损伤表现之一。MSA 的临床诊断主要依据2008 年第二版MSA诊断共识:在自主神经症状方面,若患者具有其他原因无法解释的尿频、尿急、排尿困难,则诊断为可能的MSA;若患者存在尿失禁,则诊断为很可能的MSA[2]。但是,上述下尿路症状并不具有特异性,容易被伴随疾病干扰(如男性前列腺增生),甚至可能出现在相应年龄段的健康人群中[3]。此外,尿频、尿急等下尿路症状也可存在于一些和MSA 临床表现类似但容易混淆的疾病,例如帕金森综合征(Par‐kinson’s disease,PD)[4]。PD 患者由于中脑黑质纹状体系统的多巴胺能神经元丢失,常引起神经源性逼尿肌过度活动甚至急迫性尿失禁[5],可见单纯的期相性逼尿肌过度活动不能作为诊断MSA 的线索。尿动力学检查是评估下尿路功能的可靠方法,特别是神经源性下尿路功能障碍的患者尤其应该进行尿动力学检查[6]。本文将结合MSA 下尿路功能障碍的研究现状及笔者的实践经验,对MSA 患者尿动力学检查的异常特征及临床意义进行综述。
1 逼尿肌活动低下
MSA 患者时常主诉排尿困难、尿等待、尿流变慢和尿不尽,此类排尿期症状是MSA 除尿频、尿急之外常见的下尿路症状表现。α-共核蛋白聚集导致的自主神经损伤常累积脑桥排尿中枢、骶髓节前副交感神经核[7],这些与排尿直接相关的部位受累可引起逼尿肌活动低下,即逼尿肌的收缩力及收缩时长下降(严重者甚至无收缩),导致患者排尿困难。逼尿肌活动低下也是引起残余尿量增多的主要原因,后者常作为诊断MSA 的线索[8-10]。尽管PD患者也可出现逼尿肌收缩力减弱,但通常仍能够维持相对有效的膀胱排空。MSA 患者逼尿肌收缩力受损的程度比PD 普遍更重,因而也具有更加明显的排尿困难症状[11]。值得注意的是,部分MSA患者排尿困难症状并不突出,尿动力学检查也显示逼尿肌收缩力可达到相对正常的数值,但是逼尿肌在等容收缩期的收缩速率下降,尿动力学曲线表现为开放时间明显延长(图1A,B)[12]。若患者的残余尿量不多且无其它导致逼尿肌收缩力受损的合并症(如糖尿病、腰椎病等),开放时间明显延长可作为MSA和PD 鉴别诊断的线索,可能提示早期隐匿的下尿路自主神经损伤[13]。
一些MSA 患者由于神经源性逼尿肌无收缩,膀胱类似低张力的储尿囊,即使残余尿液量非常大,膀胱内压及逼尿肌压力也非常低。但是部分患者逼尿肌无收缩还可伴有顺应性减退。随着膀胱腔内尿液量的增加,逼尿肌压力增高,并达到逼尿肌漏尿点压力,患者主诉尿不尽,点滴状尿失禁。由于男性患者的尿道压较高,逼尿肌漏尿点压力相应也高,使得膀胱储尿期高压,对上尿路的带来更大的负担。由于MSA 患者生存期较短,逼尿肌收缩力严重受损更是提示预后差,但由此造成的肾功能衰竭还相对罕见[14]。女性患者也可出现这种尿动力学表现,但是较男性少见,并且逼尿肌漏尿点压力也明显低于男性患者。
MSA主要累及中老年人群,在这个年龄段的女性患者中,压力性尿失禁并不少见。患者常表现为咳嗽、打喷嚏漏尿,严重者在床上翻身时也可漏尿。这部分患者有时并不能准确描述自己的症状,时常主诉憋不住尿,容易对MSA 相关尿失禁的诊断带来误导。存在压力性尿失禁(特别是重度压力性尿失禁)的患者利用腹压排尿,可能增加腹压后尿液即能顺利排出,患者并未感觉到排尿困难,相应的残余尿量可能也并不多甚至无残余尿,给MSA 的诊断带来疑问。尿动力学检查可能发现此类患者逼尿肌反而无收缩,且腹压漏尿点压力很低(图1C)。有学者报道影像尿动力学检查可能发现此类患者充盈期膀胱颈即开放(提示括约肌功能障碍),是MSA患者相对特异的表现[15]。
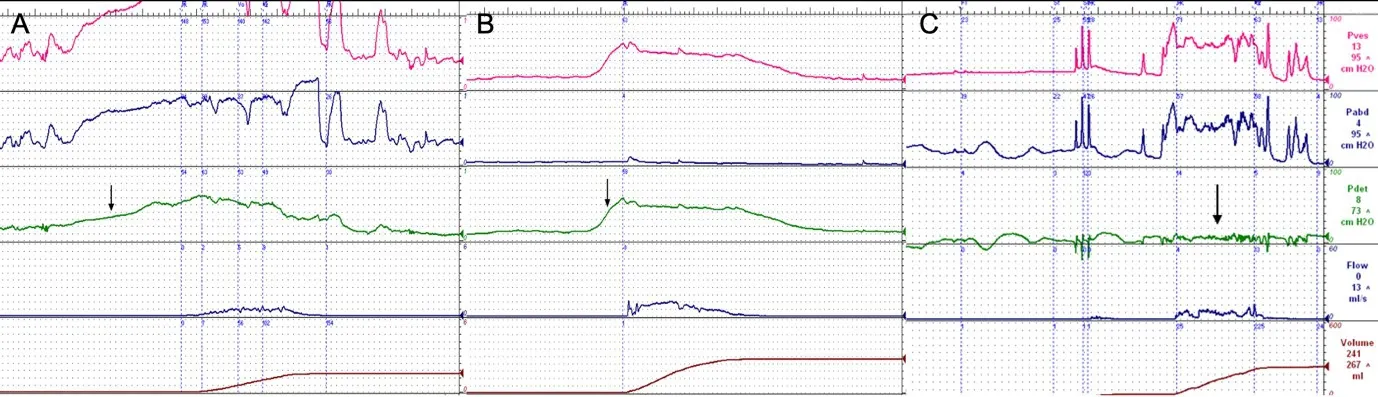
图1 多系统萎缩和帕金森病患者的尿动力示意图
2 神经源性膀胱出口梗阻
膀胱出口梗阻是常见的排尿障碍原因。在非神经源性膀胱出口梗阻的患者中,前列腺增生、膀胱颈纤维化或尿道狭窄是常见的病因。而对于神经源性膀胱出口梗阻的患者,可能原因包括神经源性逼尿肌括约肌协同失调(detrusor sphincter dys‐synergia,DSD)或内/外括约肌舒张障碍。
健康人排尿时逼尿肌收缩,同时尿道括约肌舒张,尿液得以正常排出。若患者合并DSD,逼尿肌收缩的同时尿道外括约肌不能正常舒张反而不自主的收缩,引起排尿梗阻症状。其发生的原因为脑桥与骶髓之间的病变导致脑桥排尿中枢与骶髓的传导受阻,可见DSD 反应了中枢自主神经系统的病变[6]。由于PD 患者的自主神经病变多发生于外周,因此DSD 特别是早期发生的DSD 在PD 患者中其实很少见(早期的研究由于缺乏诊断标准纳入了相当的MSA 患者)[7,16],可能作为MSA 的诊断线索(图2)。在早期MSA 患者中,逼尿肌的收缩力在相当程度上得以保留,不具有典型的MSA 逼尿肌收缩力受损的表现,患者通常无排尿困难的症状,残余尿量也不多。既往MSA 自然病史的研究表明,相当一部分患者在起病前3 年对多巴类药物具有一定的反应[17]。对于这部分早期患者来说,自主神经受累的证据往往不足,非常容易被误诊为PD,此时DSD 可能成为提示MSA 的线索。DSD 引起的症状可能为患者不易察觉的排尿速率减慢,但也可能引起严重的排尿困难。在尿动力学检查中同步行肌电图监测可协助诊断DSD。由于尿道外括约肌和肛门外括约肌同样受到骶髓Onuf‘s 核的支配,因此临床上更多使用位置更加表浅的肛门外括约肌替代尿道外括约肌行肌电图同步监测。肌电图的金标准为应用同心圆针状电极,但考虑到针状电极使得本身有创的尿动力学检查更为有创,给患者带来心理负担,更方便无创的表面贴片电极也是一种选择,但敏感度则不如针状电极[18]。此外,肌电图仅能监测到外括约肌的电活动,对于受交感神经支配的内括约肌(平滑肌)的功能则无法通过此方法来评估,而有学者认为逼尿肌-内括约肌协同失调在MSA 中甚至可能更为常见[19]。通过测量尿道不同部位的尿道压也是评估DSD的方法,但是有研究表明测量尿道压和肌电图的结果一致性尚不统一,DSD 的诊断仍是具有挑战性的问题[20]。由于MSA患者体位性低血压常见,部分患者服用屈昔多巴等α 受体激动剂类药物治疗,这类患者的膀胱出口梗阻排尿困难还需除外药物的作用。
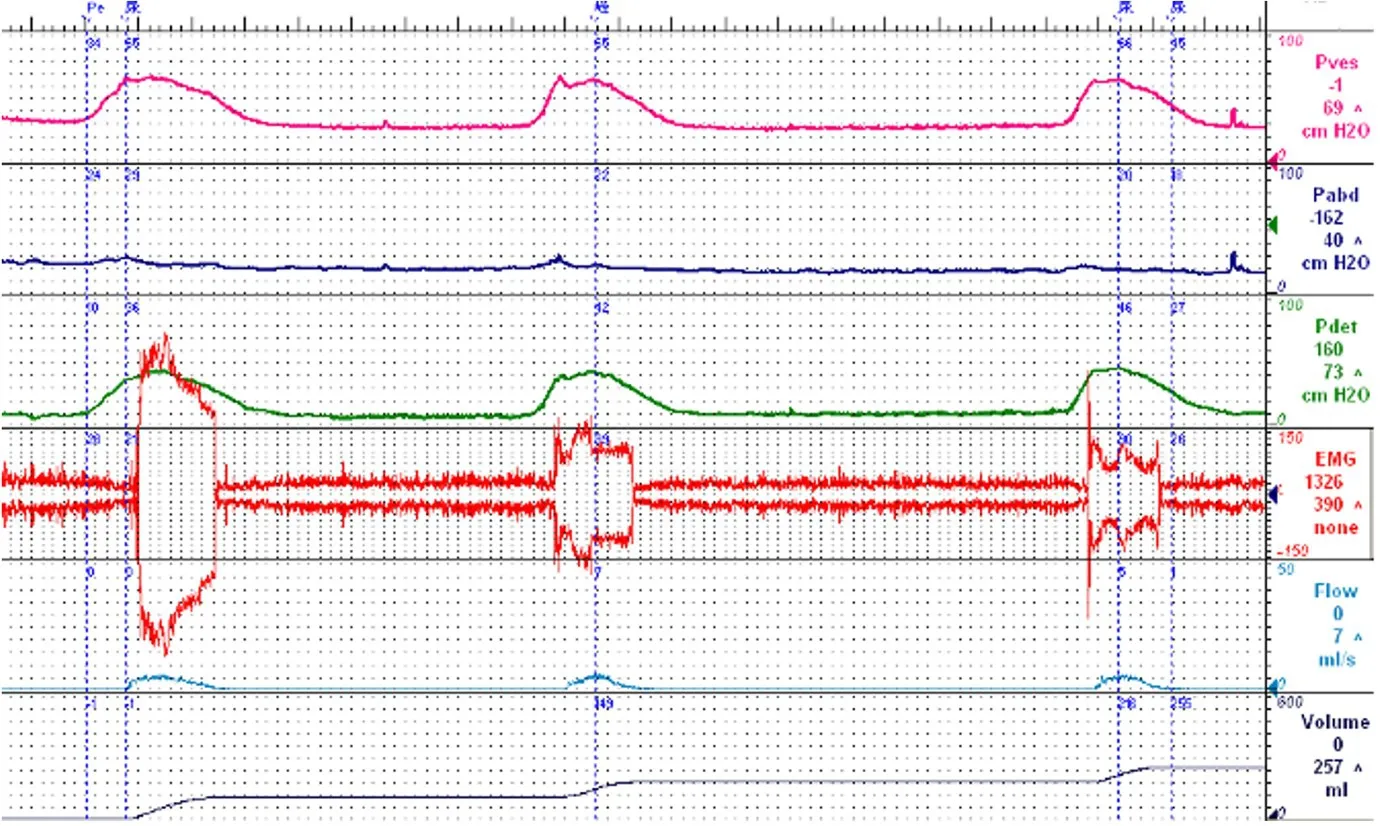
图2 逼尿肌括约肌协同失调示意图
3 频繁逼尿肌期末过度活动伴尿潴留
逼尿肌过度活动本身并不能作为MSA 患者特征性的尿动力学表现;PD 最常见的尿动力学异常即为期相性或期末逼尿肌过度活动。但是,少数MSA 患者于尿动力学检查过程中在下达排尿指令后无法自主排尿,而在灌注到相对固定的膀胱测压容积时出现短暂的期末逼尿肌过度活动伴不可抑制的尿急和漏尿,漏尿结束后膀胱内仍有大量残余尿(图3)。患者尿液的排出仅能依靠此种方式,临床表现为频繁的尿失禁且每日的失禁量较大。
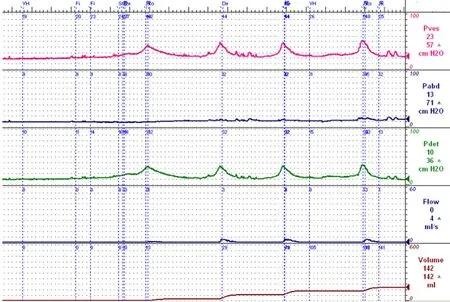
图3 频繁期末逼尿肌过度活动伴尿潴留的示意图
有关该类型下尿路功能障碍的发生机制和定位诊断尚不明确。膀胱感觉纤维上行传导至中脑导水管周围灰质,并在更高级的中枢中整合成尿意,高级中枢在下达排尿指令后将信号再通过中脑导水管周围灰质传递给脑桥排尿中枢,并进一步下行传导至骶髓和盆腔神经,引起逼尿肌收缩[21]。中脑的神经退行性改变导致膀胱感觉的显著减退,并且失去高级中枢对脑桥排尿中枢的控制,导致患者无法自主排尿和控尿。在逼尿肌收缩时,收缩力和收缩时间均显著减退,可能主要为脑桥和骶髓的病变所致[22-24]。因此,该尿动力学表现可能反应广泛自主神经系统的病变。该种尿动力学表现在MSA患者中并不常见,并且暂未见于其它类型的帕金森叠加综合征。笔者所见的患者均表现为快速进展的帕金森综合征,病史相对较短,服用高剂量的多巴类药物反应仍差,并且有较严重的尿失禁。这些特点提示此种类型的尿动力学表现可能与高度侵袭的疾病过程有关,患者死亡距离尿动力学检查的时间均不足1 年。由此可见,此种尿动力学类型可能提示神经系统原发疾病呈“恶性”病程且预后较差,值得临床医生警惕。
虽然大多数MSA 患者行尿动力检查能够发现相对特征性的异常,但是少数患者可能没有阳性发现。首先,尿动力学检查虽然为评估下尿路功能较为准确的方法,但是可能仍然具有一定的局限性。传统的尿动力学检查仅能反应检查当时的储尿和排尿情况,但有可能不能代表患者整体的下尿路功能情况。活动的尿动力学检查(ambulatory urody‐namic study,AUS)可持续监测一段时间内患者的储尿和排尿周期,患者不处于固定的体位,可能会比传统尿动力学检查具有更多的阳性发现[25],但是该方法目前并未得到大规模的临床应用。部分早期MSA患者可能自主神经损伤程度轻,未累及支配下尿路的区域,导致尿动力学检查结果正常。最后,我们也需考虑神经系统原发疾病诊断的正确性。虽然MSA 容易被误诊为PD,其它疾病如进行性核上性麻痹、路易体痴呆有时也会被误诊为MSA,特别是当患者出现共济失调、锥体束征和自主神经症状时(特别是尿失禁)[26]。不过尽管尿动力学检查具有一定的局限性,但对于MSA 患者而言,尿动力学检查不仅是了解下尿路功能障碍的有力手段,更是可靠的评估自主神经功能的方法。

