USP49抑制IL-1β诱导的软骨退行性改变
杨澜波 邹春雨 米豫飞 黄 涛 王战朝
骨关节炎是一种慢性的关节退行性疾病,以软骨细胞减少与进展性软骨退变为主要特征[1]。软骨细胞是关节软骨中唯一的细胞,其凋亡直接参与骨关节炎的病理过程[2]。软骨细胞外基质是软骨的主要组成部分,也是骨关节炎的主要靶点。因此,抑制软骨细胞凋亡及细胞外基质降解是预防骨关节炎的有效途径。多项研究表明,Wnt/β-catenin通路不仅影响软骨细胞外基质的降解,在软骨细胞凋亡中亦扮演着重要角色,被认为是骨关节炎治疗的潜在靶点[3]。同时,研究显示,泛素特异性蛋白酶49(ubiquitin specific proteases 49,USP49)具有抗肿瘤、抗病毒等多种作用,但尚无作用于骨关节炎的相关报道[4,5]。本研究首先通过NCBI基因数据库分析发现,USP49在骨关节炎患者中存在异常表达。以此为基础,了解USP49在IL-1β预处理的软骨细胞中的表达水平,进一步检测上调USP49能否对Wnt/β-catenin通路、软骨细胞凋亡和软骨细胞外基质降解相关蛋白表达产生影响,通过本研究了解USP49在骨关节炎发病机制中的具体作用。
材料与方法
1.实验动物与主要试剂:4周龄SD大鼠由上海斯莱克实验动物有限公司提供,实验动物许可证号:SCXK(沪)2017-0005,本研究经中国人民解放军第989医院医学伦理学委员会审批后实施。RPMI-1640培养基(美国Hyclone公司),胎牛血清(美国Gibco公司),Revert Aid First Strand cDNA Synthesis试剂盒及SYBR Green PCR 试剂盒(美国Thermo Fisher公司),兔抗鼠Collagen II、SOX9、β-actin抗体(英国Abcam公司),兔抗鼠USP49、MMP-1及MMP-13单克隆抗体(美国Affinity公司),兔抗鼠β-catenin单克隆抗体(美国Cell Signaling公司),重组IL-1β蛋白(美国Sigma-Aldrich公司),pcDNA3.1(+)-USP49真核表达质粒(上海基尔顿生物科技有限公司)。
2.USP49在骨关节炎患者中的表达:基于NCBI基因表达数据库中的GSE57218数据集,使用 GEO2R 工具做差异分析,定义组别为骨关节炎组及正常组,比较 USP49 在正常样本与骨关节炎样本中的表达差异[6]。
3.软骨细胞的原代培养与鉴定:处死SD大鼠,无菌取出膝关节软骨,经0.25% 胰蛋白酶及0.2% Ⅱ型胶原酶消化后获得细胞接种于培养瓶中,放入细胞培养箱(37℃、5% CO2、饱和湿度)中培养。细胞生长至60%~80%融合时,按照1∶3比例传代。软骨细胞爬片,固定并使用0.5% Triton X-100渗透后分别加入Collagen Ⅱ及SOX9抗体孵育过夜,之后加入Alexa Fluor 488标记的山羊抗兔IgG室温孵育2h,DAPI与抗荧光淬灭剂封片,激光扫描显微镜观察。
4.RT-PCR及Western blot法检测IL-1β对USP49表达的影响:取生长活跃的软骨细胞,分别加入PBS,5、10、20ng/ml的IL-1β孵育24h。采用Trizol 法提取总RNA,反转录为cDNA。以β-actin为内参,配置反应体系25μl,RT-PCR反应程序为:95℃预变性10min,95℃变性15s,60℃变性45s,共40个循环。USP49 mRNA水平计算的方法为2-ΔΔCt。USP49及β-actin引物由上海捷瑞生物有限公司合成,序列如下:β-actin上游引物:5′-GTCCCTGTATGCCTCTGG-3′,下游引物:5′-ATGTCACGCACGATTTCC-3′。USP49上游引物:5′-GTAACAGCAAACGACGAAAG-3′,下游引物:5′-GTAGTGTCCTGAGCCAAACC-3′。取生长活跃的软骨细胞,分别加入PBS,5、10、20ng/ml的IL-1β孵育24h,采用RIPA法提取总蛋白。将25μg待测蛋白及7μl marker加入10% SDS-PAGE预制胶中,以β-actin为内参,电泳约80min,待样品跑至底部时停止电泳。转膜封闭后加入USP49的一抗(1∶1000)后置于4℃湿盒中孵育过夜。加入HRP标记的二抗溶液(1∶1000),室温下摇动孵育1h。滴加ECL发光液,使用Tanon-5200 ECL记录蛋白印迹,使用Image J软件计算相对蛋白水平。
5.USP49过表达(over-expressed USP49, oeUSP49)软骨细胞的构建与验证:取位于对数生长期的软骨细胞,将oeUSP49质粒或空质粒分别与Lipofectamine 2000转染试剂混匀,室温静置20min后加入软骨细胞,继续培养60h。RT-PCR及Western blot法检测未转染的软骨细胞(对照组)、空质粒转染软骨细胞(空白组)、USP49过表达软骨细胞(oeUSP49组)中USP49的mRNA水平及蛋白表达,方法同前。
6.IL-1β对正常软骨细胞及oeUSP49软骨细胞的影响:于原代软骨细胞中加入PBS,空白质粒转染软骨细胞、oeUSP49软骨细胞中加入10ng/ml IL-1β,共同孵育24h。待测软骨细胞洗涤后先后加入5μl Annexin V-FITC 4℃避光孵育15min及5μl PI 4℃避光孵育5min后上机检测,计算凋亡细胞的百分比。Western blot法检测USP49、β-catenin、MMP-1和MMP-13的蛋白表达,方法同前。

结 果
1.USP49在骨关节炎患者中的表达(图1):骨关节炎患者样本(8.646±0.525,n=33)较正常人样本(9.764±1.047,n=7),USP49表达显著降低(P=0.000)。
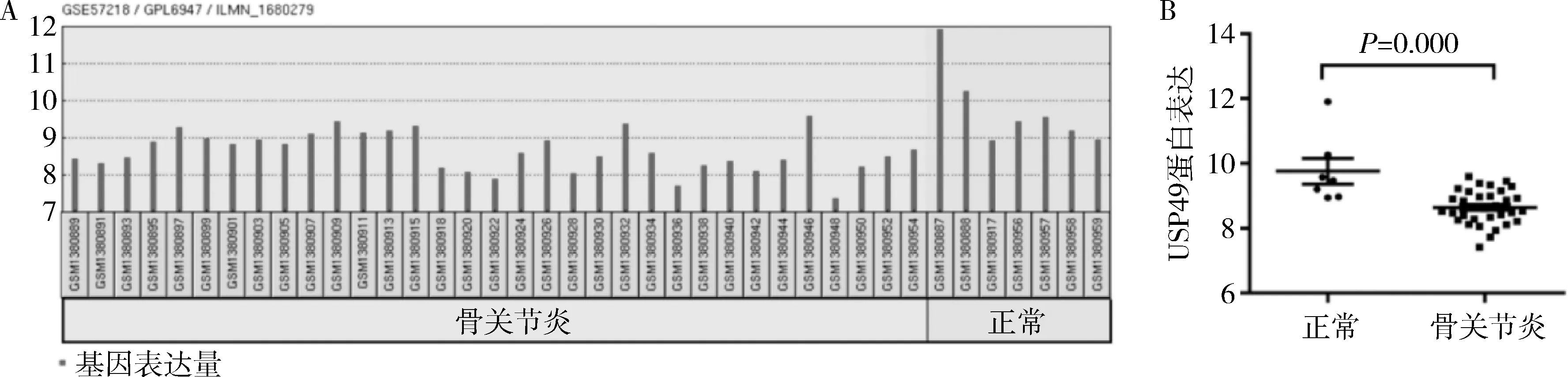
图1 GSE57218数据库中USP49在正常与骨关节炎样本中的表达差异A.数据库中各样本USP49基因的表达量;B.正常人与骨关节炎患者USP49的表达差异
2.原代软骨细胞的鉴定:Collagen Ⅱ在胞质中均匀分布,而SOX9集中表达于细胞核(图2)。Collagen Ⅱ与SOX9分别是软骨细胞胞质与胞核中的标志性抗原,故所培养细胞为软骨细胞。

图2 原代培养大鼠软骨细胞的Collagen Ⅱ和SOX9免疫荧光鉴定(×400)
3.IL-1β对USP49表达的影响:RT-PCR检测(图3A)显示,IL-1β干预后软骨细胞中USP49 mRNA水平与PBS比较显著降低,其中10ng/ml及20ng/ml IL-1β干预后USP49 mRNA降低非常显著(P=0.000);同时,10ng/ml较5ng/ml IL-1β干预后USP49 mRNA显著下调(P<0.05)。Western blot法结果显示,与PBS比较,IL-1β处理软骨细胞后USP49表达明显下调(图3B和图3C)。另外,与5ng/ml比较,10ng/ml IL-1β干预后USP49表达显著下调(P<0.05)。

图3 IL-1β对软骨细胞USP49的mRNA及蛋白表达的影响A.USP49 mRNA表达水平;B、C.USP49蛋白表达水平。与PBS比较,*P<0.05,**P<0.01,***P=0.000;与5ng/ml IL-1β比较,#P<0.05
4.USP49过表达软骨细胞的构建与验证:与未转染和空质粒转染比较,RT-PCR(图4 A)与Westernblot法检测(图4B)显示,oeUSP49质粒转染软骨细胞中USP49 mRNA与USP49蛋白水平显著上调(P=0.000)。转染后USP49表达明显上调,过表达USP49软骨细胞构建成功。

图4 USP49过表达软骨细胞的USP49 mRNA及蛋白表达水平A.USP49 mRNA表达水平;B.USP49蛋白表达水平。与对照组及空白组比较,*P=0.000
5.IL-1β对正常软骨细胞及oeUSP49软骨细胞的影响:流式检测(图5)发现,与对照组比较,空白组凋亡软骨细胞明显增多(P=0.000);与空白组比较,oeUSP49组凋亡软骨细胞显著减少(P=0.000)。Western blot法检测结果显示(图6、图7),与对照组比较,空白组软骨细胞中USP49表达显著降低(P<0.01);而oeUSP49组较空白组软骨细胞中USP49表达明显升高(P=0.000)。与对照组比较,空白组软骨细胞中β-catenin,MMP-1、MMP-13水平显著上调(P=0.000);而oeUSP49组较空白组软骨细胞中β-catenin(P=0.000),MMP-1(P<0.01)、MMP-13(P<0.01)水平显著下调。

图5 流式细胞仪检测IL-1β诱导的USP49过表达软骨细胞凋亡与对照组比较,*P=0.000; 与空白组比较,#P=0.000
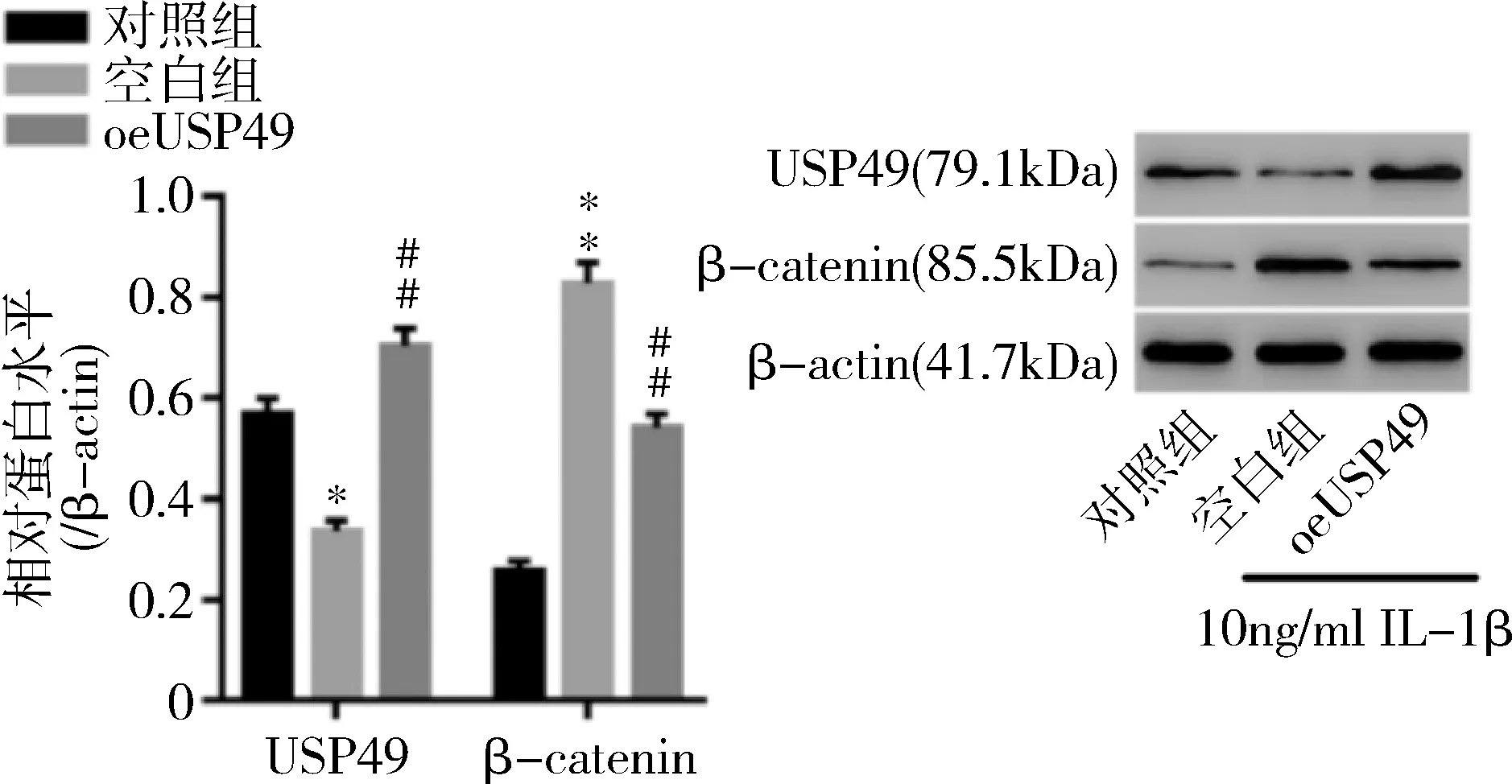
图6 IL-1β预处理软骨细胞后USP49和β-catenin的表达与对照组比较,*P<0.01,**P=0.000;与空白组比较,##P=0.000

图7 IL-1β预处理软骨细胞后MMP-1和MMP-13的表达与对照组比较,*P<0.01;与空白组比较,#P<0.01
讨 论
骨关节炎是最为常见的健康问题之一,其发病机制仍不清楚,治疗以减轻症状为主,尚无疗效明确的药物[7]。因此,寻求可有效治疗骨关节炎的靶点是目前的研究热点。
蛋白质合成和降解之间的平衡维持了真核细胞的稳态。其中,泛素化介导了主要的非溶酶体胞内蛋白降解途径,其包括3种主要成分,即蛋白酶体全酶、若干泛素连接酶和去泛素酶[8]。泛素对蛋白质的翻译后修饰(泛素化与去泛素化)是调控细胞诸多生物学行为的一个主要方式。泛素化与去泛素化是动态可逆的,去泛素酶通过裂解靶蛋白结合的多泛素链或单泛素逆转泛素化,抑制靶蛋白经泛素-蛋白酶体途径降解,调控体内蛋白水平与活性,进而影响各种生理过程[9]。研究表明,去泛素酶涉及许多疾病,如癌症、炎症和感染等[10]。
USP49是一个含有泛素特异性蛋白酶结构域和锌指连接结构域的去泛素酶,主要存在于细胞核[11]。Zhang等[4]研究发现USP49与ATP酶形成复合物,通过特异性去泛素化组蛋白H2B来影响DNA的转录。Ye等[5]揭示USP49通过去泛素化MITA调控先天抗病毒的信号通路。Tu等[12]在心肌细胞的缺血再灌注损伤中发现,USP49通过去泛素化调控DUSP1-JNK1/2通路,提高心肌细胞的活力并抑制凋亡。赵彦芬等[13]研究显示特异性沉默USP49表达可改善糖尿病大鼠痛敏反应,其机制可能与USP49介导的FKBP51蛋白去泛素化有关。本研究采用NCBI基因数据库分析发现USP49在骨关节炎患者中表达下调,进一步检测发现骨关节炎软骨细胞中USP49表达显著降低,说明USP49可能在骨关节炎的发生、发展中起关键作用。通过构建USP49过表达软骨细胞,发现USP49表达上调之后软骨细胞凋亡减弱,软骨降解相关蛋白表达下调,表明USP49可能通过抑制软骨细胞凋亡及软骨降解来控制骨关节炎进展。
骨关节炎的病理机制中涉及多个信号通路,其中,Wnt/β-catenin通路通过激活异常基因和蛋白质表达,上调基质金属蛋白酶(MMPs)水平,导致软骨细胞的凋亡和细胞外基质的降解,加速软骨退变[14]。β-catenin作为此通路的重要成分,参与骨关节炎的病理过程[15]。研究显示,Wnt/β-catenin通路通过上调MMP-13等MMPs表达,加速软骨基质降解,促进骨关节炎的发生和发展[16]。此外,Wnt/β-catenin通路具有调节软骨细胞的成熟、分化和凋亡的作用[17]。条件激活Wnt/β-catenin通路可致小鼠软骨细胞的异常分化和骨关节炎发生;阻断此通路可减少MMPs的产生,改善骨关节炎[18]。Miclea等[19]研究认为抑制Wnt/β-catenin通路可减少软骨细胞凋亡,控制软骨退变。所以,抑制Wnt/β-catenin通路可能是治疗骨关节炎的一种选择[20]。本研究发现,USP49过表达可显著下调β-catenin表达,上调软骨降解相关蛋白表达,抑制软骨细胞凋亡,说明USP49可能正是通过抑制Wnt/β-catenin通路减弱软骨细胞凋亡及软骨降解,控制骨关节炎进展。
综上所述,USP49可能通过Wnt/β-catenin通路抑制IL-1β诱导的软骨退变。本研究揭示了USP49在骨关节炎中的表达及干预软骨退变的机制,为下一步寻找通过干预USP49治疗骨关节炎的药物提供了重要的实验基础。
——一道江苏高考题的奥秘解读和拓展

