SPG20甲基化和EGFR表达在肺腺癌中相关性及临床意义
赵宝山 孙光蕊 张志民 张 旭 辛国华 梁宗英
全世界范围内原发肺腺癌的发生率逐年递增,已超过鳞癌成为肺癌的最常见病理类型[1]。医学技术的进步使得肺癌患者的整体生存率虽有所提高,但仍然很低[2]。表皮生长因子受体(epidermal growth factor receptor, EGFR)是目前公认的与肺腺癌发生、发展关系最为密切的基因之一。EGFR能启动细胞内异常信号转导导致肿瘤的产生,并使肿瘤细胞增殖、分化、迁移凋亡等功能发生明显变化[3,4]。表观遗传学中的甲基化修饰在恶性肿瘤的发生与发展过程中起到十分关键的作用,异常甲基化修饰会导致基因转录、翻译的功能改变,进而导致癌症的发生。最新研究发现,SPG20基因异常甲基化与结直肠癌、肝癌和胃癌之间存在密切关系,并作为早期事件[5,6]。本研究通过检测肺腺癌组织内SPG20甲基化及EGFR水平,探讨二者在肺腺癌发生过程中的相关性,以期为肺腺癌的病理生理机制研究和临床治疗提供理论依据。
资料与方法
1.标本:选取2019年1月~2020年10月承德医学院附属医院胸外科原发肺腺癌手术患者70例;术前均未进行任何治疗。实验组为腺癌组织,对照组为正常肺组织(距癌组织边缘>6cm)。其中男性17例,女性53例;≥60岁27例,<60岁43例;吸烟患者12例,不吸烟患者58例;按照IASLC第8版制定的标准进行TNM分期:Ⅰ期37例,Ⅱ期26例,Ⅲ期7例;组织学分级:高分化8例,中分化57例,低分化5例;有淋巴结转移7例,无淋巴结转移63例。本研究经过笔者医院医学伦理学委员会批准通过。
2.主要试剂:甲基化试剂盒购自德国Qiagen公司;焦磷酸测序试剂购自美国CST公司;DNA提取试剂盒购自北京全式金生物有限公司;EGFR抗体购自英国Abcam公司。甲基化引物(华大基因合成):上游引物:5′-AGGAAGTATGAAAGAATGTATTGTAAAG-3′;下游引物:5′-CCCCTCAAAATTAAACAACCTTTCTCTACA-3′。
3.实验方法:(1)焦磷酸测序法检测法检测甲基化:提取DNA,以重亚硫酸盐转化试剂盒对DNA进行亚硫酸盐修饰。低温保存备用。甲基化的反应条件为:95℃预变性3min,94℃变性30s,50℃退火,72℃延伸1min,40个循环,最后一个循环72℃延伸7min。应用Pyrose Quencing软件分析甲基化状态。4个CpG位点甲基化改变平均值作为甲基化结果,以远癌正常肺组织作为实验对照组。(2)免疫组织化学(SP):石蜡组织切片脱蜡。3%甲醇-H2O2溶液及枸橼酸钠缓冲液加热处理组织切片。非免疫山羊血清封闭,加一抗,孵育60min,加入二抗;PBS处理后,加入链亲和素-过氧化物酶工作液;DAB显色,苏木精复染,树胶封片固定。(3)免疫组化判断标准:根据细胞膜、胞质染色程度和着色阳性细胞所占百分率进行评价计分(每张切片高倍镜下随机观察10个视野);染色强度评分标准(A):无色(0分),淡黄色(1分),棕黄色(2分),棕褐色(3分)。着色阳性细胞所占百分率评分标准(B):1分(阳性细胞≤10%),2分(阳性细胞>10%~50%),3分(阳性细胞>50%~75%),4分(阳性细胞>75%)。以A+B所得分数作为评判标准:0~2分为阴性,3~-4分为阳性,5~7分为强阳性。(4)Western blot法检测蛋白表达:提取蛋白,测定浓度;常规制备电泳蛋白上样液,进行SDS聚丙烯酰胺凝胶电泳。电泳后,4℃,90V 60~80min转膜。加一抗4℃过夜。次日孵育二抗,重复洗膜3次。

结 果
1.SPG20甲基化水平:详见表1。

表1 SPG20在腺癌组织和正常肺组织中的甲基化水平
2.EGFR、SPG20蛋白表达水平(SP法):在腺癌组织中EGFR基因阳性表达为72.86%,显著高于正常肺组织的表达(18.57%),二者比较差异有统计学意义(P<0.05);SPG20在腺癌组织中阳性率为31.43%,低于正常肺组织(77.14%),差异有统计学意义(P<0.05),详见图1和表2。

表2 EGFR和SPG20在腺癌组织和正常肺组织中的表达水平

图1 EGFR和SPG20在腺癌组织及正常肺组织中的表达(HE,×200)A.EGFR腺癌组织中阳性;B.EGFR正常肺组织中阴性;C.SPG20腺癌组织中阴性;D.SPG20正常肺组织中阳性
3.EGFR、SPG20蛋白表达水平(Western blot法):EGFR在腺癌组织中表达为76.38%±2.67%,高于正常肺组织23.14%±1.86%(图2);SPG20在腺癌组织中表达为18.42%±1.34%,高于正常肺组织65.75%±2.47%,差异均有统计学意义(P<0.05),详见图3。

图2 EGFR在腺癌组织及正常肺组织中表达水平与腺癌组织比较,*P<0.05

图3 SPG20在腺癌组织及正常肺组织中表达水平与腺癌组织比较,*P<0.05
4.SPG20甲基化与EGFR相关性:SPG20甲基化和EGFR表达相关系数为r=1.00,χ2=6.37 (P<0.05),二者具有相关性,详见表3。
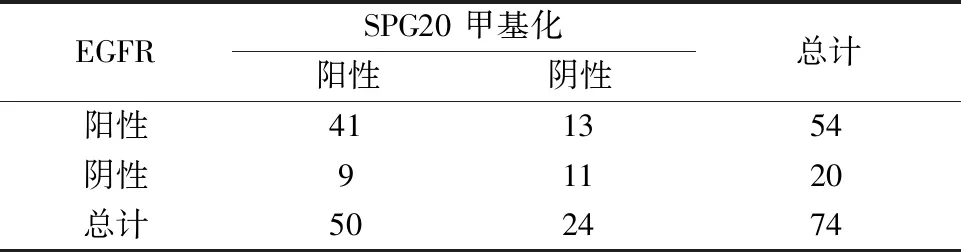
表3 在腺癌组织中SPG20甲基化与EGFR表达相关性(n)
5.肺腺癌组织SPG20甲基化、EGFR与临床病例特点的相关性:SPG20甲基化及EGFR均与肺腺癌TNM分期、组织分化程度及淋巴结转移密切相关(P<0.05);与患者性别、年龄和吸烟与否无相关性,差异无统计学意义(P>0.05),详见表4。

表4 SPG20甲基化和EGFR与临床病例特点的相关性
讨 论
肺腺癌是肺癌的常见病理类型,其发生率逐年递增,已成为肺癌最常见的病理类型,且发病年龄的年轻化趋势愈加明显[7,8]。现代医学研究发现肺癌的发生和发展是涉及多个基因、多个阶段、多个因素共同作用的结果[9]。目前肺腺癌的基因靶向治疗虽取得了一定的进展,但肺腺癌患者预后仍有待进一步提高。因此,提高肺腺癌早期诊断率、发现评估预后新指标和抗肿瘤治疗的新靶点至关重要[10,11]。
表观遗传学中甲基化修饰是恶性肿瘤发生机制之一,参与多种人体肿瘤的发生和发展[12]。研究证实,DNA甲基化修饰的紊乱状态会导致基因表达异常而导致细胞的恶性转化最终发生肿瘤[13]。DNA甲基化在肿瘤中作用主要表现在以下几个方面:(1)甲基化造成基因突变[14]。(2)甲基化够阻止基因转录,导致抑癌基因低表达甚至不表达,促进肿瘤的发生、发展和转移[15]。(3)癌基因甲基化水平降低而活化癌基因导致肿瘤的发生、发展和转移[16]。(4)基因组的低甲基化和部分癌基因启动子低甲基化而导致肿瘤恶性程度的增加。研究发现,基因的甲基化状态与肿瘤组织分型、分级和病理分期密切相关,是肿瘤早期诊断和患者预后的一个重要指标[17]。本研究结果显示,肿瘤相关因子SPG20在肺腺癌组织中发生了甲基化,且呈高甲基化状态。统计学分析结果显示,SPG20高甲基化状态与肺腺癌TNM分期、组织分化程度和淋巴结转移密切相关。研究结果提示,SPG20的甲基化可能参与了肺腺癌的发生,并促进了其进一步的发展。
SPG20基因编码Spartin多功能蛋白,参与人体多种疾病包括肿瘤的发生。研究表明,SPG20基因发生甲基化会造成基因表达抑制或缺失,进而导致Spartin蛋白减少或缺失。SPG20在细胞分裂周期的异常作用与肿瘤的发生具有相关性。更有研究表明,SPG20与EGFR的降解有关,影响该受体的胞吞及运输作用。SPG20启动子甲基化在卵巢癌中的作用已经被证实,并提出作为前列腺癌的全基因组甲基化分析目标[18]。在乳腺癌、前列腺癌及肝癌中通过外源性干预甲基干预某些关键癌基因DNA,实现了抑制这些癌基因的过表达,进而抑制该肿瘤的增殖、侵袭和转移[19~21]。本研究显示,在肺腺癌组织中SPG20的蛋白表达明显低于正常肺组织,笔者分析,SPG20在癌组织中的低表达可能是因为肺腺癌组织中SPG20的高甲基化状态抑制了SPG20的基因转录,使其在组织中表达下降,进而促进了肺腺癌的发生。
表皮生长因子受体EGFR是原癌基因c-erbB1的表达产物,在细胞的生长、增殖和分化等生理过程发挥重要的作用。EGFR突变造成其功能缺失或其相关信号通路中关键因子的活性异常会引起肿瘤的发生。研究表明,EGFR与人体内多种实体肿瘤的血管生成、侵袭及转移密切相关。本研究免疫组化检测肺腺癌中EGFR的结果显示,EGFR在癌组织中阳性表达明显高于癌旁组织,进一步通过蛋白免疫印迹方法定量检测EGFR表达量。EGFR在癌组织中高表达,与正常组织表达量存在明显差异,说明肺腺癌的发生与EGFR之间存在密切的相关性。
通过分析EGFR与肺腺癌患者临床病例特征的相关性结果显示,EGFR的表达水平与肺腺癌TNM分期、组织分化程度及淋巴结转移密切相关;SPG20甲基化和EGFR的相关性分析结果显示,癌组织中SPG20高甲基化组织中EGFR亦高表达,二者呈正相关。笔者分析,SPG20作为“抑癌因子”在肺腺癌组织内发生了甲基化,使其基因表达受到抑制,进而可能促进了作为“促癌因子”的EGFR在癌组织中的高表达,最终促进了肺腺癌的恶性程度增强,导致其容易通过淋巴结发生转移,降低了患者的生存率。
基于上述理论及研究结果,SPG20甲基化及EGFR与肺腺癌发生、发展、侵袭、转移及预后密切相关,但其具体作用机制尚不明确。今后研究中将以SPG20甲基化为切入点,结合EGFR研究为重点,对其促癌机制进行深入研究。对DNA异常甲基化的研究可以更加深入地了解到恶性肿瘤的发病机制,为今后早期诊治、预后判断等提供更为可靠的依据。

