连草泻痢胶囊通过Th17和Treg细胞的分化治疗溃疡性结肠炎的机制研究
战晶玉,袁星星,张雅丽,刘长发,王炳予
(黑龙江省中医药科学院南岗分院,黑龙江哈尔滨 150036)
溃疡性结肠炎(ulcerative colitis,UC)是一种因环境和遗传背景等多因素相互作用产生的慢性肠道炎症性疾病,常累及直肠和结肠黏膜及黏膜下层,具有反复发作的特点[1]。免疫因素是UC 的核心机制,而异常的免疫激活对UC 的发病中具有重要作用,因此抑制或是调节免疫系统的活性对于UC 的治疗具有重要的意义,并且为UC 的治疗带来新的方法[2]。
人体的免疫系统包括先天性免疫和适应性免疫,其中包括辅助性T 细胞(T helper,Th)及调节性T 细胞(regulatory T,Treg)在内的适应性免疫应答是机体免疫调节的核心,并且参与UC 的发生与发展。近年来研究发现,Th17 和Treg 通过分泌促炎性细胞因子从而提高肠道蛋白酶的活性,最终引起肠道炎症反应和黏膜损伤[3-5]。连草泻痢胶囊为我院张雅丽教授治疗溃疡性结肠炎的经验方,能够有效改善UC 患者炎性因子的失衡和肠道黏膜屏障功能的异常[6]。同时,动物实验表明连草泻痢胶囊具有抗炎、镇痛和抑制溃疡的作用[7]。本研究通过分析UC 小鼠模型脾脏和肠系膜淋巴组织中Th17 和Treg 细胞的比例,以期进一步明确连草泻痢胶囊抑制肠道炎症反应的机制。
1 材料与方法
1.1 实验动物
雄性无特定病原体级的BALB/c 小鼠(体质量18~22 g,7~8 周龄)购于北京Charles River 公司(实验动物生产许可证:SCXK(京)2016-0011)。动物饲养于黑龙江省中医药科学院动物实验中心,饲养环境:无特定病原体级实验动物屏蔽环境,相对恒温恒湿(温度:21~24 ℃,湿度:44%~55%),12 h的光暗循环,自由饮水及摄食。实验操作严格遵循《关于善待实验动物的指导性意见》中相关标准[8]。
1.2 药物与试剂
连草泻痢胶囊(组成:黄连、木香、炒薏苡仁、白芍、马齿苋、蒲公英和白花蛇舌草,0.5 g/粒,黑药制字:Z20180005)购于黑龙江省中医药科学院成药局;美沙拉嗪肠溶片(莎尔福,0.5 g/片,进口药品注册证号:H20171358)购于德国福克制药股份有限公司;葡聚糖硫酸钠(dextran sulfate sodium,DSS,分子量36 000~50 000 Da)购于法国MP Biomedicals公司;无毒环保苏木素-伊红(hematoxylin eosin,HE)染液购于南京建成生物工程研究所(货号:D006-1-3)。 小鼠转化生长因子β(transforming growth factor-β,TGF-β)购于江苏酶免实业有限公司(货号:MM-45041M2)。小鼠白介素6(interleukin 6,IL-6)、IL-17A 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测试剂盒及辣根过氧化物酶标记山羊抗兔IgG 二抗购于上海碧云天生物技术有限公司(货号分别为:PT878、PI326、PI545 和A0201);红细胞裂解液购于北京索莱宝科技有限公司(货号:R1010);RPMI-1640 培养基和胎牛血清(fetal bovine serum,FBS)购于美国Gibco 公司(货号:11875101 和26140079);抗CD4抗体、抗CD25 抗体、维甲酸相关孤儿受体γt(ROR-γt)、抗叉头状转录因子p3(Foxp3)抗体和β-actin 抗体购于英国Abcam 公司(货号分别为:ab207755、ab283576、ab58670、ab36607 和ab8227);抗IL-17A 抗体购于美国Cell signaling Technology公司(货号:13838);BD Perm/Wash 破膜剂购于美国BD Biosciences 公司(货号:554723)。
1.3 动物分组与造模
40 只BALB/c 小鼠适应性饲养1 周后按照体质量随机分为空白组、模型组、美沙拉嗪组和连草泻痢胶囊组,每组各10 只。造模前,将DSS 溶于适量的蒸馏水中配置成3%的DSS 溶液。同时,分别取适量粉碎后的美沙拉嗪肠溶片及连草泻痢胶囊溶于适量的蒸馏水中配置成终浓度为15.6 g/L 和16.1 g/L 的混悬药液。除空白组外,其余30 只BALB/c 小鼠按照文献[9]中的方法复制UC 模型,具体方法如下:模型组、美沙拉嗪组和连草泻痢胶囊组小鼠予以3%DSS 溶液自由饮用,期间美沙拉嗪组和连草泻痢胶囊组小鼠分别给予0.68 g/kg 美沙拉嗪混悬液和0.77 g/kg 连草泻痢胶囊水溶液灌胃,每次1 mL,每日1 次,灌胃剂量参照人和动物药物等效剂量进行换算。空白组小鼠则给予蒸馏水自由饮用,期间与模型组小鼠则给予等体积的蒸馏水灌胃,连续7 d。造模期间每日监测小鼠食物和水的摄入量、体重、大便稠度和大便潜血。并参照文献[10]中方法评估小鼠结肠炎疾病活动指数(disease activity index,DAI)。
各组小鼠于末次给药后禁食24 h,以1%戊巴比妥钠40 mg/kg 腹腔注射进行麻醉,从回盲部到分离直肠远端分解结肠,用磷酸盐缓冲盐溶液轻轻冲洗以除去粪便,同时测量切除的结肠的重量和长度。随后取1 cm 中段结肠组织置于4%多聚甲醛中的固定,余下组织置于-80 ℃保存。同时,收集各组小鼠脾脏和肠系膜淋巴结,用于指标检测。
1.4 指标检测
1.4.1 结肠组织病理学 取置于4%多聚甲醛中固定的结肠组织,梯度酒精脱水后置于二甲苯中进行透明处理,石蜡包埋后以切片,切片厚度设定为5 μm。参照HE 染色试剂盒说明书进行染色,光学显微镜下观察结肠组织病理形态的改变。参照文献[11]中标准进行组织病理学评分,即根据结肠病变(溃疡深度、溃疡程度、炎症的存在和纤维化的位置)的严重程度,每个参数从0 分到4 分:无变化得分为0;最小变化为1 分;轻度变化2 分;中度变化为3 分;严重变化评分为4 分,最低分为0 分,表明没有炎症;得分越高,结肠组织炎症越严重。
1.4.2 ELISA 法检测 取适量结肠组织并加入预冷的磷酸盐缓冲盐溶液中冲洗,玻璃匀浆器于冰浴中充分匀浆。于4 ℃环境下3 500 r/min 离心10 min,取上清。参照ELISA 试剂盒说明书测定组织TGF-β、IL-6 和IL-17A 的含量。
1.4.3 流式细胞术 取小鼠脾脏和肠系膜淋巴结组织剪碎、研磨后制备单细胞悬液,不锈钢滤网过滤后使用红细胞裂解液裂解红细胞。1 500 r/min离心10 min,将所得细胞悬液在RPMI-1640 中洗涤两次,并保存在含5%FBS 的冰上培养基中。随后对细胞悬液进行计数并调整细胞密度为1×106个/mL。对于Th17 细胞检测:从脾脏和肠系膜淋巴结中分离的单个核细胞后用离子霉素和佛波肉豆蔻酸酯在5%CO2中处理1 h。随后加入GolgiPlug 蛋白转运抑制剂并置于5%CO2中继续孵育6 h。细胞用抗CD4 抗体于室温下孵育15 min,固定、破膜、洗涤,加入抗IL-17A 抗体于室温下继续孵育30 min。对于Treg 细胞的检测:分别于细胞中加入抗CD4抗体和抗CD25 抗体孵育30 min,固定、破膜、洗涤,加入抗Foxp3 抗体进行染色,室温下继续孵育30 min。细胞洗涤后重悬,上机检测。
1.4.4 Western blot 检测 取结肠组织剪碎后置于RIPA 裂解液冰上裂解,以BCA 法测定总蛋白浓度;加入15 μL 蛋白样品进行电泳,转膜至PVDF膜,5% 脱脂牛奶封闭2 h;分别加入稀释后的ROR-γt、Foxp3 及β-actin 兔单抗(1∶1 000),4 ℃孵育过夜;TBST 缓冲液洗膜5 次,加入适量稀释后的山羊抗兔二抗后室温下继续孵育1 h,TBST 缓冲液洗膜5 次。滴加ECL 显影液,凝胶成像系统分析,β-actin 作为内参,以目的蛋白与β-actin 的比值作为目的蛋白的相对表达量。
1.5 统计学处理
通过SPSS 23.0 统计软件对数据进行分析,数据采用均数±标准差(±s)表示,多组间数据的比较以单因素方差(ANOVA)进行分析,组间两两的比较采用LSD 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 连草泻痢胶囊对UC 小鼠体重、DAI 评分和结肠长度的影响
实验过程中模型组小鼠死亡1 例,其余3 组未出现死亡病例。与空白组相比,模型组小鼠体重和结肠长度明显降低,DAI 评分明显升高,差异均具有统计学意义(P<0.01)。与模型组相比,实验结束后美沙拉嗪组和连草泻痢胶囊组小鼠体重和结肠长度明显增加,DAI 评分明显降低,差异均具有统计学意义(P<0.01)。见表1。
表1 各组小鼠体重、DAI 评分和结肠长度的比较(±s)Tab 1 Comparison of body weight,DAI score and colon length of mice in each group(±s)

表1 各组小鼠体重、DAI 评分和结肠长度的比较(±s)Tab 1 Comparison of body weight,DAI score and colon length of mice in each group(±s)
注:与空白组比较,△P<0.01;与模型组比较,#P<0.01。
组别空白组模型组美沙拉嗪组连草泻痢胶囊组结肠长度(cm)9.68±1.12 7.43±0.83△9.07±1.38#8.93±1.12#6.570 0.001 n 10 9 10 10 FP体重(g)23.86±1.00 16.10±1.45△18.86±1.17#19.00±0.98#75.199 0.000 DAI 评分(分)0.20±0.42 7.22±1.09△3.30±1.34#2.70±0.95#78.562 0.000
2.2 连草泻痢胶囊对UC 小鼠结肠组织病理形态的影响
HE 染色结果显示,空白组小鼠结肠组织结构正常,而模型组小鼠结肠组织中可见明显溃疡、糜烂,黏膜下层可见大量的炎性细胞存在及肉芽组织形成,其中组织病理学评分与空白组相比明显增加,差异具有统计学意义(P<0.01)。美沙拉嗪及连草泻痢胶囊均能够改善结肠组织结构及炎性细胞的浸润,尤其是组织水肿和黏膜溃疡、糜烂明显得到改善。两组组织病理学评分与模型组比较均降低,差异具有统计学意义(P<0.01)。 见图1和表2。

图1 各组UC 小鼠结肠组织病理形态的比较(HE 染色,×200)Fig 1 Comparison of pathological morphology of colon tissue of UC mice in each group(HE staining,× 200)
表2 各组结肠组织炎症评分的比较(分,±s)Tab 2 Comparison of inflammation scores in the colon tissue of each group(score,±s)

表2 各组结肠组织炎症评分的比较(分,±s)Tab 2 Comparison of inflammation scores in the colon tissue of each group(score,±s)
注:与空白组比较,△P<0.01;与模型组比较,#P<0.01。
炎症评分0.30±0.48 12.67±0.87△4.40±1.35#4.40±0.70#304.599 0.000组别空白组模型组美沙拉嗪组连草泻痢胶囊组n 10 9 10 10 FP
2.3 连草泻痢胶囊对UC 小鼠结肠组织中TGF-β、IL-6 和IL-17A 含量的影响
与空白组相比,模型组结肠组织中TGF-β 的含量显著降低,IL-6 和IL-17A 的含量明显增加,差异均具有统计学意义(P<0.01)。与模型组相比,实验结束后美沙拉嗪组和连草泻痢胶囊组小鼠结肠组织中TGF-β 明显增加,IL-6 和IL-17A 的含量明显降低,差异均具有统计学意义(P<0.01)。见表3。
表3 各组结肠组织中TGF-β、IL-6 和IL-17A 含量的比较(pg/mL,±s)Tab 3 Effect of Liancao Xieli capsule on TGF- β,IL-6 and IL-17A in the colon tissue of UC mice(pg/mL,±s)
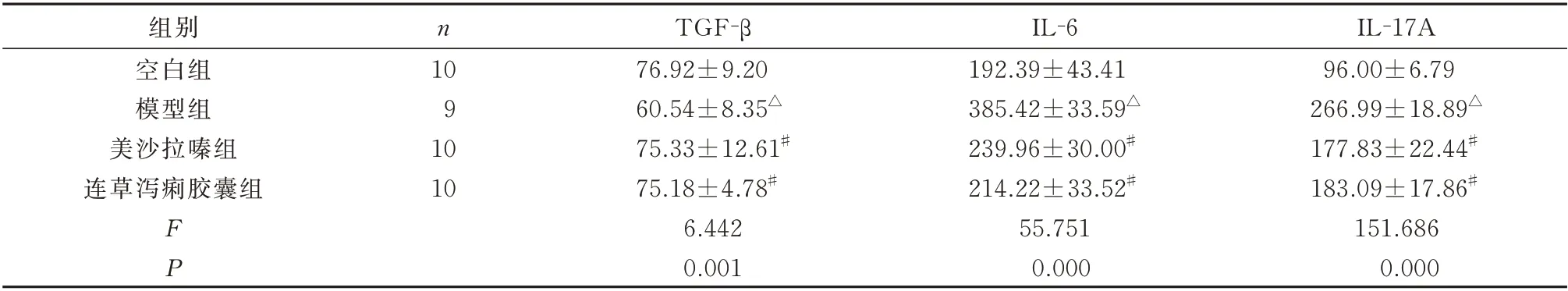
表3 各组结肠组织中TGF-β、IL-6 和IL-17A 含量的比较(pg/mL,±s)Tab 3 Effect of Liancao Xieli capsule on TGF- β,IL-6 and IL-17A in the colon tissue of UC mice(pg/mL,±s)
注:与空白组比较,△P<0.01;与模型组比较,#P<0.01。
IL-17A 96.00±6.79 266.99±18.89△177.83±22.44#183.09±17.86#151.686 0.000组别空白组模型组美沙拉嗪组连草泻痢胶囊组n 10 9 10 10 FP TGF-β 76.92±9.20 60.54±8.35△75.33±12.61#75.18±4.78#6.442 0.001 IL-6 192.39±43.41 385.42±33.59△239.96±30.00#214.22±33.52#55.751 0.000
2.4 连草泻痢胶囊对UC 小鼠Th17 和Treg 细胞比例的影响
与空白组相比,模型组小鼠脾脏及肠系膜淋巴结中Th17、Treg 细胞的比例和Th17/Treg 的比值明显增加,差异均具有统计学意义(P<0.01)。与模型组相比,实验结束后美沙拉嗪组和连草泻痢胶囊组小鼠脾脏及肠系膜淋巴结中Th17 细胞的比例和Th17/Treg 的比值明显降低,而Treg 细胞的比例明显增加,差异均具有统计学意义(P<0.01)。见表4、5。
表4 各组脾脏中Th17 和Treg 细胞比例的比较(±s)Tab 4 Comparison of the proportion of Th17 and Treg cellsin the spleen of mice in each group(±s)

表4 各组脾脏中Th17 和Treg 细胞比例的比较(±s)Tab 4 Comparison of the proportion of Th17 and Treg cellsin the spleen of mice in each group(±s)
注:与空白组比较,△P<0.01;与模型组比较,#P<0.01。
组别空白组模型组美沙拉嗪组连草泻痢胶囊组Th17/Treg 0.21±0.02 0.38±0.06△0.20±0.03#0.17±0.04#52.109 0.000 n 10 9 10 10 FP Th17(%)1.41±0.15 3.30±0.40△1.93±0.40#1.77±0.42#49.818 0.000 Treg(%)6.78±0.52 8.66±0.47△9.43±0.78#10.56±1.14#41.298 0.000
表5 各组肠系膜淋巴结中Th17 和Treg 细胞比例的比较(±s)Tab 5 Comparison of the proportion of Th17 and Treg cells in mesenteric lymph nodes of mice in each group(±s)

表5 各组肠系膜淋巴结中Th17 和Treg 细胞比例的比较(±s)Tab 5 Comparison of the proportion of Th17 and Treg cells in mesenteric lymph nodes of mice in each group(±s)
注:与空白组比较,与空白组比较,△P<0.01;与模型组比较,#P<0.01。
Th17/Treg 0.54±0.06 0.78±0.11△0.45±0.05#0.39±0.04#58.687 0.000组别空白组模型组美沙拉嗪组连草泻痢胶囊组n 10 9 10 10 FP Th17(%)2.03±0.19 4.64±0.57△3.38±0.32#3.15±0.19#91.979 0.000 Treg(%)3.81±0.42 5.93±0.19△7.47±0.60#8.05±0.46#218.033 0.000
2.4 连草泻痢胶囊对UC 小鼠结肠组织中STAT3/ROR-γt和STAT5/Foxp3 信号通路的影响
Western blot 结果显示,与空白组相比,模型组小鼠结肠组织中p-STAT3、ROR-γt、p-STAT5 和Foxp3 蛋白的表达水平明显增加,差异均具有统计学意义(P<0.01),而结肠组织中STAT3 和STAT5 蛋白的表达水平未见明显改变,差异均无统计学意义(P>0.01)。与模型组相比,实验结束后美沙拉嗪组和连草泻痢胶囊组小鼠结肠组织中p-STAT3 和ROR-γt 蛋白的表达水平明显降低,p-STAT5 和Foxp3 蛋白的表达水平明显增加,差异均具有统计学意义(P<0.01),而结肠组织中STAT3 和STAT5 蛋白的表达水平未见明显改变,差异均无统计学意义(P>0.05)。见表6 和图2。
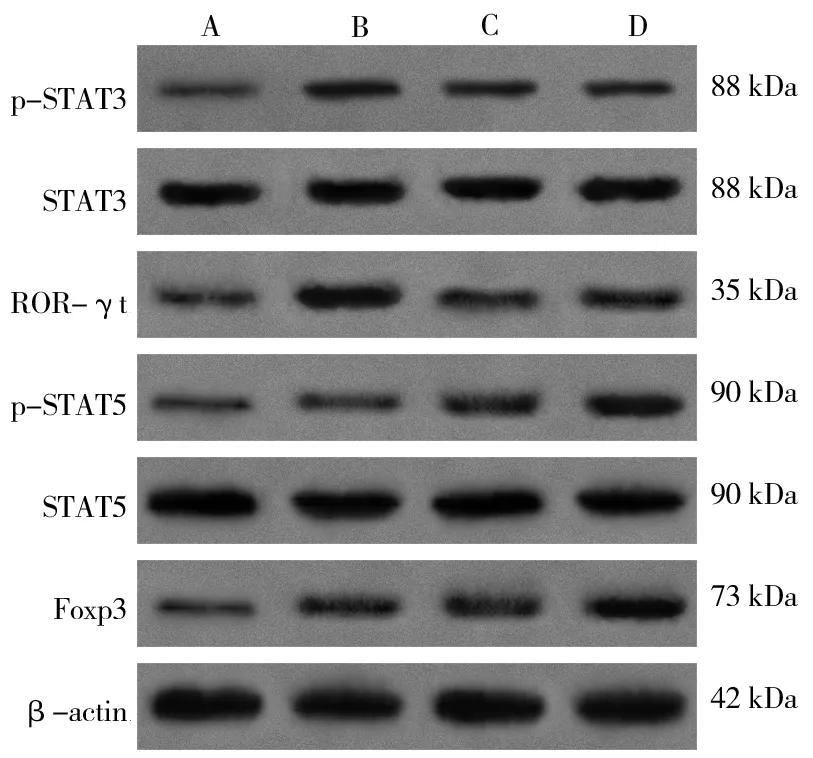
图2 各组结肠组织中STAT3/ROR-γt 和STAT5/Foxp3通路蛋白表达的比较Fig 2 Comparison of STAT3/ROR-γt and STAT5/Foxp3 pathway protein expression in the colon tissues of each group
表6 各组结肠组织中STAT3/ROR-γt 和STAT5/Foxp3 通路的比较(±s)Tab 6 Comparison of STAT3/ROR-γt and STAT5/Foxp3 pathways in the colonic tissues of each group(±s)

表6 各组结肠组织中STAT3/ROR-γt 和STAT5/Foxp3 通路的比较(±s)Tab 6 Comparison of STAT3/ROR-γt and STAT5/Foxp3 pathways in the colonic tissues of each group(±s)
注:与空白组比较,△P<0.01;与模型组比较,#P<0.01。
Foxp3/β-actin 0.20±0.08 0.42±0.13△0.55±0.10#0.60±0.06#35.116 0.000组别空白组模型组美沙拉嗪组连草泻痢胶囊组n 10 9 10 10 FP p-STAT3/STAT3 0.26±0.07 0.46±0.13△0.32±0.11#0.32±0.10#6.345 0.001 ROR-γt/β-actin 0.28±0.04 0.65±0.13△0.44±0.12#0.44±0.26#8.586 0.000 p-STAT5/ STAT5 0.16±0.03 0.30±0.15△0.47±0.12#0.60±0.13#27.720 0.000
3 讨论
溃疡性结肠炎具有复杂的病理机制,目前尚未完全阐明。尽管如此,肠道炎症反应介导的黏膜损伤在UC 发病中发挥着重要的作用。肠道黏膜屏障的受损可以引起肠道黏膜通透性的增加,从而引起肠道内的抗原、细菌等有害物质进入固有层导致免疫细胞的激活,诱导肠道异常的炎症反应[12]。TGF-β 分布于机体的多种细胞内,是一种维持肠道免疫功能的抑炎因子,对于维持肠道的稳态具有重要的作用[13]。IL-6 是一种由单核细胞产生的促炎因子,在调节炎症和免疫反应等过程中发挥着重要的作用。一方面,IL-6 可以影响肠道上皮细胞的分泌,进而导致黏膜通透性的增加和中性粒细胞的黏附和聚集,诱发或加重UC[14]。此外,IL-6 还可以与受体结合形成IL-6/sIL-6R 复合物,通过膜糖蛋白gp130-JAK 途径,促使STAT3 的磷酸化及核转位,导致肠道炎症的发生及持续[15]。IL-17A 是由Th17分泌的一种促炎因子,属于IL-17 家族的一员。IL-17A 可以诱导多种促炎因子和趋化因子从而介导炎症反应,进而参与肠道免疫失衡[16]。研究证实,UC 患者血清和结肠组织中IL-17A 的表达水平显著升高,并且与UC 患者脾虚湿热证型的程度呈现显著正相关[17,18]。同时,动物实验显示腹腔注射IL-17A 抗体能够显著减轻DSS 诱导的肠道炎症程度[19]。本研究结果显示,连草泻痢胶囊治疗后结肠组织结构及炎性细胞的浸润情况明显改善,并且连草泻痢胶囊能够显著增加小鼠结肠组织中TGF-β的表达及降低IL-6 和IL-17A 的水平。
T 淋巴细胞亚群Th17/Treg 失衡是导致UC 的重要原因[20]。ROR-γt 和Foxp3 分别为调控初始T细胞向Th17/Treg 分化的转录因子,其中ROR-γt在Th17 分化过程中持续表达,进入细胞核的p-STAT3 通过激活ROR-γt 促使CD4+T 淋巴细胞向Th17 分化,分泌IL-17A。此外,构建ROR-γt 缺陷小鼠模型可以显著抑制炎性细胞的浸润和组织募集,从而缓解炎症反应[21]。在本研究中发现连草泻痢胶囊能够明显抑制p-STAT3 和ROR-γt 的表达水平,从而下调脾脏和肠系膜淋巴结中Th17 细胞的比例。该结果表明抑制IL-6/STAT3/ROR-γt信号通路的活化是连草泻痢胶囊改善肠道炎症的重要途径之一。低浓度的TGF-β 可以诱导初始T细胞向Th17 的分化,而高浓度的TGF-β 可以诱导初始T 细胞向Treg 的分化[22]。CD4+CD25+Treg 细胞是Treg 细胞的一个亚群,通过分泌IL-10 和TGF-β 等维持机体的免疫耐受。有研究显示Foxp3的表达水平在活动期UC 患者肠道组织中明显高于稳定期UC 患者,这表明Treg 在炎症反应发生是通过转移至炎症部位从而发挥抑制免疫应答的作用[23]。STAT5 是激活初始T 细胞表达Foxp3 并发育成为Treg 的重要信号通路,STAT5 通过与Foxp3 基因上的结合位点结合从而发挥Foxp3 表达调控的作用[24]。本研究结果显示,模型组小鼠脾脏和肠系膜淋巴结组织中Treg 细胞的比例增加,而连草泻痢胶囊能治疗后Treg 细胞的比例明显增加。同时,连草泻痢胶囊能够显著上调接触组织中p-STAT5 和Foxp3 的表达水平。表明连草泻痢胶囊主要通过激活STAT5/ Foxp3 信号通路,从而上调Treg 细胞的比例发挥抑制肠道炎症反应的作用。
连草泻痢胶囊为本院独立研制的中药复方制剂(专利号CN103705796B),由黄连、木香、炒薏苡仁、白芍、马齿苋、蒲公英和白花蛇舌草组成。方中黄连和木香作为君药,其中黄连苦寒,清热燥湿,泻火解毒;木香辛、苦,温,以制黄连苦寒之性,具有行气止痛,健脾消食的功效。课题组前期研究结果显示,黄连-木香药对可以通过抑制PI3K/Akt/mTOR介导的细胞自噬,改善由DSS 诱导的肠道炎症和黏膜屏障损伤[25]。臣以炒薏苡仁归脾、胃、肺经,健脾渗湿,除痹止泻,清热排脓;白芍苦、酸,微寒,平肝止痛,养血调经,敛阴止汗;马齿苋清热利湿;凉血解毒的功效。以上三药合用具有健脾柔肝、利湿排脓。现代研究表明白芍的主要活性成分白芍总苷具有抗炎、止痛和调节免疫的作用,能够通过调节Treg/Th17 免疫平衡和细胞因子的分泌从而改善UC 小鼠肠道黏膜的损伤[26]。马齿苋专治泻痢,一项网络药理学研究分析证实马齿苋主要通过调节mTOR 信号通路发挥治疗UC 的作用[27]。此外,马齿苋多糖还可以通过改善UC 小鼠肠道菌群的稳态,进而抑制IL-6/STAT3 信号通路的活化,改善肠道炎症[28-30]。蒲公英和白花蛇舌草清热解毒,消肿散结,活血止痛,在此作为佐药。全方共凑清热解毒、渗湿排脓、活血止痛的功效。现代研究表明,蒲公英和白花蛇舌草的活性成分对DSS 诱导的UC小鼠模型均表现出较好的治疗作用[31,32]。
综上所述,本研究结果表明连草泻痢胶囊主要通过抑制STAT3/ROR-γT 和促进STAT5/Foxp3信号通路的活化,从而调控Treg/Th17 免疫平衡,达到改善UC 肠道炎症的作用。
作者贡献说明:
战晶玉:实验设计,指标检测,撰写论文;袁星星、王炳予:实验造模、药物干预;刘长发:指标检测;张雅丽:实验数据审核及统计分析,审阅。

