醒脑静注射液对大鼠脑缺血急性期半暗带转化的影响
孙逸坤,吴丽君,李媛媛,刘浩琦,安 娜,宋 珂,张 华,高永红
(1. 北京中医药大学东直门医院,中医内科学教育部和北京市重点实验室,北京 100700;2. 北京中医药大学中医脑病研究院,北京 100029;3.河南省开封市尉氏县中医院,河南开封 475500)
缺血性中风是由于流向大脑的脑血流减少或阻塞而引起脑组织急性损伤的一种脑血管疾病,约占所有中风疾病的87%,具有高发病率、高死亡率、高致残率等特点,是目前世界范围内的主要公共卫生问题之一[1,2]。目前临床上治疗缺血性中风的唯一安全有效的疗法是溶栓治疗,但是由于严格的时间窗限制和溶栓后出血性转化的风险,只有不到4%的中风患者可从中受益,临床应用受到很大的限制[3]。
局灶性脑缺血发生后,受损伤的脑组织由缺血核心区和缺血半暗带区两部分组成。缺血核心区由于坏死细胞死亡而遭受不可逆的神经元损伤,而缺血半暗带区旁系小血管的残血流量可减缓细胞的死亡速度,尚存在可挽救和代谢活跃的细胞[2,4,5]。因此挽救半暗带区可逆性损伤神经元是脑缺血急性期治疗的关键。
醒脑静注射液是以古方安宫牛黄丸为基础研发,由麝香、冰片、栀子、郁金等中药组成的水溶性注射液[6]。醒脑静注射液对缺血性中风急性期患者有明确的临床疗效,可透过血脑屏障改善局部脑缺血现象,干预半暗带区发生的病理生化级联反应,起到缺血后神经保护作用[7]。本实验通过研究醒脑静注射液对大鼠脑缺血急性期半暗带转化的影响,为醒脑静注射液治疗缺血性中风提供新的理论依据。
1 材料与方法
1.1 动物
SFP 级健康雄性SD 大鼠,体重(270±10)g,购自北京维通利华实验动物技术有限公司,许可证编号:SYXK(京)2012-0024。在适宜的温度和湿度条件下,大鼠采取分笼饲养方式,自由进食和饮水。实验方案已通过北京中医药大学东直门医院实验动物福利与伦理委员会审核(伦理编号:15-05)。
1.2 药物及试剂
醒脑静注射液(10 mL/支,由麝香、冰片、栀子、郁金四种成分组成),无锡济民可信山禾药业股份有限公司,货号151107;TUNEL 染色试剂盒(Roche);DAB 显色液(北京中杉金桥生物科技有限公司);焦油紫(Sigma,C5042)。
1.3 仪器
7.0T Micro-MRI 成像系统(德国Bruker 公司);透射电镜(日本Hitachi 公司,H7650);自动脱水、包埋机、烤片机(Leica 公司);光学显微镜(日本Olympus BX60 型)。
1.4 造模、分组及给药
采用线栓法制备大鼠大脑中动脉闭塞模型:在恒定湿度及22 ℃的室温条件下,大鼠术前禁食不禁水12 h,3.5%水合氯醛腹腔注射进行麻醉,采用线栓法制备大鼠大脑中动脉闭塞模型[8]。假手术组只进行血管分离术,不进行线栓插入过程。术后将所有大鼠置于温暖环境下,密切观察生命体征变化,且苏醒后不限制其活动及饮食。参照mNSS 评分标准[9]于大鼠清醒后进行神经功能评分,选取造模成功(7~12 分)的大鼠随机分为模型组和醒脑静组。各组大鼠均于术后2 h 进行腹腔注射给药,2次/d。其中醒脑静组按0.18 mL/100 g 注射醒脑静注射液,假手术组和模型组则给予同等剂量的生理盐水。
1.5 灌流及取材方法
术后24 h,各组大鼠经深度麻醉后仰卧位固定于解剖板上,迅速开胸,分离心包膜,暴露并游离出心脏,经心尖部从左心室插入灌流针至主动脉弓,固定并夹闭腹主动脉,剪开右心耳,依次灌注生理盐水和4%多聚甲醛,灌注成功后迅速断头取脑浸泡于4%多聚甲醛溶液中。24 h 后经常规脱水透明和石蜡包埋后连续冠状切片,切片厚度4 μm,烘烤备用。
1.6 尼氏染色观察大鼠半暗带区神经元形态变化
石蜡切片常规脱蜡水化后,依次放入二甲苯溶液和梯度乙醇中脱蜡至水;然后将切片浸入尼氏染色液(0.5% 焦油紫)37 ℃恒温孵育10~20 min。蒸馏水快洗,0.25%冰醋酸酒精溶液分色,脱水、透明后,用树脂胶进行封片。每组3 只,每只大鼠选取一张切片,在光学显微镜下观察半暗带区域神经元形态组织变化并拍照。
1.7 原位细胞凋亡检测(TUNEL 染色)
石蜡切片常规脱蜡水化后,按照TUNEL 染色试剂盒说明书进行操作,DAB 显色,磷酸盐缓冲液(PBS)漂洗,苏木精复染,温水反蓝。脱水、透明、中性树胶封片。每只大鼠选取一张切片,每组3 只,低倍镜下定位缺血半暗带区,高倍镜下每张切片选取5 个不重叠视野,采用Image J 进行阳性细胞计数并取其均值。
1.8 电镜观察半暗带区超微结构
造模成功后24 h,每组取3 只大鼠,用4%多聚甲醛和2%戊二醛PBS 溶液灌注成功后取出脑组织,于缺血侧半暗带区切取体积大小为1 mm3的脑组织块,迅速放入4%戊二醛溶液中于4 ℃冰箱中固定2 h。PBS 清洗3 次后置于1%锇酸溶液中固定2~3 h,PBS 再次清洗后进行脱水、包埋,并在-80 ℃下聚合24 h。超薄切片机切取50~60 nm 厚度的超薄切片,经醋酸铀-柠檬酸铅双重染色后,在透射电镜下观察半暗带区神经血管单元(Neurovascular unit,NVU)的改变。
1.9 磁共振检测
大鼠造模成功后随机分为模型组(n=5)和醒脑静组(n=6),于相应时间点(4.5、24 h)用7.0T Micro-MRI 成像系统进行扫描,包括T1 加权像(T1 Weighted Image,T1WI)、T2 加权像(T2 Weighted Image,T2WI)、弥散加权成像(Diffusion Weighted Imaging,DWI)及灌注成像(perfusion-weighted imaging,PWI)。扫描参数设置如下:T1WI∶SE 序列,TR/TE=350 ms/11 ms,层厚1 mm,间隔0.3 mm,矩阵192×122;T2WI :FSE 序列,TR/TE=3 140 ms/37 ms,层厚1 mm,间隔0.3 mm,矩阵320×240;扩散加权成像(Diffusion weighted imaging,DWI):TR/TE=4 500 ms/35 m,层厚1 mm,间隔0.3 mm,矩阵128×108;灌注加权成像(Perfusion weighted imaging,PWI):EPI 序列,TR/TE=1 500 ms/19 ms,层厚0.9 mm,间隔0 mm,矩阵128×128。
1.10 数据分析
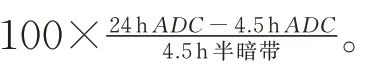
1.11 统计学处理
2 结果
2.1 尼氏染色
图1A(即假手术组)神经元排列致密整齐,细胞数量饱满,形态、结构正常,胞质内尼氏小体清晰可见且分布均匀。图1B(即模型组)神经元数量明显减少,着色浅,胞体固缩凋亡,形态、结构严重改变,细胞胞浆中尼氏小体轮廓模糊或消失。图1C(即醒脑静组)神经元恢复较好,细胞形态、结构基本恢复正常,凋亡神经元数量明显较少,细胞内尼氏小体分布正常且形态规则。
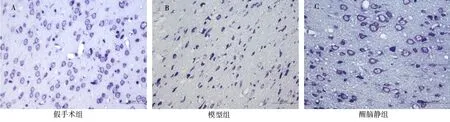
图1 MCAO 大鼠术后24 h 半暗带区神经元形态变化(尼氏染色,×400)Fig 1 Morphological changes of neurons in penumbra of MCAO rats 24 h after operation(Nissl staining,×400)
2.2 电镜下观察半暗带区NVU 超微结构变化
图2A(即假手术组)神经元形态正常,胶质细胞形态、结构正常且染色质分布均匀;微血管无改变,管径正常、管壁光滑,内皮细胞形态、结构未见变化。图2B(即模型组)神经元细胞明显固缩,胞核弥散且染色不均一,核仁边聚;微血管出现不规则变形,管腔狭窄,血管周围可见不同程度性溶解伴水肿;图2C(即醒脑静组)神经元水肿减轻,胞核形态相对正常;微血管未见明显变形,内皮细胞形态、结构尚可,水肿较模型组减轻。
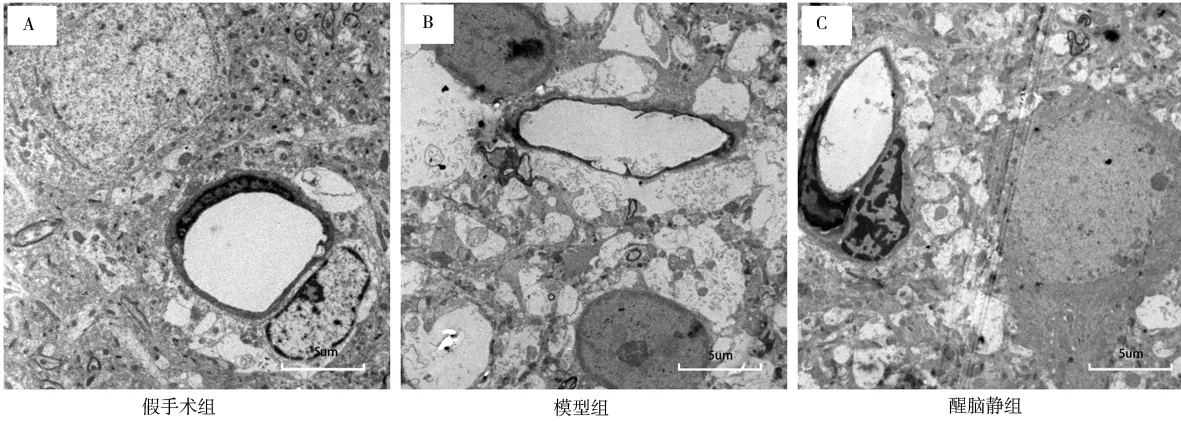
图2 MCAO 大鼠术后24 h 神经血管单元比较(透射电镜,×7 000)Fig 2 Comparison of neurovascular units in MCAO rats 24 h after operation(TEM,×7 000)
2.3 TUNEL 染色
TUNEL 染色观察大鼠缺血半暗带区细胞凋亡情况并统计阳性细胞数,其中凋亡细胞呈棕色,细胞核深染。图3A(即假手术组)可见少量TUNEL阳性细胞数,为正常生理表达。与假手术组(1.73±0.61)相比,模型组(20.13±0.46)TUNEL 阳性细胞数显著增多(P<0.01),见图3B;与模型组相比,醒脑静组(14.27±0.81)TUNEL 阳性细胞数明显减少(P<0.01)。见图3C。

图3 MCAO 大鼠术后24 h 细胞凋亡的病理学表现(TUNEL 染色,×400)Fig 3 Pathological changes of apoptosis in MCAO rats 24 h after operation(TUNEL staining,×400)
2.4 磁共振观察半暗带转化结果
磁共振结果显示,ADC 反映脑梗死面积,CBF反映脑血流情况,其中红色表示血流通畅,蓝黑色表示血流较少或中断。图4 结果显示,醒脑静组24 h 脑梗死面积小于模型组,且脑血流状态亦明显优于模型组。半暗带丢失率计算结果显示,与模型组相比[(111.24±73.46)%],醒脑静组[(62.66±30.43)%]的半暗带丢失率明显降低(Z=-2.008,P=0.045)。
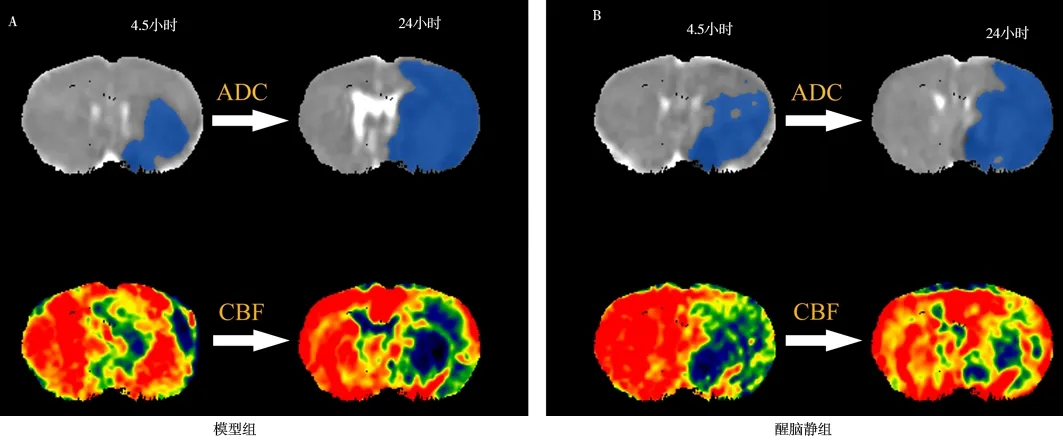
图4 MCAO 大鼠MRI 示缺血演变过程图Fig 4 Ischemic evolution map of MRI in MCAO rats
3 讨论
脑缺血是一个从超急性期到急性期、亚急性期和慢性期的动态过程,最大限度地降低发病到治疗的时间是目前研究的重点[13]。急性脑梗死分为缺血核心区和半暗带区,其中缺血核心区由于葡萄糖和氧气的缺乏导致神经元细胞因坏死而死亡,而核心区域周围尚存在可挽救的、代谢活跃的神经元细胞,被称为缺血半暗带区[14]。
缺血半暗带一词最早由Astrup 等提出,其是指电活动终止但局部CBF 仍高于细胞离子梯度所需的阈值(10~18 mL/100 g/min),故能保持正常的细胞结构和离子平衡,为可逆性损伤[15-17]。随后Sharp等[18]将半暗带定义扩展,提出“多分子半暗带”的概念,即在正常脑组织和梗死中心区之间,不同时间内多种基因在选择性神经元死亡区、蛋白质变性区、低氧区和扩散性抑制区的表达不同。半暗带是一个时间依赖的概念,在缺血的早期阶段,如果无法及时恢复血流,随着时间的推移,半暗带区神经元细胞将会发生不可逆的损害,半暗带范围亦随之缩小。这种情况是由一系列复杂的生理和病理引起的,主要包括保护性三磷酸腺苷合成的减少;兴奋性神经递质释放的增加;一氧化氮和白介素-1 水平的升高以及水平升高的转化生长因子β、肿瘤坏死因子α、血管内皮生长因子、脑源性神经营养因子和缺氧诱导因子等[19]。缺血半暗带理论是急性脑梗死临床治疗的基础,所谓“时间就是大脑”中的大脑指的就是缺血半暗带[20],此处的神经元细胞短时间内仅表现为生物电活动等暂时停止,但细胞的结构和功能仍保存完整,如及时恢复血流或进行脑保护则可挽救区域内大量尚可存活的神经元,使其恢复正常或者部分恢复正常,抑制或减缓缺血性脑梗死的进一步发生发展[21,22]。
醒脑静注射液是临床常用的中成药急救药品,具有清热泻火,凉血解毒,醒脑开窍的功效,可用于治疗多种脑血管神经系统疾病[23]。现代药理学研究表明,醒脑静注射液可通过血脑屏障直接作用于中枢神经系统,发挥抗炎,抗氧化,抑制细胞凋亡,改善脑微循环,减轻脑水肿等效应[24,25]。同时还可有效地保护缺血半暗带,减少溶栓后毒性反应的发生[26]。但是溶栓疗法尚未得到广泛普及[27],因此观察醒脑静注射液是否能直接作用于缺血半暗带区,促进半暗带转化并缓解脑缺血损伤为本研究的重点。NVU 作为一种新型卒中治疗策略于2001 年被提出,其主要由神经元、胶质细胞(包括星形胶质细胞、小胶质细胞和少突神经胶质)和微血管等结构组成,共同维持着神经元的正常生理过程以及受损神经元的修复[28,29]。脑梗死发生后,NVU 中的神经元、胶质细胞和微血管等会受到不同程度损伤,各组分之间的相对平衡会被打破,引起一系列级联损伤反应[30,31]。本研究结果观察显示,醒脑静注射液可促进脑缺血急性期半暗带区NVU 神经元、胶质细胞和微血管的修复,减轻其各组分的病理形态改变。凋亡在急性缺血性中风的发病机理中发挥着重要作用。在缺血性中风的早期,缺血中心的脑血流量急剧下降,发生坏死性神经细胞死亡[32]。但缺血半暗带周围的神经细胞仍具有代谢活性,死亡主要以凋亡为主,其形态学特征是核固缩,细胞膜泡沫形成和凋亡小体的形成[33]。本研究结果亦显示,醒脑静注射液可部分恢复缺血半暗带区损伤的神经元,抑制细胞凋亡。
影像学是缺血性脑卒中诊断的基石,不仅对急性缺血性卒中,而且对亚急性和慢性缺血性脑损伤也是如此[34]。研究发现,在急性大脑中动脉闭塞中,每分钟大约会丢失190 万个神经元,而早期的影像学检查能帮助临床医师抓住最佳诊疗时间[20]。缺血半暗带区为脑梗死核心区周围由于脑血流灌注不足而导致神经功能受损的脑组织,但仍可维持细胞正常电活动,尚存在可挽救的神经元细胞[35]。因此,快速准确识别半暗带区域并统计一定时间内半暗带丢失面积可作为判断脑梗死治疗是否有效的一个关键性观察指标。目前临床上用于评估脑梗死后半暗带面积的主要影像学方法包括CT 灌注成像、MRI 磁共振成像、正电子发射体层摄影等[36],临床研究发现在急性脑梗死超早期的诊断上MRI更具优势,且能够明确识别潜在可存活的半暗带组织和不可存活的梗死核心区,对于临床诊断及治疗具有十分重要的意义[37,38]。目前普遍认为PDM 是临床判断缺血性半暗带的“金标准”,是鉴定半暗带面积最有效的影像学方法。通过DWI 反映核心梗死区,PWI 反映所有血流灌注降低的区域,二者的差值被广泛应用于判定半暗带区域。本研究将MCAO 大鼠ADC 和CBF 不匹配区域定义为缺血半暗带区域,结果显示,24 h 较缺血半暗带区较4.5 h较少,而梗死面积却相应增加。通过PDM 所得到的参数并按照一定公式计算4.5 h 到24 h 的半暗带丢失率,结果显示,醒脑静组的半暗带丢失率低于模型组,差异具有统计学意义(P<0.05),表明醒脑静注射液能够在一定程度上抑制大鼠脑缺血急性期半暗带转化。
综上所述,醒脑静注射液能够改善缺血半暗带区神经元状态,减少胶质细胞和微血管损伤,并抑制细胞凋亡,转化为不可逆的梗死组织较模型组减少,在一定程度上挽救部分半暗带,对脑缺血急性期半暗带区脑组织具有一定的保护作用。不足的是,本实验未能从分子机制层面探讨醒脑静注射液对大鼠脑缺血急性期半暗带转化的影响,有待进一步深入研究,为临床上治疗急性脑梗死提供更多的理论依据和实验证据。
作者贡献度说明:
实验设计为通讯作者,动物造模实验实施为第一作者和第二作者,病理染色实验为第四作者和第五作者,核磁及分析为第二、七作者,统计为第三、六作者,第一、二、三作者共同执笔,通讯作者为审校。

