Ddit4 3′UTR 双荧光素酶报告基因质粒的构建及调控microRNA 的鉴定
孙雨晴,王宇飞,宋美燕,张娟,张丽,李美宁,白云,刘志贞
1.山西医科大学生物化学与分子生物学教研室,山西太原030000;2.山西省妇幼保健院妇产科,山西太原030000
世界卫生组织预计,2012 年我国出生缺陷发生率约为5.6%,特别是山西省吕梁市柳林县及临县,发病率可高达10%[1]。其中神经管畸形(neural tube defects,NTDs)是一类常见的中枢神经系统出生缺陷相关疾病,发病率位居出生缺陷疾病的第2 位,仅次于先天性心脏病[2-3],主要临床表现为脑膨出、无脑儿及脊柱裂。围产期每天增补4 mg 叶酸已作为降低NTDs 发生率的主要有效预防措施[4]。鉴于NTDs发病机制的复杂性和不确定性,对其研究尚无明确报道。因此,探索NTDs 的发病原因具有十分重要的社会价值和研究意义。
微小 RNA(miRNA)是长度约为 22 个核苷酸(NT)的非编码 RNA,通过与靶mRNA 的3′UTR 序列特异互补结合调节下游目标基因表达,导致mRNA 降解或翻译抑制,人类基因约有 1 / 2 mRNA 受 miRNA 调控[5]。miRNA 已被证实广泛参与细胞周期调控、胚胎发育、细胞生长分化和凋亡、应激反应、代谢或形态发生等重要生命活动过程[6-9];在神经细胞谱系的决定、突触和神经发生等神经生物学等方面同样发挥关键作用[10];目前研究表明,miRNAs 参与调控神经干细胞(neural stem cells,NSCs)分化和哺乳动物的脑发育[11-14]。大量研究发现,miR-222-3p 在乳腺癌、甲状腺癌和脑胶质瘤等的细胞增殖、迁移和分化过程中发挥显著的调控作用[15-18],但在NTDs 发生过程中的相关研究尚未见报道。miR-222-3p 下游Ddit4 基因被称为氧化应激基因,属于DDIT(DNA damage inducible transcript)或GADD(growth arrest DNA damage)蛋白家族[19]。人和小鼠的 Ddit4 蛋白在其 C-端相当保守,均含有RTP801_C 蛋白结构域,序列一致性可达61%,研究也发现,其同源基因scylla 和charybde 参与果蝇头部发育[19]。既往许多研究表明,Ddit4 在肿瘤发生发展、胚胎发育等生理过程中发挥重要作用[20],但对于如何调控Ddit4 表达,进而参与疾病的机制尚未阐明。
本实验室前期miRNA-Seq 测序结果发现,miR-222-3p 及其下游靶基因 Ddit4 在 C57BL / 6 小鼠正常胚胎脑组织和全反式维甲酸(all-trans retinoic acid,ATRA)诱导的NTDs 胚胎脑组织存在差异表达[21]。基于此,本研究首先利用ATRA 诱导小鼠NTDs 模型,再通过生物信息学方法及双荧光素酶检测分析miR-222-3p 与Ddit4 基因之间是否为靶向关系,以期了解miR-222-3p 在大脑发育中的功能。
1 材料与方法
1.1 细胞、载体及基因组DNA HT-22 细胞株购自广州吉妮欧细胞库;miR-222-3p 模拟物(miRNA mimics)及其阴性对照(mimis NC)、293T 基因组 DNA 均购自上海吉玛制药技术有限公司;带GFP 的Ddit4 空载体和小鼠源GP-miRGLO 购自中国GenePharma 公司。
1.2 主要试剂及仪器 ATRA 购自美国Sigma 公司;蛋白胨(tryptone)及酵母提取物(yeast extract)购自英国OXOID 公司;琼脂糖、Universal DNA Purification Kit、DNA 纯化回收试剂盒购自天根生化科技(北京)有限公司;Phusion DNA 连接酶、限制性内切酶SacⅠ、XhoⅠ和普通DNA 聚合酶均购自美国Fermentas公司;ClonExpress®Entry One Step Cloning Kit 购自南京诺唯赞生物科技有限公司;DualGlo®Luciferase Assay System 购自美国Promega 公司;体式显微镜购自日本Olympus 公司;10%胎牛血清购自美国Gibco公司;DMEM 培养基购自美国Hyclone 公司;LipofectmineTM2000 购自美国Invitrogen 公司。
1.3 实验动物 清洁级 C57BL / 6 成年小鼠,8 ~ 12周龄,体重22 g 左右未繁殖发情期雌鼠和体重26 g左右的雄性小鼠,购自山西医科大学动物中心,动物合格证号为SCXK(晋)2015-0001。本实验对小鼠的所有处理均以科研为目的进行养殖和使用,且按照动物伦理相关规定进行。
1.4 小鼠NTDs 模型的建立 研究发现,神经管闭合的关键时点为E8.5 ~E10.5[22]。本课题组前期通过 ATRA 建立 NTDs 模型[23],测序结果也显示[21],与对照组相比,畸形组miR222-3p / Ddit4 表达异常,表明miR222-3p/Ddit4 参与了神经管的发育。因此,本实验选择在E7.5 给药建模,E10.5 处死孕鼠,分离完整胚胎。将雌鼠及雄鼠于下午6:00 进行合笼交配,次日8:00 分笼,阴栓及体重增加的雌鼠作为孕鼠,中午 12:00 即为 E0.5,E7.5 时,将配制好的ATRA 按照 28 mg / kg 剂量灌胃,灌入等剂量的香油作为正常对照组。小鼠怀孕至E10.5,通过颈椎脱臼法处死孕鼠,将其泡入75%乙醇,沿其腹中线剪开腹部暴露子宫,用镊子夹取串珠状子宫,剪下放入PBS缓冲液中清洗,而后在体式显微镜下依次剥离子宫壁、虹膜组织、Reichart’s 膜、羊膜后,分离出完整胚胎。观察剥离的对照组和畸形组胚胎的差异,拍照。
1.5 Ddit4 野生型(WT)和突变型(MUT)双荧光素酶报告基因质粒的构建 通过Targetscan、PicTar、miRanda 及PITA、miRDB 等生物信息学软件筛选出得分较高,且交集较多的靶基因,结合前期测序结果选择Ddit4 靶基因。进一步利用PCR 法,按照3′UTR Ddit4(mmu)序列信息设计其扩增引物,以293T基因组 DNA 为模板,PCR 扩增 Ddit4 基因的 3′UTR序列,将其克隆至小鼠源GP-miRGLO。提取健康小鼠全血基因组DNA,以其为模板,PCR 扩增含miR-222-3p 结合位点的 Ddit4 3′UTR 区域,分别于 PCR 引物5′及 3′端添加 SacⅠ和 XhoⅠ酶切位点。Ddit4 正向引物:5′-CCTTAGGAGTCACACAGGCTTCTGGCTGGATGTGTATGTAGCATGTACCTTATTTTTTTTTATTACTGACAC-3′,反向引物:5′-TCGAGTGTCAGTAATAAAAAAAAATAAGGTACATGCTACATACACATCCAGCCAGAAGCCTGTGTGACTCCTAAGGAGCT-3′;根据野生型序列将 miRNA-222-3p 与 Ddit4 3′UTR 区域特异性结合部位碱基变为无意义序列,设计特异定点突变引物。正向引物:5′-CCTTAGGAGTCACACAGGCTTCTGGCTGGATGTGTTACATCGATGTACCTTATTTTTTTTTATTACTGACAC-3′,反向引物:5′-TCGAGTGTCAGTAATAAAAAAAAATAAGGTACATCGATGTAACACATCCAGCCAGAAGCCTGTGTGACTCCTAAGGAGCT-3′。用SacⅠ和XhoⅠ对载体GP-miRGLO 37 ℃酶切2 h,琼脂糖凝胶电泳线性化后,用DNA 凝胶回收试剂盒回收载体条带,用T4 DNA ligase 与退火得到的双链模板22 ℃连接2 h。连接产物转化氯化钙法制备的大肠埃希菌感受态细胞,挑选 4 个克隆菌落,置于 5 mL LB 培养基(含 50 μg /mL Amp)中,37 ℃,250 r / min 摇床培养 16 h。用质粒小提试剂盒抽提菌液质粒,送上海吉玛制药技术有限公司测序。将测序结果与目的基因序列进行比对,确认其序列一致后,将保存的甘油菌液接种LB培养基,进行质粒大量抽提,获得重组质粒。
1.6 细胞培养及转染 用含10%胎牛血清和1%双抗(100 U / mL 青霉素,100 μg / mL 链霉素)的 DMEM培养基,于37 ℃,5%CO2细胞培养箱中常规培养HT-22 细胞。用 LipofectmineTM2000 将带 GFP 的 Ddit4空载体按 2.08 μg / 孔(6 孔板)转染 HT-22 细胞,倒置荧光显微镜下观察转染效率。
1.7 双荧光素酶活性检测 HT-22 细胞培养24 h后,按照每孔1.5×104个接种于96 孔板中,取75 μL不含血清及双抗的DMEM 培养基,加入2.5 μL miR-222-3p 模拟物(miRNA mimics)或 miR-222-3p 阴性对照(mimis NC),75 μL(25 μL / 孔)无血清培养基加入0.8 μL Ddit4 3′UTR 双荧光素酶报告基因WT或 MUT 质粒,75 μL 不含血清及双抗的 DMEM 培养基加入 0.3 μL LipofectamineTM2000 试剂,3 者混合5 min,摇匀,室温作用 20 min;将 WT 或 MUT 质粒、miRNA mimics 或 mimis NC 加入细胞前,吸弃 50 μL培养基,加入上述混合液50 μL,其中转染浓度mimics均为 20 μmol / L,质粒为 130 ng / 孔,每组设 3 个重复。6 h 后更换100 μL 新鲜培养基;检测荧光前,将试剂盒的Dual-Glo buffer + Dual-Luciferase substrate混合后配成Dual-Glo & Luciferase Reagent 后分装,-80 ℃贮存,使用前解冻至室温。Dual-Glo & stop &Glo buffer-20 ℃贮存,现配现用。转染48 h 后,吸出25 μL 培养基,加入 75 μL Dual-Glo&Luciferase Reagent,摇床等待至少10 min 使细胞裂解,然后检测萤火虫荧光素的发光强度;检测后加入75 μL Dual-Glo&stop&Glo Reagent,置于摇床上,等待至少10 min,检测海肾荧光素的发光强度;最后收集和分析数据。
1.8 统计学分析 应用SPSS 17.0 软件进行统计学分析,实验数据用均数 ± 标准差()表示,两个样本均数间差异比较采用t 检验,以P <0.05 为差异有统计学意义。数据作图使用GraphPad Prism 8 软件。
2 结 果
2.1 小鼠NTDs 模型的建立及miR-222-3p 的表达水平 体式显微镜下观察发现,畸形组小鼠胚胎有明显的前脑及后脑畸形,表明此剂量ATRA 确能使C57BL / 6 小鼠神经管畸形,侧面证实了前期测序结果真实可用,并提示miR222-3p / Ddit4 参与了神经管的发育,可进行后续验证。

图1 体式显微镜观察两组小鼠E10.5 胚胎(× 50)Fig.1 Stereomicroscopy of E10.5 of mice in two groups(× 50)
2.2 miR-222-3p 与 Ddit43′UTR 互补结合位点及双荧光素酶报告基因构建质粒的鉴定 经生物信息学软件筛选,发现 miR-222-3p 与 Ddit4 3′UTR 存在互补结合位点,见图2。载体具有双荧光素酶位点,可用于后续双荧光素酶试验,见图3。测序结果显示,WT 型和MUT 型质粒构建成功,见图4。1.2%琼脂糖凝胶电泳分析显示,重组质粒GP-miRGLO-Ddit4-WT 和 GP-miRGLO-Ddit4-MUT 经 SacⅠ和 XhoⅠ双酶切,均可见约70 bp 的目的片段,见图5。

图2 生物信息学预测miR-222-3p 与Ddit4 结合位点Fig.2 Bioinformatics prediction of binding sites of miR-222-3p and Ddit4

图3 Ddit4 双荧光素酶载体图Fig.3 Dual luciferase vector for Ddit4
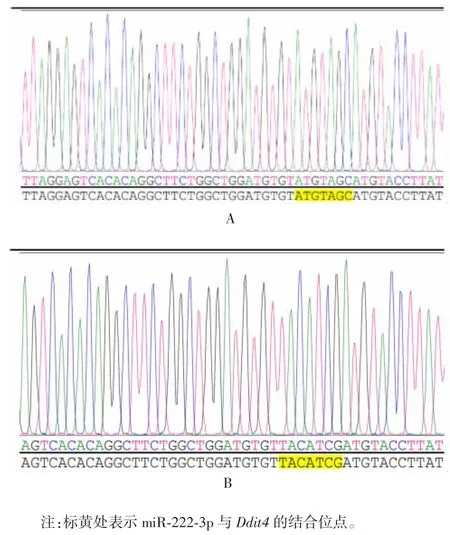
图4 Ddit4-WT(A)和 Ddit4-MUT(B)质粒测序结果Fig.4 Sequencing of Ddit4-WT(A)and Ddit4-MUT(B)plasmids
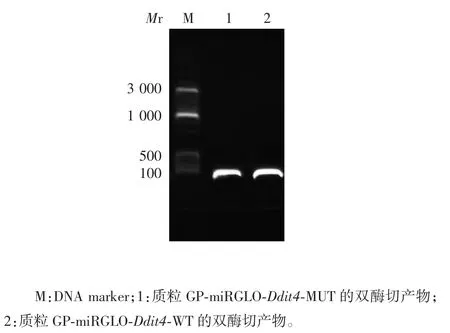
图5 WT 型和MUT 型重组质粒的双酶切鉴定(SacⅠ/XhoⅠ)Fig.5 Restriction map of WT and MUT recombinant plasmids(SacⅠ/ XhoⅠ)
2.3 转染效率 倒置荧光显微镜下观察可见,GFP的表达随时间增加而增强,至48 h 荧光表达强度基本稳定,转染效率达90%以上,见图6。
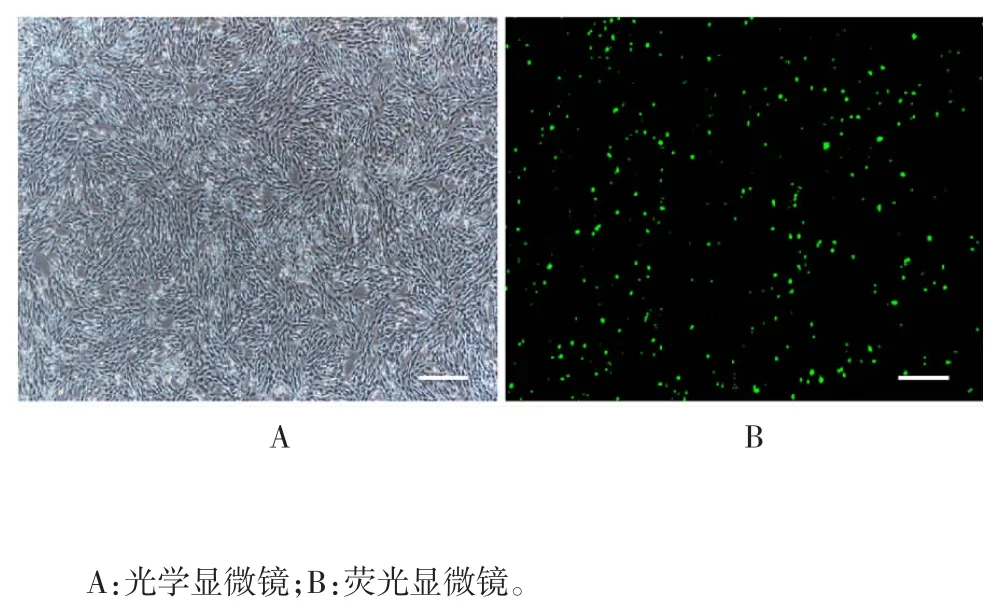
图6 荧光显微镜观察转染后GFP 表达(× 100)Fig.6 Fluorescence microscopy of GFP expression after transfection(× 100)
2.4 双荧光素酶活性 空白对照组Ddit4-PC 转染mimis NC 和mimis-miR-222-3p 后,荧光素酶活性无显著变化(t=0.357 9,P=0.497 246);Ddit4-WT+mimismiR-222-3p 组与Ddit4-WT + mimis NC 内参组相比,荧光素酶活性明显降低(t = 21.85,P = 0.000 026),表明mimis-miR-222-3p 能抑制野生型Ddit4 质粒荧光素酶活性;而Ddit4-MUT + mimis-miR-222-3p 组与Ddit4-MUT+mimis NC 内参组相比,差异无统计学意义(t = 1.619,P = 0.180 782),进一步表明mimismiR-222-3p 无法抑制突变型Ddit4 质粒荧光素酶活性。见图7。

图7 双荧光素酶活性分析Fig.7 Analysis of activity of dual luciferase
3 讨 论
microRNAs 主要在基因表达和蛋白质翻译过程中起调控因子的作用,在多种疾病的发生发展中起调控枢纽的作用[24-25],其通过转录后水平结合下游靶基因3′UTR 区域进而沉默下游靶基因,从而发挥其调控作用。前期研究表明,包括miR-222-3p 在内的多种microRNAs 参与调节胚胎发育、NTDs 的发生发展[26-27]。本研究结果表明,在NTDs 小鼠胚胎脑组织中,miR-222-3p 表达降低且下游靶基因Ddit4 表达增加。因此,证实Ddit4 为miR-222-3p 靶向调控的基因,该结果对于明确miR-222-3p 在NTDs 发生发展中的作用机制,开发NTDs 个体化治疗新的分子靶点具有重要价值。
本实验首先利用多个靶基因预测数据库查询得出Ddit4 可能是miR-222-3p 的下游靶基因,但microRNAs 对下游靶基因是否存在调控作用尚需进一步证实。HT-22 细胞是一种小鼠海马神经元细胞系,目前已应用于多种中枢神经疾病的研究中。因此,本实验选则该细胞系,采用双荧光素酶试验来进一步验证,将含有miR-222-3p 结合靶位点3′UTR 的Ddit4基因目的片段克隆插入双荧光素酶载体中的SacⅠ、XhoⅠ位点,经SacⅠ和XhoⅠ双酶切及测序后证明质粒构建正确。此外,本实验结果表明,miR-222-3p表达增加可明显抑制双荧光素酶荧光活性。将Ddit4基因 mRNA 3′UTR 的 miR-222-3p 种子序列结合位点内的7 个碱基进行定点突变后,发现过表达miR-222-3p 后,荧光强度未明显改变。上述结果表明,miR-222-3p 能够直接作用于 Ddit4 的 3′UTR 区,对其产生负性调控作用。而Ddit4 基因在帕金森阿尔兹海默症等退行性神经系统疾病中,参与调节作用[28-29];Ddit4 还可能参与细胞增殖、细胞周期调控、胚胎背腹部发育、细胞凋亡诱导等生理过程[30-32]。
综上所述,本研究首次成功构建了Ddit4 基因双荧光素酶载体,并证实了Ddit4 与miR-222-3p 存在靶向关系,这些结果对miR-222-3p 在大脑发育中的功能提供了的新认识,并给疾病和神经生物学带来了深远的影响。

