Sestrin2 在2 型糖尿病血栓形成中的作用
李萍 综述, 哈小琴 审校
1.兰州大学公共卫生学院营养与食品卫生研究所,甘肃兰州730000;2.中国人民解放军联勤保障部队第九四〇医院检验科,甘肃兰州730050;3.甘肃省干细胞与基因药物重点实验室,甘肃兰州730050
2 型糖尿病(type 2 diabetes,T2D)是一种以血糖升高、胰岛素分泌不足或胰岛素抵抗为主要表现的慢性代谢性疾病,现已成为全球性的公共卫生问题。据国际糖尿病联盟(International Diabetes Federation,IDF)2019 年数据显示,全球有 4.63 亿糖尿病患者,预计到2030 年将增至5.52 亿。中国糖尿病患者有1.164 亿,已成为世界第一的糖尿病人口大国。仅2019 年我国用于糖尿病方面的花费已达1.096亿美元[1],给全国医疗卫生和社会财政带来了巨大的压力及挑战。研究显示,T2D 患者多处于血栓前状态[2],其发生动脉粥样硬化血栓事件的风险比非糖尿病者高2 ~ 4 倍。在T2D 死亡患者中,约80%死于血栓事件[3],心血管疾病已成为T2D 患者过早死亡的主要原因[4]。因此,对于T2D 血栓的防治已迫在眉睫。T2D 血栓的形成主要与氧化应激增强、炎症反应、血管内皮损伤和血小板高度活化密切相关[5]。近年来研究发现一种新型蛋白——Sestrin2(Sesn2),在抗氧化、抗炎和调节糖代谢中具有重要潜力,在多种疾病中发挥着保护作用[6]。
本文就Sesn2 蛋白在T2D 血栓形成关键环节中的作用作一综述,以期为T2D 血栓的防治提供新的思路和治疗靶点。
1 T2D 血栓的形成
1.1 血栓 血栓是指在流动的血液中血液成分在血管或心脏内膜表面形成的一种凝块或沉积物[7]。血栓可分动脉血栓和静脉血栓[8]。动脉血栓又称为“白色血栓”,主要由血小板构成,与斑块破裂相关。涉及的疾病有冠脉综合征、心肌梗死和脑梗死(中风);静脉血栓又称为“红色血栓”,主要由红细胞和纤维蛋白构成,与内皮损伤和血瘀相关。涉及的疾病有深静脉血栓、肺栓塞。通常静脉血栓较为常见,但动脉血栓造成的死亡率更高。血栓的形成与血细胞比容升高、血液黏度增加、血流动力学改变、血管壁受损、血小板活化以及凝血酶、纤维蛋白和细胞因子的分泌有关[9]。因此,血栓的早期、快速、准确诊断对于血栓类疾病的治疗及预后具有重要意义。
1.2 T2D 血栓形成机制 T2D 患者多存在血脂增高,凝血酶活性增强[10],活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)缩短[11]以及循环分子异常的状态[12]。这些改变均与血液高凝状态相关。此外,与非糖尿病家族史的健康者相比,T2D 患者的非糖尿病一级亲属凝血酶原片段、D-二聚体水平较高,β 细胞功能降低,处于血栓前状态[13]。表明在糖尿病发生前相关指标已发生异常。而这一系列从早期异常到晚期血栓的形成均伴随着氧化应激和炎症反应。
高的氧化应激会使胰岛β 细胞功能受损,出现胰岛素抵抗、血脂异常、葡萄糖耐量降低和炎症反应[14],还会在直接损伤血管内皮的同时[15],通过增加核因子-κB(nuclear factor-kappa B,NF-κB)、转化生长因子-α(transforming growth factor-a,TGF-α)和转化生长因子β(TGF-β)来增加内皮和血管平滑肌细胞的增殖[16],促进动脉粥样硬化形成。此外,过多的自由基(O2、H2O2和 NOX 等)会与血小板以及内皮细胞表面上的相关分子(P-选择素、E-选择素、血管间黏附分子、细胞间黏附分子和血管细胞黏附分子)相互作用,引起血小板和白细胞向血管内皮的聚集[17-18]。研究还发现,氧化应激能增加花生四烯酸(arachidonic acid,AA)、血栓烷 A2(thromboxane A2,TXA2)和前列腺素(prostaglandin,PG)的产生,进一步破坏内皮[19],而且炎症分子(IL-1β、IL-6 和 C 反应蛋白)和细胞因子(血管紧张素Ⅱ、血管内皮生长因子、血小板源生长因子、转移生长因子、巨噬细胞激活因子-1 和肿瘤坏死因子-α)的表达增加均与氧化应激相关[20]。而高血糖同样会导致活性氧(reactive oxygen species,ROS)产生增多,加重氧化应激,还会诱使糖基化终产物(advanced glycation end products,AGEs)、蛋白激酶 C(protein kinase C,PKC)、多元醇和己糖胺途径的激活,引起内皮细胞基因表达改变[21],而且高糖和胰岛素抵抗还会导致血小板活化和聚集[15]。炎症也不是单项调节的系统。炎症反应激活同样会造成胰岛β 细胞功能障碍,加重胰岛素抵抗,造成血管的损伤[22]。炎症因子的过量产生还会增加内皮促凝血因子(假性血友病因子和组织因子)的释放,阻碍抗凝血因子(血栓调节蛋白和抗凝血酶)的表达,加剧凝血的发生,促使血管动脉粥样硬化斑块和血栓的形成。研究显示,T2D 患者体内C 反应蛋白、P 选择素、E 选择素、细胞间黏附分子、甘油三脂、高密度脂蛋白等指标表达增加与T2D 血栓的发生均呈正相关[23]。因此,高糖、氧化应激和炎症反应相互影响共同介导血栓的形成(其相互作用关系见图1)。
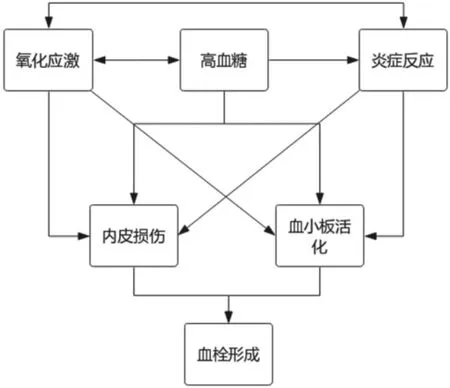
图1 T2D 血栓形成简易关系图Fig.1 Diagram of T2D thrombosis
2 Sesn2 与T2D 血栓形成的相关性
2.1 Sesn2 Sesn2 是近年来在哺乳动物体内发现的一种新型的高度保守的应激型蛋白,作为Sestrins 家族(Sestrin1、Sestrin2 和 Sestrin3)中的一员。Sesn2 由P53 基因调控,在低氧条件下易被诱导,因此被称为低氧诱导型基因 95(hypoxia-inducible 95,Hi95)[24]。由于最初Sesn2 蛋白结构与已知的任何结构域和酶活性点均无明显的相似性,使得学者对其的研究陷入了困境。随着近年来研究的不断深入,KIM 等[25]首次报告了人类Sesn2(hSesn2)的晶体结构,认为人类的Sesn2 是仅由珠蛋白组成的2 个α-螺旋结构域(Sesn-A 和 Sesn-C)和一个螺旋-环-螺旋结构域(Sesn-B)连接组成。其中Sesn-A 端包含1 个氧化还原酶结合位点,Sesn-C 端在介导mTORC1(下文进行介绍)调节的同时还具有亮氨酸结合位点,在机体营养代谢中发挥着重要作用。Sesn2 蛋白的三维结构见参考文献[25]。
2.2 Sesn2 蛋白与氧化应激和炎症反应 腺苷单磷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)是在能量缺乏的情况下被激活的一种酶,雷帕霉素(mammalian target of rapamycin,mTOR)是 AMPK 下游物质,分为对雷帕霉素敏感的雷帕霉素复合物1(mammalian target of rapamycin compound 1,mTORC1)和对雷帕霉素不敏感的雷帕霉素复合物2(mTORC2)。AMPK 和mTORC 是机体重要的营养传感器,可调节能量代谢稳态。研究发现,mTORC1 可在氧化应激和能量代谢异常中介导内质网应激,与胰岛素抵抗相关[26],而 Sesn2 能够促进 AMPK 的活化,抑制mTORC1 的活性,调节自噬以增加胰岛素敏感性[27]。EL-ASHMAWY 等[28]的研究就指出血清 Sesn2 水平与T2D 患者的胰岛素抵抗(通过HOMA-IR 测量)和代谢综合征相关,表明其可以作为相关代谢紊乱的新型预后标志物和潜在治疗靶标。
Sesn2 的抗氧化作用主要体现在会增强超氧化物歧化酶(superoxide dismutase,SOD)活性、降低丙二醛(malondialdehyde,MDA)的产生方面[29]。在细胞靶向Sesn2 siRNA 处理后,Sesn2 mRNA 和蛋白质表达降低,过氧化物酶(2.1 倍)和 ROS 产生(1.3倍)较原来明显增加[30]。其抗氧化机制较多,主要涉及 Sesn2 对肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)-AKT-mTOR 途径激活自噬的抑制,氧化反应元件(antioxidant response elements,AREs)和核因子红系 2 相关因子 2(NF-E2-related factor 2,Nrf2)的调节[31],以及在缺氧状态下,缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)对 Sesn2 表达的上调[32]。其他未知的抗氧化途径尚需进一步探索,以便全面认知Sesn2 的抗氧化过程,进行靶向抗氧化治疗。
Sesn2 除具有较强的抗氧化能力外,还可通过多种途径发挥抗炎作用。T2D 受试者中Sesn2 的表达水平与炎症标志物超敏C 反应蛋白(high-sensitivity C-reactive protein,hsCRP)相关[33],单核细胞激活和抗炎反应中Sesn2 表达降低与动脉粥样硬化形成风险的增加相关[34]。而巨噬细胞作为炎症反应的主要参与细胞,YANG 等[35]学者的研究发现,Sesn2 过表达抑制了M1 巨噬细胞在体外和体内的炎症反应,还具有促进修复的功能,这主要与mTORC1 信号传导的抑制相关。当然,Sesn2 也可通过抑制脂多糖诱导的一氧化氮释放和诱导型一氧化氮合酶的表达发挥抗炎作用,也可通过JNK 或p38 介导的c-Jun 磷酸化来抑制Toll 样受体诱导的促炎信号来保护细胞功能[36]。
2.3 Sesn2 与内皮细胞 血管内皮位于管腔最内层,是血栓和动脉粥样硬化发生的基床,也是最先损伤的部位。正常状态下内皮细胞可分泌多种因子调节血管收缩及舒张,防止血小板活化和细胞黏附,维持血管完整性、通透性和血液正常流动[37]。内皮一旦受损会使P 选择素、E 选择素、细胞间黏附分子、血管黏附分子、内皮素的表达增加,促使血小板活化,招募白细胞向内皮聚集[38-39],加剧动脉粥样硬化的发生。HWANG 等[40]学者在实验中首次证实了Sesn2 基因敲低的小鼠血液和细胞中,血管细胞黏附分子、细胞间黏附分子和E-选择素在内的黏附分子的表达均显著增加,证实了Sesn2 具有抑制细胞黏附的作用。如前所述,Sesn2 的表达受P53 基因的调控,CHEN 等[41]在实验中发现,经 P53 和 Sesn2 构建干扰RNA(siRNA)使其表达沉默后可减弱色素上皮衍生因子(pigment epithelium-derived factor,PEDF)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)的自噬,而且还发现 PEDF 可依次诱导P53 和Sesn2 表达来诱导HUVEC 自噬,这一过程与mTOR 的抑制相关。提示Sesn2 是通过抑制mTOR 发挥自噬作用以保证内皮的修复。在大鼠的脑梗死模型中,HIF-1α 正向调节Sesn2 和血管内皮生长因子的表达,经重组人Sesn2 注射后可减轻脑梗死程度,而沉默Sesn2 可逆转严重缺氧缺血后的这些保护作用[32],这也进一步证实了Sesn2 具有内皮修复的功能。YI 等[42]的研究发现,血管紧张素Ⅱ诱导人HUVEC 中Sesn2 的表达呈时间依赖性和剂量依赖性关系,敲低Sesn2 会促进血管紧张素Ⅱ的细胞毒性,降低细胞活力,加剧氧化应激和细胞凋亡,而这种作用是由JNK / c-Jun 途径介导的。提示Sesn2 可能是通过相关的抗氧化途径调节内皮收缩功能。以上研究均证明,Sesn2 的表达具有保护内皮细胞的作用,是治疗心血管疾病的有效药理靶标。
2.4 Sesn2 与血小板活化 血小板是血栓形成过程中与心血管疾病风险增加相关的关键参与者。与健康受试者相比,T2D 患者的血小板计数、血小板分布宽度、平均血小板体积值和血小板 / 淋巴细胞比率显著升高[43],更易于形成自发的微聚集体[44]。慢性高血糖症已被明确为导致血小板聚集增强、纤维蛋白原结合增加的原因[45]。在脑梗患者中发现梗死面积与糖尿病血小板产生的ROS 量呈正相关[46]。来自糖尿病个体的血小板对抗聚集胰岛素、一氧化氮和前列腺素2 的敏感性均降低[47]。说明T2D 患者血小板形态、数量以及功能发生改变,促使了血栓的形成。Sesn2 作为抗氧化剂蛋白,被证实是血小板源性生长因子受体β(platelet-derived growth factor receptor,Pdgfrβ)信号的抑制剂,抑制作用与抗氧化剂基因诱导物 Nrf2 的正向调节相关[48]。Pdgfrβ 能在多种细胞中表达,具有促进细胞迁移、血管生成的作用[49]。对其抑制有助于降低动脉粥样硬化、肿瘤、组织纤维化疾病的发生。靳文等[50]的研究也证实,Sesn2 激动剂能够降低慢性肾功能不全小鼠血小板ROS 生成及P-选择素表达,对小鼠动脉粥样硬化血栓的形成具有延缓作用,其机制可能与血小板活化相关。虽然以上研究显示Sesn2 与血小板之间的作用有利于抑制血栓的发生,但目前报道的相关研究较少,尚需进一步探明二者相互作用的机制,为血栓的治疗指明方向。
3 总结与展望
T2D 易发生包括血栓在内的多种血管并发症,其病例生理机制较为复杂。涉及糖代谢、氧化应激、炎症免疫、凝血和纤溶等多个系统之间的相关影响。而Sesn2 在氧化应激、炎症反应、糖代谢和胰岛素抵抗中均显示突出的抑制作用,在其他系统和部位也均有参与。在其他疾病(如肥胖症、癌症、心脏肥大、动脉粥样硬化和神经退行性疾病)中也被证实发挥保护作用[51],是有利的预后标志物和各种疾病的可行治疗靶标。但Sesn2 与血栓之间的研究鲜有报道,其涉及的机制尚未证实,因此,还需进一步借助体内、体外以及大样本人群的研究去探索Sesn2 与内皮细胞、血小板以及血栓形成分子标志物之间的作用机制,确定Sesn2 在血栓治疗中的药物靶点作用,为糖尿病血栓的治疗明确导向,有望早日成为糖尿病血栓及其他疾病的重要治疗靶标。

