冻干甲型肝炎减毒活疫苗除菌过滤前后产品质量分析
周振歆,易力,常亚军,杨家方,汪启兵,马忠飞,董少忠
中国医学科学院医学生物学研究所,云南昆明650031
冻干甲型肝炎减毒活疫苗用于预防由甲型肝炎病毒(hepatitis A virus,HAV)引起的甲型肝炎,自2005年上市以来,该疫苗的安全性和免疫原性良好[1-4]。然而,冻干甲型肝炎减毒活疫苗属于非最终灭菌的无菌产品[5-6],根据《中国药典》三部(2015 版)灭菌方法规定:若物品不适合采用最终灭菌法,可选用过滤除菌法或无菌生产工艺达到无菌保证要求[7]。
2020 年5 月8 日,国家药品监督管理局向中国医学科学院医学生物学研究所下发了冻干甲型肝炎减毒活疫苗药品补充申请批件,批准在该疫苗半成品配制前增加除菌过滤工艺。
本研究对2020 年已完成生产的32 批未经除菌过滤和18 批经除菌过滤的冻干甲型肝炎减毒活疫苗,按照企业注册标准的要求进行全项检测,并对产品的有效物质及残留物质进行独立样本t 检验,进一步研究获批的除菌过滤工艺对冻干甲型肝炎减毒活疫苗产品质量的影响。
1 材料与方法
1.1 供试品及细胞 取中国医学科学院医学生物学研究所2020 年已完成生产的32 批(批号为1 ~32)未经除菌过滤工艺生产的冻干甲型肝炎减毒活疫苗和18 批(批号为33 ~ 50)经除菌过滤工艺生产的冻干甲型肝炎减毒活疫苗作为供试品,每批冻干甲型肝炎减毒活疫苗包括2 个亚批,亚批号用批号-1 和批号-2 表示;KMB17 细胞由中国医学科学院医学生物学研究所提供。
1.2 检测方法
按照企业注册标准的要求对32 批(包括64 亚批)未经除菌过滤工艺和18 批(包括36 亚批)经除菌过滤工艺生产的冻干甲型肝炎减毒活疫苗进行全项检测。然后对产品的有效物质(病毒感染性滴度、热稳定性)及残留物质(牛血清白蛋白残留量、抗生素残留量、三氯甲烷残留量)进行独立样本t 检验。
1.2.1 鉴别试验 将每批次产品的2 个亚批合并后使用 ELISA 法进行检测[8-9],应含有 HAV 抗原。
1.2.2 外观 肉眼观察每亚批产品均应为乳白色疏松体,复溶后应为澄明液体,无异物。
1.2.3 水分、pH 值、渗透压摩尔浓度、三氯甲烷残留量、牛血清白蛋白残留量、抗生素残留量、无菌检查、异常毒性检查、细菌内毒素 按照《中国药典》三部(2015 版)通则的相关要求进行检测[7]。其中,每个亚批均进行水分、pH 值、渗透压摩尔浓度、三氯甲烷残留量检测、无菌检查、异常毒性检查、细菌内毒素检测;每批次的2 个亚批合并后进行牛血清白蛋白残留量、抗生素残留量检测。
1.3 病毒感染性滴度检测 取每个亚批3 ~ 5 瓶疫苗供试品混合,10 倍系列稀释至不低于10-8,取不少于3 个稀释度,每个稀释度病毒液分别接种KMB17细胞,置(35.0 ± 0.5)℃培养 24 ~ 26 d,收获HAV。ELISA 法检测 HAV 抗原[8-9];Reed-Muench 法计算病毒感染性滴度,应为 6.67 ~ 7.67 lgCCID50/ mL。
1.4 热稳定性试验 取每个亚批3 ~ 5 瓶疫苗于(35.0 ± 0.5)℃放置 72 h 后,按 1.3 项方法进行病毒感染性滴度检测,应不低于6.5 lgCCID50/ mL,下降不高于 0.5 lgCCID50/ mL。
1.5 统计学分析 使用SPSS 20.0 软件对32 批(包括64 亚批)未经除菌过滤工艺和18 批(包括36 亚批)经除菌过滤工艺生产的冻干甲型肝炎减毒活疫苗有效物质(病毒感染性滴度、热稳定性)及残留物质(牛血清白蛋白残留量、抗生素残留量、三氯甲烷残留量)进行独立样本t 检验,以P <0.05 为差异有统计学意义。
2 结 果
检测结果显示,2020 年32 批(包括64 亚批)未经除菌过滤工艺和18 批(包括36 亚批)经除菌过滤工艺生产的冻干甲型肝炎减毒活疫苗的鉴别试验、外观、水分、pH 值、渗透压摩尔浓度、三氯甲烷残留量、牛血清白蛋白残留量、抗生素残留量、无菌检查、异常毒性检查、细菌内毒素、病毒感染性滴度、热稳定性检测结果均符合企业注册标准的要求。各批次病毒感染性滴度、热稳定性、水分、牛血清白蛋白残留量、抗生素残留量、三氯甲烷残留量、pH 值、渗透压摩尔浓度趋势图见图1。
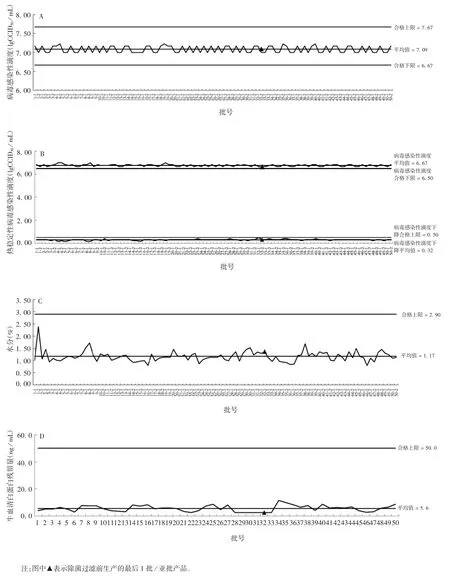
图1 各批次产品病毒感染性滴度(A)、热稳定性(B)、水分(C)、牛血清白蛋白残留量(D)、抗生素残留量(E)、三氯甲烷残留量(F)、pH 值(G)、渗透压摩尔浓度(H)检测项目趋势图Fig.1 Trend chart of viral infectious titer(A),thermal stability(B),moisture(C),residual bovine serum albumin content(D),residual antibiotics content(E),residual chloroform content(F),pH value(G)and osmol concentration(H)of products of various batches
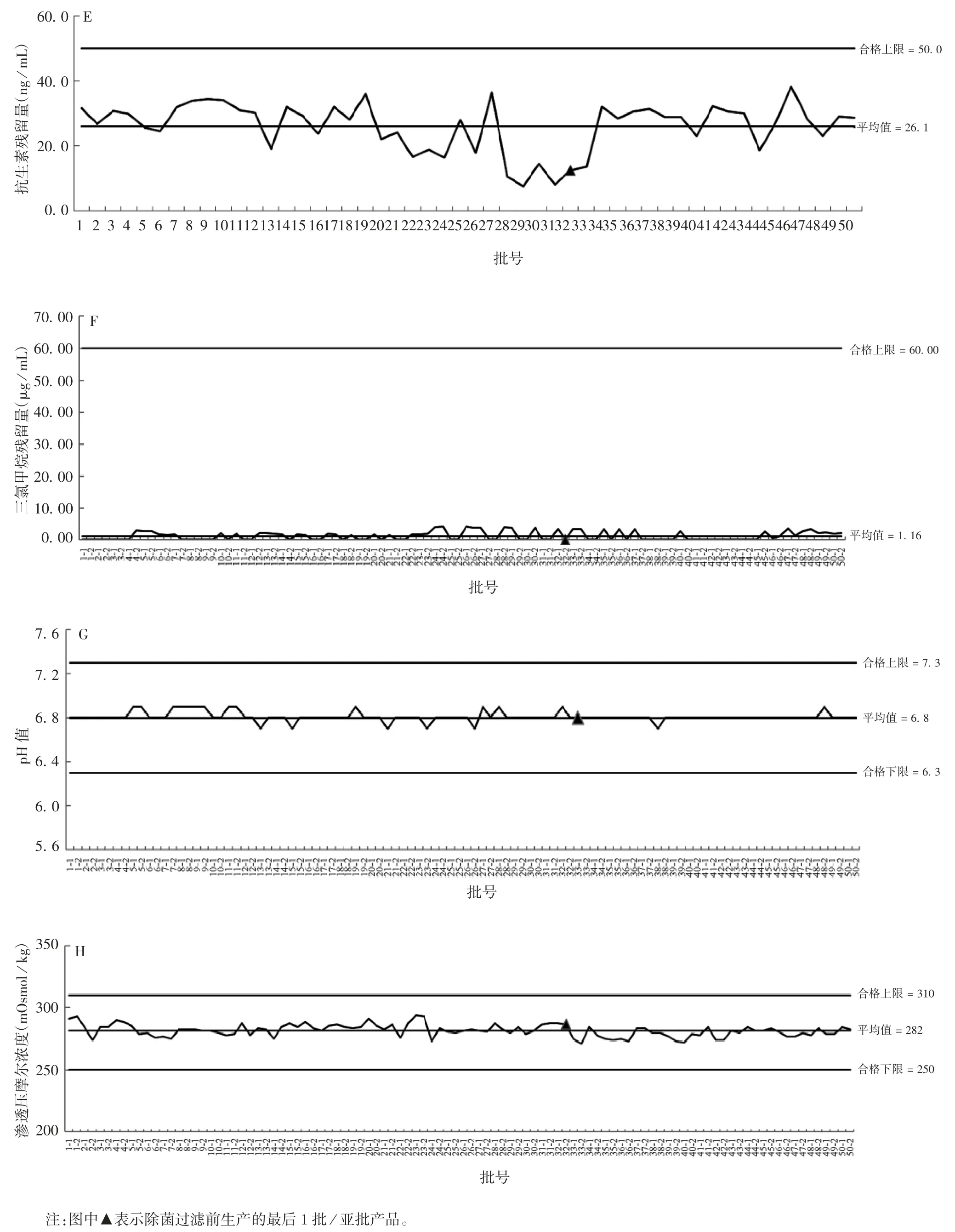
续图1 各批次产品病毒感染性滴度(A)、热稳定性(B)、水分(C)、牛血清白蛋白残留量(D)、抗生素残留量(E)、三氯甲烷残留量(F)、pH 值(G)、渗透压摩尔浓度(H)检测项目趋势图Fig.1(Continued)Trend chart of viral infectious titer(A),thermal stability(B),moisture(C),residual bovine serum albumin content(D),residual antibiotics content(E),residual chloroform content(F),pH value(G)and osmol concentration(H)of products of various batches
正态检验计算结果显示,病毒感染性滴度最大值为 7.23 lgCCID50/mL,最小值为 7.00 lgCCID50/mL,均值为 7.09 lgCCID50/mL,标准差为 0.089 lgCCID50/mL,服从正态分布;热稳定性试验检测结果显示,病毒感染性滴度最大值为7.00 lgCCID50/ mL,最小值为6.67 lgCCID50/mL,均值为 6.77 lgCCID50/mL,标准差为0.085 lgCCID50/mL,服从正态分布;热稳定性试验后病毒感染性滴度下降值最大值为0.50 lgCCID50/mL,最小值为 0.17 lgCCID50/mL,均值为0.32 lgCCID50/mL,标准差为0.058 lgCCID50/ mL;牛血清白蛋白残留量最大值为 11.5 ng / mL,最小值为 2.5 ng / mL,均值为 5.6 ng / mL,标准差为 2.288 ng / mL,服从正态分布;抗生素残留量最大值为38.2 ng / mL,最小值为7.6 ng/mL,均值为 26.1 ng/mL,标准差为7.557 ng/mL,服从正态分布;三氯甲烷残留量最大值为4.08 μg/mL,最小值为 0.00 μg / mL,均值为 1.16 μg / mL,标准差为 1.378 μg /mL,服从正态分布。
独立样本t 检验结果显示,除菌过滤前后病毒感染性滴度(t = 0.176,P > 0.05)、热稳定性[包括病毒感染性滴度(t = 1.328,P > 0.05)和病毒感染性滴度下降值(t = -1.913,P > 0.05)]、牛血清白蛋白残留量(t = -1.850,P > 0.05)、抗生素残留量(t =-1.525,P > 0.05)、三氯甲烷残留量(t = -0.043,P >0.05)差异均无统计学意义。见表1。
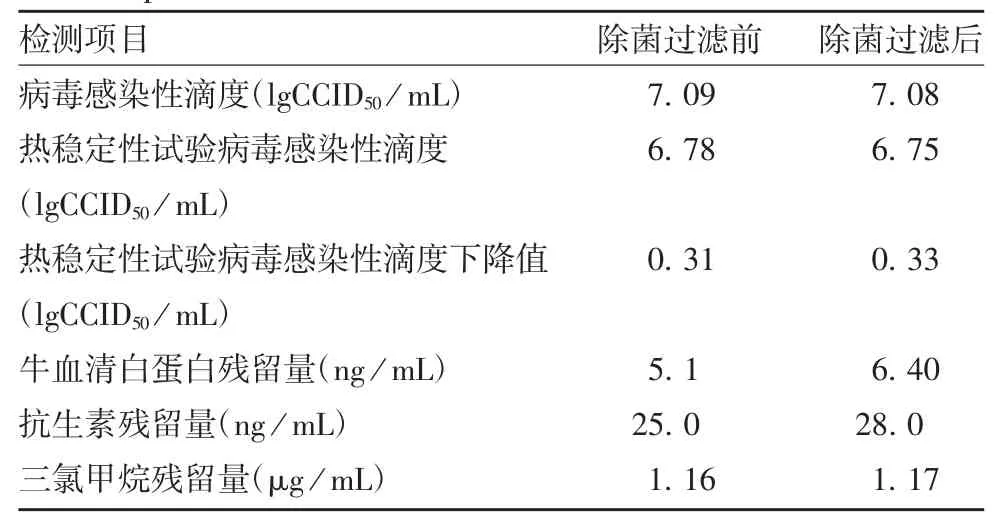
表1 除菌过滤前后冻干甲型肝炎减毒活疫苗有效性物质和残留性物质检测结果Tab.1 Control test results of active substances and residual substances of freeze-dried live attenuated HA vaccine before and after aseptic filtration
3 讨 论
《药品生产质量管理规范》(2010 版)附录1 无菌药品第三条指出:产品的无菌或其他质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)[5]。2018 年以后,随着《除菌过滤技术及应用指南》的颁布[10],进一步指出了除菌过滤工艺在非最终灭菌无菌产品中的应用。因此,为进一步提升冻干甲型肝炎减毒活疫苗的无菌保证水平,中国医学科学院医学生物学研究所在原有无菌生产操作工艺的基础上增加除菌过滤工艺,最大限度地降低了微生物污染的可能性。
除菌过滤工艺是通过除菌过滤器除去流体中的微生物而获得无菌滤液的生产工艺,除菌过滤的过程不得对产品的质量产生不良影响[11-12]。因此,增加除菌过滤工艺应主要考虑3 个方面的内容:①除菌过滤对产品有效物质的影响。冻干甲型肝炎减毒活疫苗的有效成分HAV 为小RNA 病毒科嗜肝病毒属(直径 27~32 nm)[13-14],除菌过滤器孔径为 0.22 μm,虽远远大于HAV 的孔径,但0.22 μm 孔径的定义来源于过滤器微生物截留能力的验证实验,而不是简单的平均粒径的表示[15]。因此,除菌过滤过程中应重点考察过滤器对病毒含量的影响,包括病毒的吸附[10]、截留等。②除菌过滤对残留物质去除效果的影响。③除菌过滤器材质与待过滤介质的相容性。过滤器不得因与产品发生反应、释放物质或吸附作用而对产品质量产生不利影响[10]。
为此,中国医学科学院医学生物学研究所开展了相关的工艺研究。首先,对冻干甲型肝炎减毒活疫苗半成品配制前增加除菌过滤操作进行了小规模试验,选取3 批冻干甲型肝炎减毒活疫苗原液,每批原液平均分成3 份,分别使用3 家企业生产的0.22 μm除菌过滤器(滤芯材质:PES;有效过滤面积:500 cm2)进行除菌过滤操作(共9 次试验),并在除菌过滤前后取样进行病毒感染性滴度检测,以确定除菌过滤操作对产品有效物质损失的影响以及不同企业生产的除菌过滤器之间的差异性。小规模试验结果显示,除菌过滤前后,产品的病毒感染性滴度无显著差异,且3 家企业生产的除菌过滤器间也无显著差异。然后,根据小规模试验结果及除菌过滤器供应情况,选择其中一家企业生产的0.22 μm 除菌过滤器进行商业化规模的3 批工艺验证,并将3 批工艺验证过程中的原液、半成品和成品与3 批2019 年生产的上市批次原液、半成品和成品的检测结果进行独立样本t 检验。结果显示,除菌过滤操作对冻干甲型肝炎减毒活疫苗的质量无影响。除菌过滤器材质与待过滤介质的相容性方面,中国医学科学院医学生物学研究所根据《除菌过滤技术及应用指南》的要求[10],对3 家企业生产的0.22 μm 除菌过滤器分别进行了细菌截留试验(细菌生存性试验、细菌挑战试验)、化学兼容性试验、可提取物和浸出物试验、产品润湿完整性检测试验、吸附性试验及安全性评估验证,结果证明,所使用的除菌过滤工艺和除菌过滤器安全有效。2019 年8 月,中国医学科学院医学生物学研究所将该研究结果向国家药品监督管理局提请了药品注册补充申请,并于2020 年5 月8 日获得批准。
工艺变更批准后,在实际生产过程中进一步确认除菌过滤对疫苗质量的影响具有重要意义,不仅可进一步验证前期工艺变更的可靠性和稳定性,又可为今后的疫苗生产提供数据支持和指导意义,同时,还可为其他非最终灭菌的无菌产品在提升无菌保障性工艺变更中增加除菌过滤工艺提供相应的参考依据。
因此,本文选取2020 年增加除菌过滤工艺前生产的32 批冻干甲型肝炎减毒活疫苗和增加除菌过滤工艺后生产的18 批冻干甲型肝炎减毒活疫苗进行质量研究。首先,按照企业注册标准的要求对所有批次产品进行全项检测,分析除菌过滤工艺对产品质量的影响,结果显示,所有批次产品的质量均符合企业注册标准的要求,除菌过滤前后产品稳定性良好。
病毒感染性滴度是评价HAV 疫苗质量和有效期的关键指标[16],因此,通过对增加除菌过滤工艺前后产品的病毒感染性滴度、热稳定性的检测结果进行独立样本t 检验,以研究除菌过滤工艺对疫苗有效物质的影响。结果显示,除菌过滤前后产品的病毒感染性滴度、热稳定性检测结差异无统计学意义(P 均 >0.05),表明增加除菌过滤工艺对冻干甲型肝炎减毒活疫苗有效物质含量无影响。
另外,本研究进一步探讨了增加除菌过滤工艺对残留物质去除效果的影响,分别对增加除菌过滤工艺前后的牛血清白蛋白残留量、抗生素残留量和三氯甲烷残留量进行独立样本t 检验,结果显示,增加除菌过滤工艺前后产品的牛血清白蛋白残留量、抗生素残留量和三氯甲烷残留量差异无统计学意义(P均> 0.05)。牛血清白蛋白属于大分子物质,冻干甲型肝炎减毒活疫苗生产过程中,主要通过病毒抽提的过程去除杂蛋白,独立样本t 检验的结果显示,增加除菌过滤工艺前后的牛血清白蛋白残留量无显著差异,也进一步证明了冻干甲型肝炎减毒活疫苗抽提工艺的有效性和稳定性。而病毒抽提过程中,离心后仅吸取上层水相,抽提过程在去除杂蛋白的同时,也有效去除了有机溶剂三氯甲烷,因此,经独立样本t 检验显示增加除菌过滤工艺前后三氯甲烷残留量无显著差异的结果符合产品生产工艺的特点。抗生素主要使用在细胞传代、培养过程中,独立样本t 检验结果也证明了通过清洗细胞表面和病毒抽提的过程能有效去除抗生素残留量。
综上所述,除菌过滤工艺能有效提高产品的无菌保障性,且获批的除菌过滤工艺对冻干甲型肝炎减毒活疫苗产品质量无影响。在今后的生产和检验过程中,我们还将继续关注增加除菌过滤工艺后冻干甲型肝炎减毒活疫苗的质量以及稳定性考察结果[17],确保生产出安全、有效、符合既定用途的疫苗产品。

