新型冠状病毒抗体水平检测方法的比较
杜丽芳,侯亚楠,雷泽华,袁润余,梁宇,韩子泊,唐芳,李启明
1.国药中生生物技术研究院,北京101111;2.广东省疾病预防控制中心,广东广州511430
新型冠状病毒是β 属冠状病毒,为单股正链RNA 病毒,有包膜,颗粒呈圆形或椭圆形,直径60 ~140 nm,人群普遍易感,主要经呼吸道飞沫和密切接触传播,污染物品及气溶胶也具有传播风险。多数患者预后良好,少数患者病情危重甚至死亡,多见于老人、有慢性基础疾病人群、晚期妊娠和围产期女性、肥胖人群[1-4]。新型冠状病毒自发现以来迅速在全球蔓延,并在全球范围内持续流行。WHO 官网显示,截至2021 年11 月12 日,全球共有251 788 329人确诊为新型冠状病毒肺炎,其中有5 077 909 人死亡[5]。
新型冠状病毒感染人体的关键在于S 蛋白与血管紧张素转换酶2(angiotensin converting enzyme 2 ACE2)蛋白的结合。两者结合后,存在于宿主细胞表面的Ⅱ型跨膜丝氨酸蛋白酶(transmembrane protease serine 2,TMPRSS2)清除 ACE2 并激活 S 蛋白,S 蛋白的激活导致构象改变,并允许病毒进入宿主细胞。细胞膜上的外肽酶TMPRSS2 和细胞内的组织蛋白酶 cathepsin B / L 将 S 蛋白的 S1 / S2 切开[6]。因此S 蛋白是病毒进入的主要决定因素,也是药物治疗、疫苗研发的重要靶点[7]。
本研究利用中国仓鼠卵巢(CHO)细胞重组表达新型冠状病毒S 蛋白受体结合区(RBD)蛋白制备的重组新型冠状病毒疫苗,免疫大鼠后,采用不同方法检测大鼠血清中特异性IgG 抗体和中和抗体水平,以分析不同检测方法的相关性和一致性,为疫苗有效性评价提供数据支持。
1 材料与方法
1.1 实验动物 SPF 级 Wistar 大鼠,6 ~ 8 周龄,体重150 ~ 200 g,共40 只,雌雄各半,分笼饲养,购自斯贝福(北京)生物技术有限公司,动物合格证号:110324201102113753。本实验均以科研为目的进行Wistar 大鼠的养殖和使用,且按照《北京市实验动物伦理审查指南》相关规定进行。
1.2 新型冠状病毒假病毒及野病毒 假病毒(包含新型冠状病毒S 蛋白的VSVΔG 病毒)由中国食品药品检定研究院性病与艾滋病室提供,其中S 蛋白基因序列来自Wuhan-Hu-1 毒株(GenBank 序列号:MN908947),报告基因为萤火虫荧光素酶;野病毒由广东省疾病预防控制中心提供,分离自广东省,病毒株编号为2020XN4276 株。
1.3 疫苗及细胞 重组新型冠状病毒疫苗由国药中生生物技术研究院制备并提供;Huh-7 细胞由中国食品药品检定研究院性病与艾滋病室提供;Vero-E6 细胞由广东省疾病预防控制中心提供。
1.4 主要试剂 RBD 蛋白购自北京义翘神州科技股份有限公司(货号:40592-V08B);HRP 标记的山羊抗大鼠IgG 购自北京中杉金桥生物技术有限公司(货号:ZB2305);铝佐剂购自丹麦Croda Denmark(货号:21645-51-2)。
1.5 动物免疫 将Wistar 大鼠分为5 组,每组8 只。1 ~ 3 组免疫剂量分别为 10、20 和 40 μg / 剂,共接种 3 剂(第 0、3、6 周);4 组免疫剂量为 20 μg / 剂,共接种 2 剂(第 0、3 周);5 组为阴性对照组,接种 3剂铝佐剂。均经肌肉注射,0.5 mL / 只(双侧后腿各0.25 mL),免疫1 周后经尾静脉采血,分离血清,每周1 次,共7 次。检测特异性IgG 抗体和中和抗体水平,共检测280 份血清样本。
1.6 特异性IgG 抗体水平检测 采用ELISA 法。将RBD 蛋白稀释至 1 μg /mL,包被酶标板,100 μL /孔,2 ~8 ℃孵育10 ~ 12 h;用含20%牛血清的稀释液封闭2 h;免疫血清进行系列稀释(初始稀释度为1 ∶100)后加至酶标板中,100 μL / 孔,37 ℃孵育 1 h;洗板,加入HRP 标记的山羊抗大鼠IgG(1 ∶10 000稀释),100 μL / 孔,37 ℃孵育 1 h;洗板,显色并读取吸光度值(A450/630)。特异性IgG 抗体效价为 ≥ cutoff 值的血清最高稀释度的倒数。
1.7 中和抗体水平检测
1.7.1 假病毒微量中和试验 将待测血清样本进行系列稀释(初始稀释度为 1 ∶40),取 50 μL 稀释后血清与50 μL 新型冠状病毒假病毒[工作浓度为(1 ~ 2)× 104TCID50/ m L]混合,37 ℃孵育 1 h;将Huh-7 细胞悬液(2 × 105个 / mL)加至含有血清和假病毒混合液的 96 孔培养板中,100 μL / 孔,同时设空白对照(不含假病毒)和阴性对照(含假病毒),37 ℃培养20 ~ 28 h。根据各孔RLU 值,采用Reed-Muench 法计算50%感染抑制率时血清稀释倍数,即为该血清样品的中和抗体滴度。
1.7.2 野病毒微量中和试验 该试验在广东省疾病预防控制中心BSL-3 级实验室完成。将待测血清样本进行系列稀释(初始稀释度为 1 ∶40),取 60 μL 稀释后血清与60 μL 新型冠状病毒野病毒(2 × 103TCID50/mL)混合,37 ℃孵育2 h;取 100 μL 血清与野病毒的混合液加至含 Vero-E6 细胞(2 × 105个 / mL)的 96 孔细胞培养板中,同时设空白对照(不含野病毒)和阴性对照(含野病毒),37 ℃培养5 ~7 d。观察细胞病变情况,采用Karber 法计算50%感染抑制率时血清稀释倍数,即为该血清样品的中和抗体滴度。
1.8 统计学分析 应用SPSS 20.0 软件进行统计学分析。采用Spearman 秩相关对3 种方法进行相关性分析,采用kappa 检验对3 种方法进行一致性分析(kappa ≥ 0.75,两者一致性好;0.75>kappa ≥ 0.4,两者一致性一般;kappa < 0.4,两者一致性较差)。以P < 0.05 为差异有统计学意义。
2 结 果
2.1 相关性分析 ELISA 法与假病毒微量中和试验、野病毒微量中和试验检测结果的相关性均良好(rs分别为 0.926 和 0.884,P < 0.05),假病毒微量中和试验与野病毒微量中和试验检测结果的相关性也良好(rs= 0.925,P < 0.05),见图 1。将各组检测结果分别进行相关性分析,结果显示,各组内不同检测方法的相关性均良好(rs> 0.750,P <0.05),见表1。表明不同方法检测结果均具有良好的相关性。

图1 不同检测方法检测结果的相关性分析Fig.1 Correlation of determination results by different methods

表1 各组内不同检测方法的相关性分析Tab.1 Correlation of determination results by different methods in various groups
2.2 一致性分析 ELISA 法与假病毒微量中和试验检测结果的一致性分析kappa 值为0.899,总符合率为95.71%;ELISA 法与野病毒微量中和试验检测结果的一致性分析kappa 值为0.759,总符合率为88.93%;假病毒微量中和试验与野病毒微量中和试验检测结果的一致性分析kappa 值为0.824,总符合率为91.79%,见表2 ~ 4。表明不同方法检测结果的一致性均较好。对3 种方法不同采血时间样品的检测结果进行一致性分析,结果显示,不同方法一致性程度与采血时间点有一定相关性,见表5。
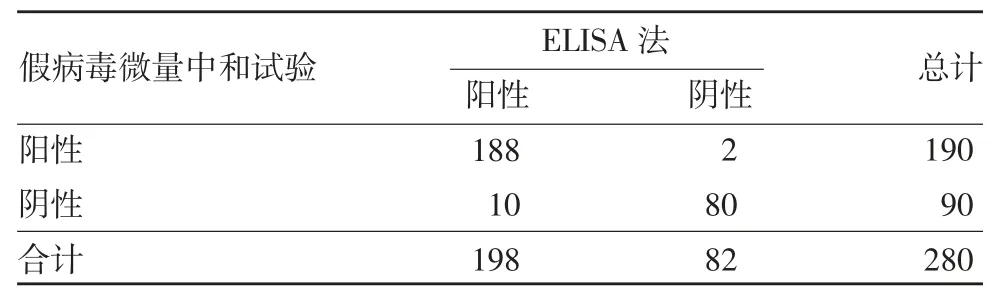
表2 假病毒微量中和试验与ELISA 法检测结果的一致性分析(例数)Tab.2 Consistency of determination results by pseudovirus neutralization test and ELISA(number of cases)
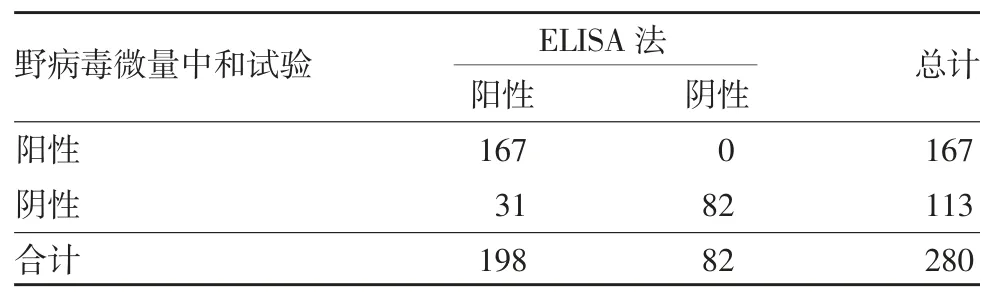
表3 野病毒微量中和试验与ELISA 法检测结果的一致性分析(例数)Tab.3 Consistency of determination results by wild virus neutralization test and ELISA(number of cases)
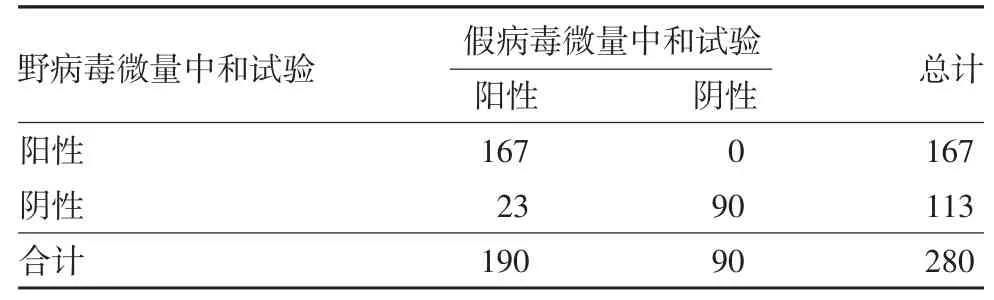
表4 野病毒微量中和试验与假病毒微量中和试验检测结果的一致性分析(例数)Tab.4 Consistency of determination results by wild virus neutralization test and pseudovirus neutralization test (number of cases)

表5 不同方法检测不同采血时间点样本的一致性分析Tab.5 Consistency of determination results of samples determined by different methods at different time points
3 讨 论
为应对新型冠状病毒肺炎大流行,全球出台了多项疫情防控措施并积极组织开展疫苗研发,病毒基因序列的公布更加快了新型冠状病毒疫苗的研发速度。截至2021 年11 月16 日,全球共计194 个新型冠状病毒疫苗处于临床前研究阶段,132 个新型冠状病毒疫苗正在进行临床研究,8 个新型冠状病毒疫苗获得紧急使用授权[8]。新型冠状病毒的中和抗体是建立保护性免疫的关键,因此,疫苗的免疫原性分析,尤其是中和抗体分析,对于疫苗效力评价非常重要[9]。
在不同种类新型冠状病毒疫苗临床研究中,特异性IgG 抗体和中和抗体水平检测均是疫苗免疫原性评价的主要指标[10-12]。其中特异性IgG 抗体检测靶标主要针对S 蛋白或N 蛋白[13],中和抗体检测主要采用假病毒或野病毒中和试验。
野病毒噬斑减少中和试验是检测中和抗体的金标准,但对于新型冠状病毒中和抗体的检测,其不仅检测通量低,耗时长,且需在BSL-3 级实验室完成。假病毒微量中和试验可弥补野病毒微量中和试验环境及设备的限制,在BSL-2 级实验室完成,且耗时短[9]。临床上基于抗原抗体结合原理的检测方法有化学发光法、ELISA 法和免疫荧光法等,其中ELISA法是经典的血清学检测方法,由于其检测成本低,耗时短,检测通量相对较大,适合用于产品开发阶段的抗体评价[13]。
本研究将重组新型冠状病毒疫苗免疫大鼠,采用ELISA 法、假病毒微量中和试验和野病毒微量中和试验检测大鼠血清特异性IgG 抗体和中和抗体水平,结果显示,不同方法检测结果的相关性和一致性良好,这对新型冠状病毒疫苗的早期研究具有重要指导意义。相比较而言,ELISA 法与野病毒微量中和试验检测结果的相关性、一致性相对较低,分析其原因为:①不同方法的检测灵敏度存在差异,部分IgG抗体结合的抗原表位非中和表位[14-15];②与抗体亲和力有关。检测结果不一致样本多为初次免疫后1或2 周的血清样本,此时还未完成抗体亲和力成熟的过程,因此抗体亲和力及中和活性相对较低[16]。
综上所述,特异性IgG 抗体和中和抗体均是反映保护效果的重要指标,针对新型冠状病毒中和抗体是建立保护性免疫的关键,因此在不具备BSL-3级实验室的条件下,3 种检测方法的相关性对于疫苗的早期研发及概念性验证阶段具有重要指示意义。
志谢感谢中国食品药品检定研究院性病与艾滋病室在假病毒中和试验中提供的帮助

