基质辅助激光解吸电离飞行时间质谱技术在13 价肺炎球菌多糖蛋白结合疫苗生产用菌种质量控制中的作用
张丽芝,李阿妮,张新庄,程新,白贵杰,任克明,郑明睿,罗树权
兰州生物制品研究所有限责任公司第一研究室甘肃省疫苗工程技术研究中心,甘肃兰州730046
肺炎链球菌(Streptococcus pneumoniae)简称肺炎球菌,是一种具有荚膜的革兰阳性菌,主要引起社区获得性肺炎、中耳炎、脑膜炎及败血症等疾病。目前已有采用肺炎球菌荚膜多糖制备的23 价肺炎球菌荚膜多糖疫苗和13 价肺炎球菌多糖蛋白结合疫苗上市,可有效防御肺炎球菌对成人和婴幼儿造成的感染。
《中国药典》三部(2020 版)中对肺炎球菌检定技术主要包括培养特性、镜检、生化反应、玻片凝集反应[1]。基质辅助激光解吸电离飞行时间质谱(matrixassisted laser desorption / ionization time of flight mass spectrometry,MALDI-TOF MS)技术主要原理是利用基质与细菌细胞内的蛋白质形成结晶,激光照射结晶体,使其快速爆炸性蒸发,基质与标本间发生电荷转移使菌体蛋白质离子化并带入气相介质;带电离子在电场作用下,沿着高真空的飞行管道飞行,质荷比越小,到达检测器所需时间就越短,从而区分不同的带电离子,并获得该细菌的全蛋白组图谱,如MALDITOF MS 技术可区分鉴定肺炎球菌与假性肺炎球菌(如口腔链球菌)[2],该技术具有高通量、高重现性,快速的特点[3-4],已在临床微生物的鉴定中广泛使用[5-7]。MALDI-TOF MS 技术还可用于细菌分型及血清学分型方面,如区分肠道沙门菌属主要的血清型等[8];可用于耐药株和敏感株的快速鉴定,如区分鉴别耐万古霉素肠菌株[9];可用于细菌进化和相似度的分析[10]。研究表明,MALDI-TOF MS 技术对曲霉种水平的鉴定准确率可达95%,对非曲霉丝状真菌的鉴定准确率仅为57.7%[11-12]。本研究采用MALDI-TOF MS 技术对13 价肺炎球菌多糖蛋白结合疫苗生产用菌种进行血清分型,探讨该技术在疫苗生产用菌种质量控制中的作用。
1 材料与方法
1.1 菌种 1 型肺炎球菌(Streptococcus pneumoniae serotype1,FL1)、FL3、FL4、FL5(批号分别为 FL5-2009、FL5-2010、FL5-2014、FL5-2016、FL5-2019、FL5-202005、FL5-202007)、FL6A、FL6B、FL7F、FL9V、FL14(批号分别为 FL14-0303、FL14-0606)、FL18C、FL19A、FL19F、FL23F 工作菌种保存于 2 ~ 8 ℃,FL5 主代菌种(FL5ZD)保存于-60 ℃以下,均购自中国医学细菌保藏管理中心,为血清型明确的标准菌株,由兰州生物制品研究所有限责任公司第一研究室制备;FL5丹麦菌种(FLdm2014)及北京儿科医院菌种(FLek41 和FLek85)分别由丹麦血清研究所和北京儿科医院惠赠。
1.2 主要试剂及仪器 肺炎球菌血清型分型鉴定用血清购自丹麦血清研究所;色谱纯甲酸和乙腈购自美国Sigma 公司;无水乙醇购自中国国药集团化学试剂公司;哥伦比亚血琼脂购自广州迪景生物科技有限公司;HCCA 基质和基质辅助激光解吸电离飞行时间质谱仪购自德国Bruker 公司。
1.3 菌种经典表型的鉴定 将13 种血清型肺炎球菌菌种(共24 株)分别无菌接种至哥伦比亚血琼脂平皿,于35 ~ 37 ℃,5% ~ 10% CO2环境中培养12 ~20 h,观察细菌培养特性。取肺炎球菌的新鲜培养物,按《中国药典》三部(2020 版)中规定的方法分别进行镜检、糖发酵生化反应、胆汁溶菌试验、奥卜托欣试验、血清凝集反应检测[1]。同时进行荚膜肿胀试验,取培养皿中菌种的新鲜培养物,用生理盐水制成菌悬液,A600=0.2~0.5 时,取 5 μL,滴于载玻片上,加入5 μL 相同血清型别的血清抗体;吸取5 μL 美兰染液进行染色,盖盖玻片,置湿盒中30 min,显微镜下观察。
1.4 肺炎球菌的质谱鉴定 取肺炎球菌的新鲜培养物,用100 μL 纯净水调制成4 个麦氏单位的菌悬液,再加入300 μL 无水乙醇,混匀,制成灭活的菌悬液,-20 ℃保存。取1 μL 菌悬液点靶板上,室温晾干后,添加1 μL HCCA 基质液敷于样本之上,晾干后,上样基质辅助激光解吸电离飞行时间质谱仪,用MALDI Biotyper 软件自带数据库(Compass 2019 版)进行质谱鉴定,得分<1.700 则表示检测结果不可信;得分为1.700 ~ 1.799 表示可能鉴定到细菌属水平;得分为2.000~2.299 表示非常可靠鉴定到细菌属的水平,可能到细菌种水平;得分为2.300~3.000为高度可能性鉴定到细菌种水平。
1.5 指纹图谱数据库的建立 取100 μL 上述菌悬液,8 000 × g 离心 2 min,收集菌体,添加 50 μL 70%甲酸,混匀,再添加 50 μL 乙腈,混匀,8 000 × g离心2 min,取1 μL 上清液,点样于靶板上,每个样品平行设4 个点,另于其他孔点样 1 μL BTS,用于仪器的校准,于室温下晾干;添加 1 μL HCCA 基质液敷于样本之上,室温晾干,插入基质辅助激光解吸电离飞行时间质谱仪进行分析。每个样品孔位采集3 张质谱图,每个样品共采集12 张谱图。通过MALDI Biotyper 软件进行谱图数据库的建立,再自建24 株肺炎球菌数据库,将自带库和自建库的合并数据库进行搜库鉴定,并根据质谱图的相似性进行聚类分析,同时生成聚类分析树状图。
1.6 不同批次FL14 的比较 将批号为FL14-0303、FL14-0606 的2 批FL14 工作菌种按1.3 项方法进行荚膜肿胀试验,按1.5 项方法建立蛋白指纹谱图,并进行比较。
1.7 不同来源FL5 菌种的比较 按1.5 项方法建立 FL5 工作菌种(FL-202005)、不同来源 FL5(丹麦菌种FLdm2014 及北京儿科医院菌种FLek41 和FLek85)的蛋白指纹图谱,并进行比较。
1.8 FL5 菌种保存稳定性的检测 按1.5 项方法建立FL5 的主代菌种(FL5ZD)、不同批次的FL5 工作菌种(FL5-2009、FL5-2010、FL5-2014、FL5-2016、FL5-2019、FL5-202005、FL5-202007)、FL5 丹麦菌种(FLdm2014)及北京儿科医院菌种(FLek41 和FLek85)的蛋白指纹图谱,应用MALDI Biotyper 软件进行聚类分析。
2 结 果
2.1 菌种经典表型特性 13 种血清型肺炎球菌(24株)的新鲜培养物均为灰白色、表面光滑湿润的圆形菌落,且具有α-溶血现象;均为革兰阳性球菌,见图1;均有荚膜,见图2;均可发酵葡萄糖、乳糖、棉子糖、蜜二糖,不发酵甘露醇,见图3;均能被10%脱氧胆酸钠溶解,见图4;放入奥卜托欣纸片后均能出现抑菌圈,直径为14 ~ 16 mm,见图5;与相应的肺炎球菌分型血清均能产生抗原抗体复合物,见图6。
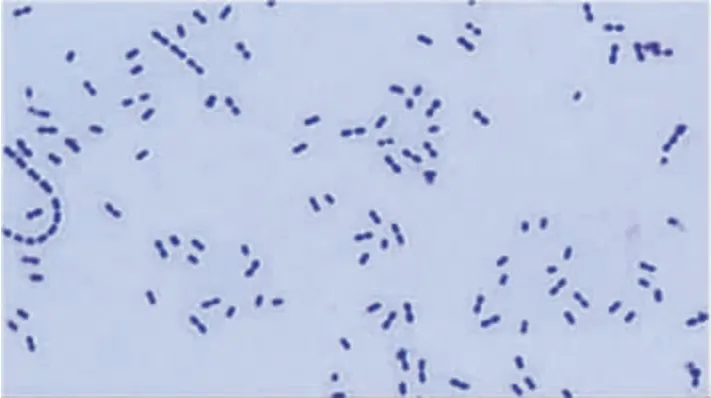
图1 肺炎球菌革兰染色图(× 100)Fig.1 Gram staining of Streptococcus pneumoniae(× 100)

图2 肺炎球菌荚膜肿胀试验(× 100)Fig.2 Swelling test of Streptococcus pneumonia(× 100)

图3 肺炎球菌糖发酵生化反应Fig.3 Sugar fermentation test of Streptococcus pneumoniae

图4 肺炎球菌胆汁溶菌试验Fig.4 Bile lysis test of Streptococcus pneumoniae

图5 肺炎球菌奥卜托欣抑菌试验Fig.5 Obtosin antibacterial test of Streptococcus pneumoniae

图6 肺炎球菌的血清凝集试验Fig.6 Slide agglutination test of Streptococcus pneumonia
2.2 肺炎球菌的质谱鉴定 13 种血清型肺炎球菌(共24 株)均鉴定为肺炎球菌,其中自带库鉴定得分>2.0 能非常可靠鉴定至链球菌种水平的有21 株,鉴定至链球菌属水平的为3 株;自带库和自建库合并数据库鉴定13 种血清型肺炎球菌(共24 株)与自建库录入时对应血清型相符。见表1。不同血清型蛋白指纹谱的质谱峰的位移不同或缺失,见图7。13 种血清型肺炎球菌(共24 株)得出聚类分为3 大类,见图8。结果表明,不同血清型肺炎球菌蛋白指纹图谱虽有差异,但MALDI-TOF MS 技术仍不能依据这些质谱峰的不同按血清型进行聚类。
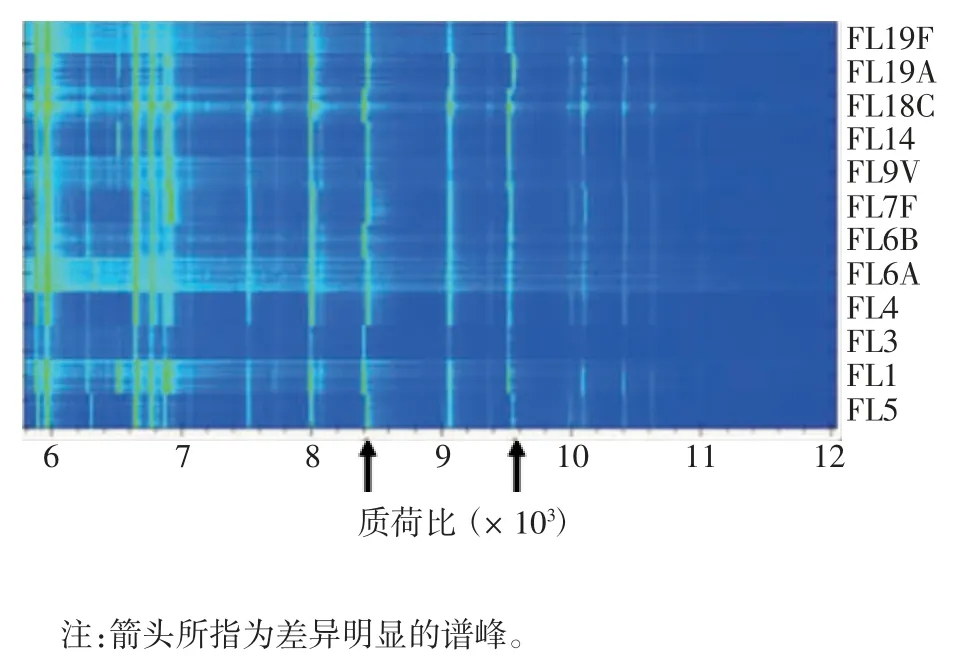
图7 13 种血清型肺炎球菌蛋白指纹图谱Fig.7 Protein fingerprints of 13 serotypes of Streptococcus pneumonia

图8 13 种血清型肺炎球菌蛋白指纹谱图的聚类分析Fig.8 Cluster analysis of protein fingerprints of 13 serotypes of Streptococcus pneumonia
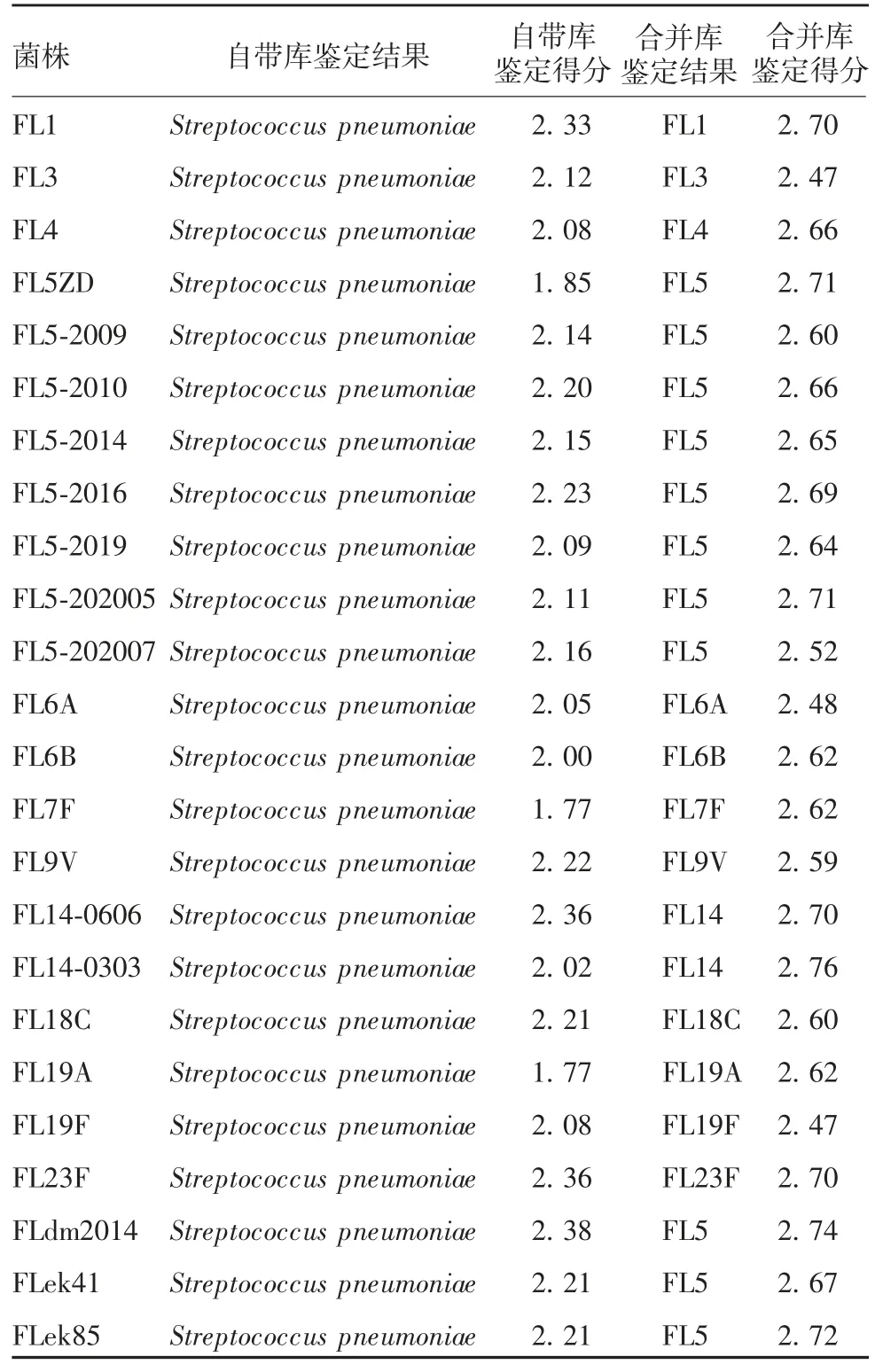
表1 13 个血清型肺炎球菌菌种的鉴定结果Tab.1 Identification of 13 serotypes of Streptococcus pneumonia strains
2.3 不同批次FL14 的比较 FL14-0606 批肺炎球菌均有明显荚膜,FL14-0303 批既有荚膜退化菌,也有正常荚膜菌,见图9,表明两批FL14 具有不同的荚膜丰度。两批FL14 的蛋白指纹谱图基本一致,见图10,表明不同荚膜丰度的相同血清型肺炎球菌的蛋白指纹图谱差异较小。

图9 两批FL14 的荚膜肿胀试验(× 100)Fig.9 Capsular swelling test of two FL14 batches(× 100)

图10 两批FL14 的蛋白指纹图谱Fig.10 Protein fingerprints of FL14 of two batches
2.4 不同来源FL5 菌种的比较 FL5 北京儿科医院菌种及FL5 工作菌种(FL-202005)质谱峰较一致,但FL5 丹麦菌种有多个峰的位移不同,见图11。表明相同血清型不同来源肺炎球菌的蛋白指纹图谱不同,MALDI-TOF MS 技术能够进行区分鉴定。

图11 不同来源FL5 菌种的蛋白指纹图谱Fig.11 Protein fingerprints of FL5 from different origins
2.5 FL5 菌种保存稳定性 与FL5 北京儿科医院菌种(FLek41 和 FLek85)比较,FL5 主代菌种及不同批次的 FL5 工作菌种(FL5-2009、FL5-2010、FL5-2014、FL5-2016、FL5-2019、FL5-202005、FL5-202007)为 同一聚类,与丹麦菌种(FLdm2014)为不同聚类,见图12。表明不同批次的疫苗用FL5 工作菌种的蛋白指纹图谱基本一致,各批菌种保存稳定性良好。

图12 不同批次FL5 工作菌种的聚类分析图(× 100)Fig.12 Cluster analysis of working strains of FL5 of different batches(× 100)
3 讨 论
目前,《中国药典 》三部(2020 版)[1]中主要通过经典细菌表型鉴定技术进行肺炎球菌疫苗用菌种检定,简便易行,但鉴定结果多以主观判断为主,易产生误差。本实验结果表明,13 型肺炎菌种(24 株)均满足经典细菌表型鉴定的要求,但细菌表型鉴定方法本身分辨率较低,不易于获得更多菌种的质量信息。
MALDI-TOF MS 技术主要反映微生物核糖体蛋白信息,蛋白是生命活动的主要承担者,其差异性主要体现为微生物的表现型[13]。本实验在经典细菌表型鉴定结果正确的前提下,探讨MALDI-TOF MS技术对疫苗用肺炎菌种质量控制中的作用,结果表明,MALDI-TOF MS 技术可正确鉴定肺炎球菌的菌种,不同血清型肺炎球菌蛋白指纹图谱存在差异,聚类分析为3 大类,表明该技术不能完全依照血清型别的不同进行分类。肺炎球菌主要依据荚膜多糖的差异分成不同的血清型及血清亚型,MALDI-TOF MS 技术主要是针对细菌蛋白质进行分析,不能检测荚膜多糖,因此MALDI-TOF MS 技术能够检测肺炎球菌血清型的差异,可能与细菌中血清型差异相关的管家蛋白不同[14]或与荚膜多糖的合成过程需要荚膜多糖合成酶系统的不同有关。NAKANO 等[14]采用MALDI-TOF MS 技术成功鉴别区分出日本主要流行的10 种肺炎球菌血清型,并认为通过收集更多的肺炎菌株及充实每种肺炎血清型的数据库,可能会提高MALDI-TOF MS 技术对肺炎血清型水平检定的性能。PINTO 等[15]采用 MALDI-TOF MS 技术对 416株临床分离肺炎菌株进行血清型分型鉴定,可快速,高通量鉴定出肺炎球菌,在肺炎球菌血清分型检测中具有良好的应用前景。
荚膜多糖是肺炎球菌的主要毒力因子,也是肺炎球菌多糖疫苗、肺炎球菌多糖蛋白结合疫苗的主要成分。在肺炎球菌的长时间保存中,有时会出现荚膜衰退菌种,表现为荚膜肿胀试验中存在无荚膜菌,严重影响相应疫苗的质量,因此筛选荚膜丰度好的菌种是工作菌种质控的关键。实验室一般通过荚膜肿胀试验检测肺炎菌种的荚膜丰度,结果判断受主观影响较大,不利于质控。本研究采用MALDI-TOF MS 技术检测相同血清型不同荚膜丰度肺炎球菌的质谱图,结果显示,两种荚膜丰度肺炎球菌的质谱图无区别,表明该方法对肺炎球菌荚膜丰度的分辨率较低。
本实验采用MALDI-TOF MS 技术对不同来源的FL5 的工作菌种、丹麦菌种、北京儿科医院菌种进行检定,结果显示,不同来源FL5 菌种的蛋白指纹图谱存在有差异,表明不同的环境选择压力会使相同血清型的肺炎菌种产生不同的蛋白表达,该技术可区分鉴定不同地域的肺炎球菌菌种。同时,本实验采用MALDI-TOF-MS 技术对FL5 主代菌种及不同批次的工作菌种进行聚类分析,结果显示,FL5 主代菌种及多批工作菌种的指纹图谱基本一致,聚类分析为一类,表明菌种制备的冻干过程并不会对肺炎球菌的核糖体蛋白产生影响。实验结果还表明,不同批次的FL5 工作菌种均为一个聚类,表明疫苗用肺炎球菌主代菌种与工作菌种在长时间的低温保存中的稳定性良好。
综上所述,MALDI-TOF MS 技术可区分不同地域来源的相同血清型肺炎球菌,借助蛋白谱聚类分析可判断菌种核糖体蛋白的一致性,可用于观察肺炎球菌疫苗用菌种的稳定性,提供更多菌种信息,并具有快速、客观、准确、高通量、重复性好等优点。因此,MALDI-TOF MS 技术可作为肺炎血清分型检定的一种辅助方法,可用于疫苗用工作菌种的质量控制,尤其是疫苗的研发阶段,建立工作菌种的质谱数据库,收集菌种的相关数据,为长期保存的菌种留存蛋白指纹谱信息,为菌种的稳定性及质量控制提供更多信息及依据。

