miR-124 对缺氧/复氧诱导的心肌细胞凋亡的影响
杨璐瑜,陆辉志,廖友霞,谭赟,董辉,付守芝
武汉市第三医院重症医学科,湖北武汉430074
急性心肌梗死(acute myocardial infarction,AMI)是常见的急危重症之一,其发病率及致死率居高不下[1]。近年来,再灌注治疗手段已成为抢救AMI 患者最有效的措施,可显著改善患者预后[2]。但再灌注治疗易引起心肌缺血再灌注(ischemia reperfusion,I / R)损伤。心肌 I / R 损伤是指缺血心肌的血液供应重新恢复后,心肌组织的损伤反而加重的现象。其中,心肌I / R 损伤诱导的心肌细胞凋亡是导致心肌梗死面积增大及心功能障碍的重要因素[3],因此,研究心肌细胞凋亡的机制将为该病的防治提供新的思路。微小RNA(microRNA,miR)是在真核生物中发现的一类内源性的具有调控功能的高度保守的非编码小RNA。目前已有多种miR 被证实参与心肌 I/R 损伤的病理过程,包括 miR-1、miR-29、miR-499 等[4-6],但关于 miR-124 在心肌 I / R 损伤中的调控作用尚无报道。本研究利用缺氧 / 复氧(hypoxia / reoxygenation,H / R)干预大鼠心肌细胞 H9c2以模拟心肌I / R 损伤,旨在探讨miR-124 在心肌细胞I / R 损伤中的作用及其机制。
1 材料与方法
1.1 细胞及质粒 大鼠H9c2 心肌细胞系、HEK293细胞系购自中国科学院上海细胞中心;psi-CHECK2荧光素酶报告基因质粒由武汉福因德生物科技有限公司设计并提供。
1.2 主要试剂及仪器 Annexin V-FITC 细胞凋亡检测试剂盒、双荧光素酶报告基因检测试剂盒购自上海碧云天生物技术有限公司;LipofectamineTM2000试剂、SYBR Green qPCR 试剂盒、PVDE 膜购自美国Invitrogen 公司;胰酶、胎牛血清(BSA)及高糖DMEM购自美国 GIBCO 公司;兔抗人 STAT3、Caspase-3、Bax多克隆抗体购自美国Cell Signaling Technology 公司;羊抗兔IgG-HRP 购自武汉博士德生物工程有限公司;STAT3 蛋白抑制剂Stattic 购自英国Abcam 公司;miR-124 抑制剂(siRNA)、miR-124 mimic 由武汉福因德生物科技有限公司设计并提供;实时荧光定量PCR 仪购自美国Applied Biosystems 公司;流式细胞仪购自美国BD 公司;多功能酶标仪购自美国Molecular Devices 公司;细胞培养箱购自美国Thermo Fisher Scientific 公司。
1.3 miR-124 靶基因位点的预测 基于靶基因3′-UTR位点与 miR 同源序列,通过检索 TargetScan(http:/ /www.targetscan.org / vert_72)在线网站,预测与 miR-124 结合的靶基因位点。
1.4 细胞培养及传代 将大鼠H9c2 心肌细胞系或HEK293 细胞系置于含15% BSA 的高糖DMEM 培养基中,于 37 ℃,5% CO2培养箱中培养,每 3 d 换液1 次。当细胞生长至85%融合时,胰酶消化,根据后续试验需要,以相应密度接种于培养瓶或细胞培养板中。
1.5 荧光素酶活性的检测 采用双荧光酶素报告试验检测各组细胞的荧光素酶活性,以反映WT 和Mut STAT3 3′-UTR 序列与 miR-124 的结合情况。将含有miR-124 结合位点的野生型(WT)和突变型(Mut)的 STAT3 3′-UTR 基因序列分别构建至 psi-CHECK2 荧光素酶报告基因质粒中。试验分为4 组:携带 WT STAT3 报告基因组(WT Mimic 组)、WT 阴性对照组(WT NC 组)、携带 Mut STAT3 报告基因组(Mut Mimic 组)和 Mut 阴性对照组(Mut NC 组)。将对数生长期的HEK293 细胞接种至24 孔板,进行重组质粒与miR-124 mimic 的共转染,具体操作按LipofectamineTM2000 试剂说明书进行。转染后2 d收集细胞,利用双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
1.6 心肌细胞H/R 模型的建立及分组 将H9c2 细胞接种至24 孔板后置培养箱中,持续通入95% N2+5% CO2的混合气体24 h,以模拟缺氧状态。吸出原培养基,加入新配制的含15%BSA 的高糖DMEM 液,置37 ℃,5% CO2培养箱复氧6 h,构建心肌细胞H /R 模型。试验分为 4 组:正常心肌细胞组、H / R 模型组、H / R 模型 + miR-124 抑制剂组(即在缺氧前48 h 于培养基中加入 50 nmol / L 的 miR-124 抑制剂)和 H / R 模型 + miR-124 抑制剂 + Stattic 组(即在缺氧前48 h 于培养基中加入50 nmol / L 的miR-124 抑制剂及 2 μmol / L 的 Stattic)。
1.7 H/R 心肌细胞模型中miR-124 靶基因STAT3表达水平的检测 采用Western blot 法。收集上述各组细胞,加入 400 μL RIPA 裂解液,12 000 × g 离心10 min,收集上清,用BCA 试剂盒进行总蛋白定量,并采用RIPA 裂解液及Loading Buffer 调整各组细胞蛋白浓度至同一水平。经10% SDS-PAGE 分离、转膜,脱脂奶粉室温封闭1 h;加入兔抗人STAT3 多克隆抗体(1 ∶1 000 稀释),4 ℃过夜;加入羊抗兔IgGHRP(1 ∶5 000 稀释),室温孵育 30 min;TBST 洗涤 3次,ECL 化学发光法使条带显影,采用Image-Pro Plus软件对蛋白表达水平进行量化,以GAPDH 作为内参,计算蛋白的相对表达量。
1.8 H/R 心肌细胞模型中miR-124 mRNA 表达的检测 采用实时荧光定量PCR 法。收集上述各组细胞,采用Trizol 法提取细胞总RNA,逆转录合成cDNA,以其为模板,按SYBR Green qPCR 试剂盒说明书,在ABI 7500 PCR 仪上进行荧光定量PCR。miR-124 上游引物序列:5′-CTTAGTCTCTGTATGACGT-3′,下游引物序列:5′-TCACCCAGCTTGAGTCGA-3′;U6 snRNA 上游引物序列:5′-CGCTTCGGCAGCACATATAC-3′,下游引物序列:5′-TTCACGAATTTGCGTGTCAT-3′。引物由武汉福因德生物科技有限公司设计并合成。PCR 反应条件:95 ℃预变性 10 min;95 ℃10 s,60 ℃ 45 s,72 ℃ 30 s,共 35 个循环。以 U6 核小分子 RNA 为内参,miR-124 表达量采用 2-ΔΔCt法计算。
1.9 miR-124 对心肌细胞凋亡影响的检测 采用流式细胞术。用含EDTA 的0.25%胰酶消化并收集各组细胞,PBS 洗涤并离心细胞 2 次(1 000 × g 5 min),收集沉淀,用 500 μL Binding Buffer 重悬,加入 5 μL Annexin V-FITC 和 10 μL PI 染色液,充分混匀,室温避光孵育15 min,具体操作按Annexin V-FITC 细胞凋亡检测试剂盒说明书进行。上流式细胞仪检测早期凋亡率及晚期凋亡率之和。
1.10 miR-124 对促心肌细胞凋亡相关蛋白表达影响的检测 采用Western blot 法,具体操作同1.7项,一抗为兔抗人 Caspase-3 或 Bax 多克隆抗体(1 ∶1 000稀释),二抗为羊抗兔 IgG-HRP(1 ∶5 000 稀释)。
1.11 统计学分析 采用SPSS 21.0 软件进行统计学分析,数据采用表示,多组间均数比较采用单因素方差分析,两组间多重比较采用LSD 检验,以P < 0.05 为差异有统计学意义。
2 结 果
2.1 miR-124 靶基因 TargetScan 分析结果显示,STAT3 是miR-124 的1 个靶基因。见图1。
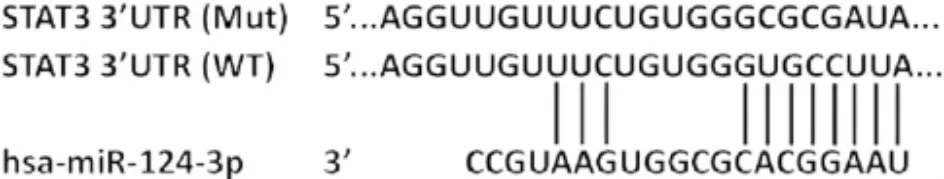
图1 miR-124 靶基因位点的预测Fig.1 Prediction of site of target gene of miR-124
2.2 荧光素酶活性 检测结果显示,与WT NC 组相比,WT Mimic 组细胞荧光素酶活性明显降低(t =13.86,P < 0.05),而 Mut Mimic 组细胞荧光素酶活性较 Mut NC 组无明显变化(t = 0.36,P > 0.05)。见图2。
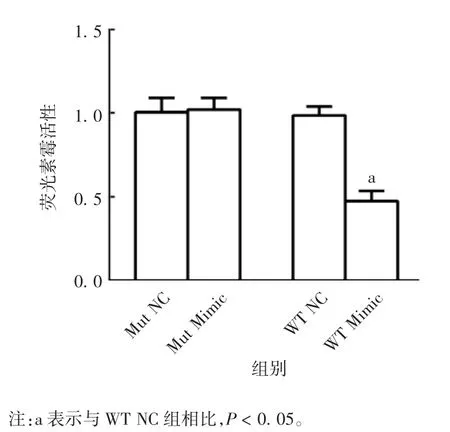
图2 双荧光酶素报告试验检测各组细胞荧光素酶活性Fig.2 Determination of luciferase activity of cardiomyocytes in various groups by dual luciferase reporter assay
2.3 H/R 心肌细胞模型中miR-124 靶基因STAT3的表达水平 Western blot 分析显示,与正常心肌细胞组相比,H / R 模型组心肌细胞 STAT3 蛋白表达水平明显降低(t = 22.88,P < 0.05),而 H / R 模型 +miR-124 抑制剂组无明显差异(t = 1.89,P > 0.05)。见图3 和图4。
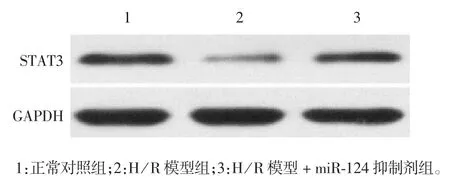
图3 STAT3 蛋白表达水平的Western blot 分析Fig.3 Determination of expression level of STAT3 protein by Western blot

图4 miR-124 靶基因STAT3 的表达水平Fig.4 Expression level of miR-124 target gene STAT3
2.4 H/R 心肌细胞模型中miR-124 mRNA 水平检测结果显示,与正常心肌细胞组相比,H / R 模型组心肌细胞中miR-124 mRNA 水平明显升高(t=10.55,P<0.05);而与 H / R 模型组相比,H / R 模型 +miR-124 抑制剂组心肌细胞中miR-124 mRNA 水平明显降低,但仍高于正常心肌组细胞(t=5.31,P<0.05)。见图5。

图5 H / R 心肌细胞模型中的 miR-124 mRNA 水平Fig.5 The miR-124 mRNA level in H / R model group
2.5 miR-124 对心肌细胞凋亡水平的影响 检测结果显示,与正常心肌细胞组相比,H / R 模型组心肌细胞凋亡水平明显升高(t = 13.56,P < 0.05);而与H / R 模型组相比,H / R 模型 + miR-124 抑制剂组心肌细胞凋亡水平明显降低(t = 7.86,P < 0.05)。与 H / R 模型 + miR-124 抑制剂组相比,H / R 模型 +miR-124 抑制剂+ Stattic 组心肌细胞凋亡水平明显升高(t = 6.37,P < 0.05)。见图 6 和图 7。提示下调miR-124 可能通过增加STAT3 表达来降低心肌细胞的凋亡水平。
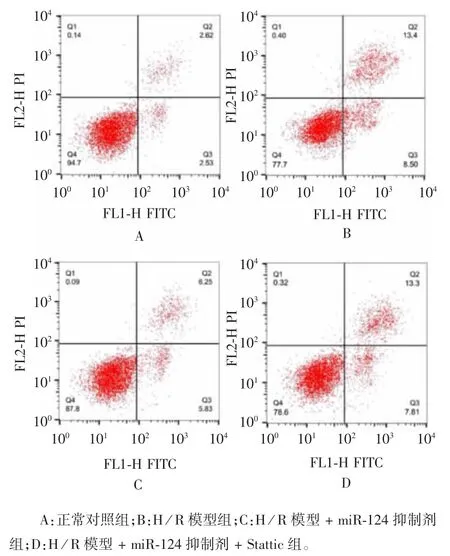
图6 miR-124 诱导大鼠心肌细胞凋亡的流式细胞图Fig.6 Flow cytometry of apoptosis of rat cardiomyocytes induced by miR-124
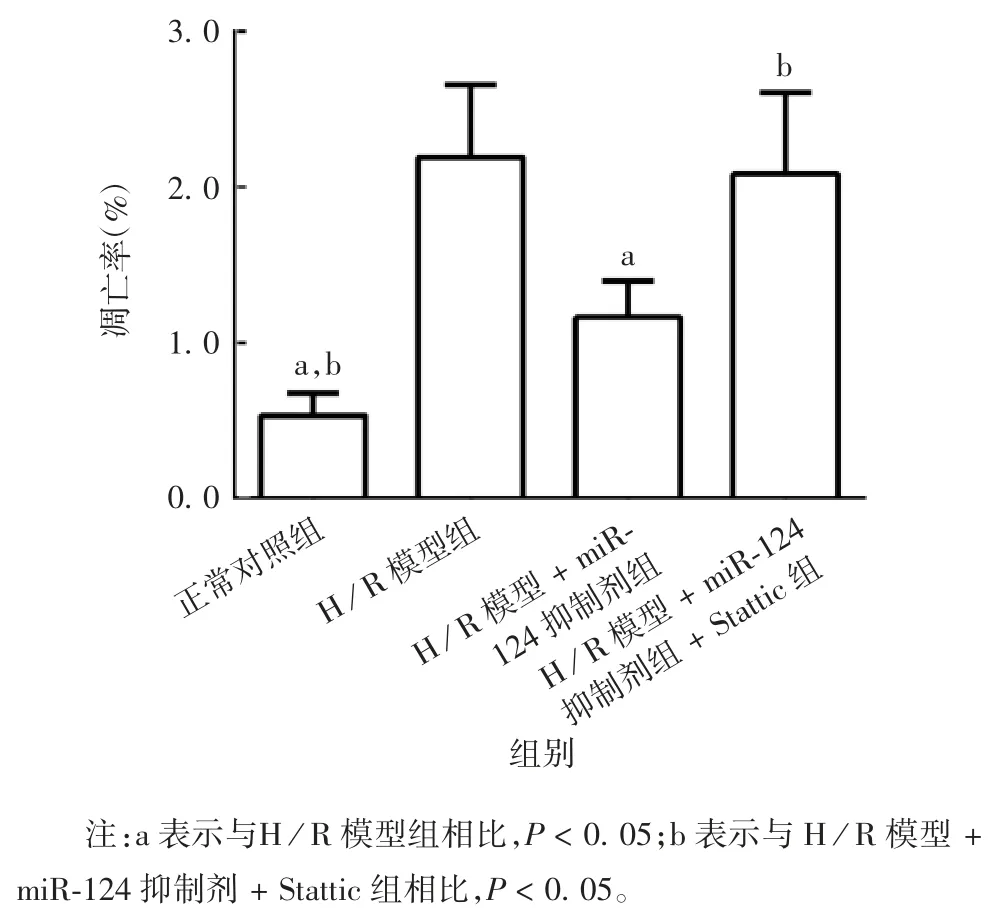
图7 miR-124 对大鼠心肌细胞凋亡水平的影响Fig.7 Effect of miR-124 on apoptosis level of rat cardiomyocytes
2.6 下调miR-124 对促心肌细胞凋亡相关蛋白表达的影响 检测结果显示,与正常心肌细胞组相比,H / R 模型组心肌细胞 Caspase-3、Bax 蛋白表达水平明显增加(t 分别为 19.46 和 8.78,P < 0.05);而与H / R 模型组相比,H / R 模型 + miR-124 抑制剂组心肌细胞Caspase-3、Bax 蛋白表达水平明显降低(t 分别为 18.30 和 9.47,P<0.05)。与 H /R 模型 +miR-124 抑制剂组相比,H / R 模型 + miR-124 抑制剂 +Stattic 组心肌细胞Caspase-3、Bax 蛋白表达水平明显升高(t 分别为 22.11 和 12.05,P < 0.05)。见图 8和图9。提示下调miR-124 可能通过增加STAT3 表达降低促心肌细胞凋亡相关蛋白的表达水平。
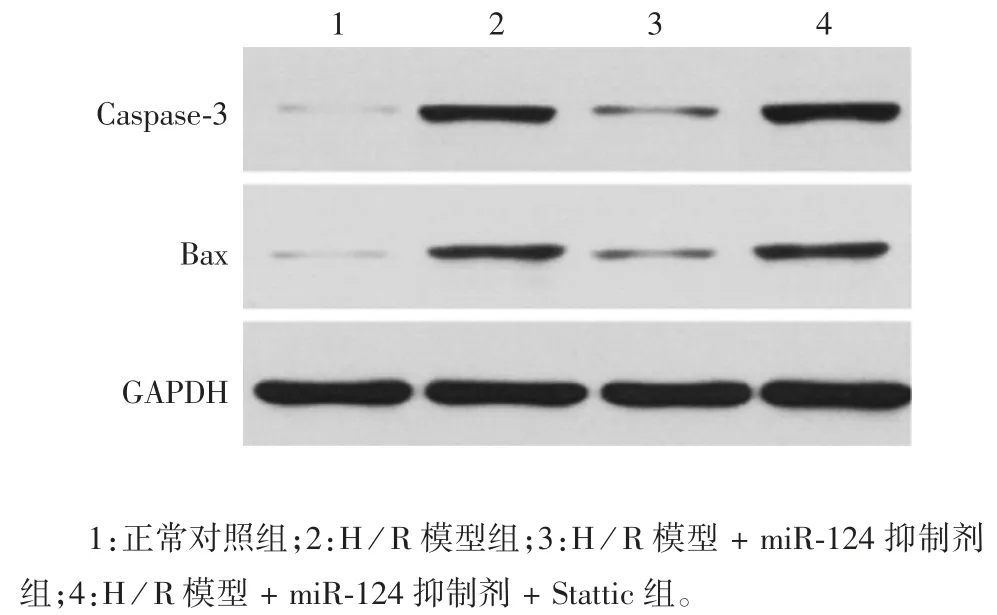
图8 miR-124 诱导大鼠心肌细胞促凋亡相关蛋白表达的Western blot 分析Fig.8 Western blotting of expressions of rat cardiomyiocyte apoptosis-associated proteins induced by miR-124

图9 miR-124 诱导大鼠心肌细胞促凋亡相关蛋白的表达Fig.9 Expression of rat cardiomyiocyte apoptosis-associated proteins induced by miR-124
3 讨 论
心肌I / R 损伤是再灌注治疗严重的并发症之一,可能导致心肌纤维化和心肌细胞凋亡,进而发展为心力衰竭[3]。因此,深入探究其分子机制对于I /R 损伤有效的治疗策略的开发具有十分重要的意义。既往研究发现,miR 在I / R 损伤所引起的心肌病理改变中发挥重要作用[7]。本研究利用心肌细胞H9c2 的 H / R 模型来模拟心肌 I / R 损伤,结果显示,H / R 显著上调了miR-124 在体外培养的心肌细胞中的表达水平,而抑制miR-124 可有效改善H / R 诱导的心肌细胞凋亡。
目前已有研究指出,miR-124 在胃癌、膀胱癌、乳腺癌等肿瘤细胞中呈低表达,且对肿瘤细胞的增殖、迁徙和凋亡等具有重要的调控作用[8-10]。在心血管疾病方面,miR-124 可作用于特异性蛋白1 的3′端非翻译区,进而影响血管平滑肌细胞的分化、增殖以及表型转化[11];miR-124 还可负性调控核纤层蛋白 A / C,进而影响 TP53、MYC 和 Jun 等关键蛋白的表达,以发挥促进血管平滑肌细胞凋亡的作用[12]。此外,JIANG 等[13]发现,在 H9c2 细胞中,长链非编码RNA TUG1 可作为miR-124 的内源性竞争RNA,从而抑制缺氧所导致的细胞损伤。HAN 等[14]研究指出,过表达miR-124 可增加体外培养心肌细胞的凋亡水平及心肌梗死的面积,其机制可能与Dhcr24基因的表达受抑制有关。以上证据结合本研究结果,均支持miR-124 在心肌I / R 损伤所导致的细胞凋亡中的关键作用。
CAI 等[15]的早期研究证实,miR-124 可靶向调节STAT3 的表达,进而影响骨髓间充质干细胞向心肌细胞分化,提示STAT3 是miR-124 的1 个靶基因。本研究通过基因突变方法,使Mut 的STAT3 mRNA的3′-UTR 不再能被miR-124 识别,即不能与miR-124结合,结果发现Mut 组细胞加入Mimic 后并不能引起荧光素酶活性的变化。这一结果及后续的Western blot 分析进一步证实,miR-124 作用于 STAT3 的 3′-UTR 序列,进而发挥调控心肌细胞凋亡的作用。STAT3 是信号传导活化转录因子家族的重要成员,在细胞中起到传递信号和启动基因转录的双重作用。异常的STAT3 信号可抑制细胞凋亡,并促进细胞增殖及血管生成,从而在癌症的发生发展中起重要作用[16]。既往研究也证实,STAT3 信号通路的激活可降低 H / R 诱导的心肌细胞凋亡,并保护 I / R 所引起的心肌损伤[17-18]。细胞凋亡是心肌 I / R 损伤发病机制中的一个重要环节,其发生受多种促凋亡蛋白的调控,其中最重要的为Caspase-3 和Bax。研究发现,通过不同方法抑制Caspase-3 和Bax,可减少I /R 损伤时的心肌细胞凋亡,从而降低心肌I / R 的损伤程度[19-20]。本研究结果表明,抑制 miR-124 后,I/R模型组Caspase-3 和Bax 的表达降低,而加用STAT3抑制剂后,Caspase-3 和Bax 表达明显升高。因此,miR-124 可能通过降低STAT3 蛋白的表达,导致促凋亡蛋白Caspase-3 和Bax 的表达增加,进而促进H /R 诱导的心肌细胞凋亡。
综上所述,在心肌细胞H / R 体外模型中,miR-124 表达量降低,而STAT3 表达量升高,且miR-124可通过直接靶向作用于STAT3,进而抑制H / R 诱导的心肌细胞凋亡。然而,miR-124 存在较多的靶基因,尚需更多的实验来进一步丰富和完善miR-124对I / R 过程中心肌细胞的损伤作用。

