CSE基因敲除小鼠的基因型鉴定方法
覃 明 ,王海燕 ,田 丹,郑 静,汪化军,冯仁和,庹宇宇,张 悦,李妍霓,张浪浪,杨婷婷
(1.遵义医科大学 基础医学院免疫学教研室,贵州 遵义 563099;2.遵义医科大学 公共卫生学院流行病与卫生统计学教研室 贵州 遵义 563099)
硫化氢(hydrogen sulfide, H2S)是继一氧化氮和一氧化碳之后的第三个“气体信号分子”[1]。目前认为,哺乳动物细胞主要依赖胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)和胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)分别以L- 半胱氨酸和同型半胱氨酸为底物催化产生H2S[2],以此参与机体内源性H2S的合成。CSE和CBS表达具有不同的组织分布[3],CBS主要表达于中枢神经系统;CSE主要表达于心血管系统、呼吸系统、胃肠道等外周器官[4-5]。H2S功能诸多,一直是研究的热点,H2S在心血管系统中有舒张血管、抑制血管重构和保护心肌等重要调控作用,并与多种心血管疾病相关[6-7];在免疫系统中与调节性T淋巴细胞的发育与功能密切相关[8],还与结肠癌癌细胞的生长、代谢密切相关[9],本课题组近年来的工作也发现CSE通过调节内源性H2S的合成在调控炎症方面有重要作用[10-11 ]。虽然CSE和CBS基因敲除小鼠在这些研究中被大量应用,但关于CSE基因敲除小鼠基因型鉴定方法的介绍都比较简略。因此,本研究介绍一种快速、较为准确的具体鉴定方法,以期为应用该动物的实验研究提供参考。
1 材料与方法
1.1 实验动物及伦理声明 SPF级C57BL/6背景CSE杂合子小鼠(CSE+/-)由复旦大学药学院朱依谆教授课题组惠赠,杂合子小鼠交配繁殖后,随机取其子代小鼠(6-8周龄)21只用于实验;野生C57BL/6小鼠购买于长沙市天勤生物技术有限公司,许可证号:SCXK(湘)2019-0013,随机取3只(6~8周龄)用于实验;小鼠饲养环境温度22 ℃,湿度50%,光照时间(明/暗 12 h), 食物和水供应充足,小鼠自由饮水、取食。杂合子小鼠繁殖(2雌1雄/笼),其余小鼠雌雄分开,8只/笼。实验方案符合《动物福利行为指南》,并得到遵义医科大学动物实验伦理委员会的批准。
1.2 方法
1.2.1 小鼠基因组DNA的提取 采用Mouse Direct PCR Kit试剂盒(B40013,Biotool)提取DNA,严格按照试剂盒说明书操作。剪取所有小鼠的尾尖组织(约0.5 cm)于裂解液(100 μL Buffer L与2 μL Protease plus混匀)中,55 ℃水浴30 min,再95 ℃水浴10 min,12 000 r/min离心10 min,上清液中即含小鼠DNA组,可直接用于扩增。
1.2.2 小鼠基因组DNA扩增及电泳 设计野生型(wild type,WT)引物,序列如下:5'-CCTGGATATAAGCGCCAAAG -3',5'-CGAGAATTCCATTGCTCAGG-3';设计CSE基因敲除型(CSE-/-)引物,序列如下:5'-CCTGGATATAAGCGCCAAAG-3', 5'- AGGAACCAGGGCGTATCTCT-3'。上述引物均由上海生工公司合成,按说明书操作,每种引物均稀释为10 μM。每种引物各加0.1 μL共0.4 μL。具体如下:总体系为20 μL,2×Mix 10 μL,DNA 1μL,DEPC H2O 8.6 μL,引物0.4 μL。扩增条件:94 ℃预变性3 min后,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,35个循环,72 ℃ 5 min后回温至4 ℃。然后配制浓度为1.5 %(质量/体积)琼脂糖凝胶,按1∶10 000的比例加入EB替代物绿如蓝,混匀,待胶凝固后,拔掉梳子,设置阳性、阴性对照组,Marker孔加入DNA Marker 5 μL,样本孔每孔加入7 μL扩增后的DNA样本,放入装满1×TAE溶液的电泳槽中,开始电泳;提前30 min预热凝胶成像系统,电泳完毕,把凝胶置于成像系统上拍照。
1.2.3 小鼠骨髓来源的巨噬细胞(BMDM)的分离与培养 处死小鼠后,置75%酒精中浸泡消毒3 min后取其完整具有双侧股骨与胫骨的后肢,用1 mL无菌医用注射器预先吸入含10% FBS的1640培养液约0.5 mL,将针头插入股骨、胫骨的一端,将骨髓细胞全部吹至新的100 mm平皿中,将全部收集到的骨髓细胞用200目无菌不锈钢筛网过滤,再转入无菌离心管,1 000 r/min室温离心3 min,弃上清;将分离得到的细胞铺于6孔板中,加入终浓度20 ng/mL的巨噬细胞集落刺激因子(315-03-50,Peprotech),置于37℃ 含5% CO2培养箱中培养,第3天换液,6天后即可开始后续实验。
1.2.4 小鼠肠道组织取材 处死小鼠后,取其结肠组织(肛门至盲肠段),用预冷的PBS冲洗干净,保存备用。
1.2.5 免疫印迹(Western blot)实验 BMDM和肠道组织总蛋白提取:按说明书操作,用含1% PMSF的RIPA裂解液(R0010,Solarbio)裂解BMDM(6孔板,每孔加150 μL),用移液器将细胞蛋白收集至EP管中,冰上置30 min,每10 min涡旋震荡1次;每100 mg肠道组织加1 mL RIPA裂解液,然后匀浆。4 ℃条件下15 000 r/min离心15 min后的上清液即为细胞或组织总蛋白。采用BCA法测定细胞和组织蛋白浓度,分别调整BMDM、肠道组织蛋白浓度一致,加入1x蛋白上样缓冲液,98 ℃变性10 min,然后配胶、上样、转膜、封膜、抗体膜结合反应、显影,即用免疫印迹法测定CSE蛋白的表达,内参为GAPDH蛋白,CSE(12217-1-AP,Proteintech),GAPDH(60004-1-AP,Proteintech)。
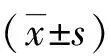
2 结果
2.1 小鼠基因型鉴定 分别提取3只野生型小鼠(CSE+/+)和21只CSE杂合子小鼠(CSE+/-)繁殖后的子代小鼠的基因组DNA,扩增后,在琼脂糖凝胶板上进行电泳对小鼠基因型进行鉴定。野生型小鼠DNA作为阳性对照组,加入P泳道;阴性对照组不加小鼠DNA,用纯水代替,加入N泳道。结果如图1所示:阳性对照组即野生鼠DNA只在167 bp处有表达条带(CSE+/+),如P泳道所示;阴性对照组如N泳道所示,在167 bp处、309 bp处均无表达条带;子代小鼠的DNA在167 bp处、309 bp处均有表达条带的为杂合子小鼠(CSE+/-),如1-3、8-11及16泳道所示;其余泳道只在309 bp处有表达条带,为CSE基因敲除鼠(CSE-/-)。

以小鼠DNA为模板PCR扩增后的琼脂糖电泳图,M代表Marker,P代表阳性对照,N代表阴性对照,1-21代表检测样本。阳性对照只在167 bp处有表达条带;阴性对照无表达;CSE+/-小鼠基因组DNA在167 bp处、309 bp处均有表达条带;CSE-/-小鼠则只在309 bp处有表达条带。图1 小鼠基因型鉴定电泳
2.2 小鼠BMDM和肠道组织中CSE的蛋白表达 小鼠基因组DNA基因型鉴定后,随机提取6只CSE基因敲除鼠(CSE-/-)骨髓来源的巨噬细胞(BMDM)蛋白和肠道组织蛋白,采用免疫印迹法(western blot)检测CSE蛋白的表达并定量分析,3只野生型小鼠(CSE+/+)的对应组织蛋白作为对照,结果如图2所示:CSE-/-鼠肠道组织(图2A)和BMDM(图2B)中CSE蛋白表达显著性降低(P<0.01),证明CSE基因敲除后,小鼠相应细胞和组织中CSE蛋白表达也明显降低,与基因型鉴定结果一致,进一步证实我们的小鼠CSE基因型鉴定方法是比较准确可靠的。
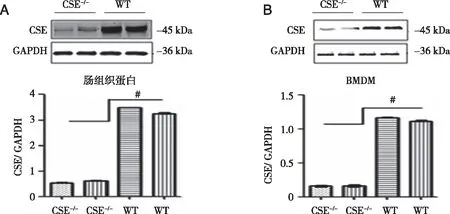
A:肠道组织中CSE蛋白表达的代表性结果,WT代表野生型小鼠(n=3),CSE-/-代表CSE基因敲除鼠与WT比较,P<0.01;B:BMDM中CSE蛋白表达的代表性结果,WT代表野生型小鼠(n=3),CSE-/-代表CSE基因敲除鼠与WT比较,P<0.01。图2 小鼠肠道组织和BMDM中的CSE蛋白表达
3 讨论
H2S最早被认为是污染环境的有毒气体,随着对H2S研究的深入,发现CSE是哺乳动物机体内源性H2S合成的主要酶之一,主要表达于外周组织[4-5]。因此,要进一步研究H2S在外周组织中的功能,必然会观察CSE基因及其蛋白的差异表达。当前,常用的方法就是利用敲除/敲减或过表达技术改变相应基因的表达,进而观察其后续蛋白表达差异或进一步分析其相关生物学功能差异[12]。虽然大量文献中利用CSE-/-小鼠作为研究动物,但针对CSE基因敲除小鼠基因型鉴定的具体方法少见报道。因此,本文主要介绍一种具体鉴定方法。
不同策略的基因修饰鼠所用的基因鉴定方法各异,PCR结合凝胶电泳、PCR结合酶切或测序是比较常用的方法。小鼠基因型PCR法鉴定的基本原则是利用基因修饰小鼠基因组与野生型小鼠基因组的序列差异,以小鼠基因组DNA为模板进行PCR,并以凝胶电泳对比不同基因型特异产物的大小(一般差异在100 bp以上),根据电泳条带表达位置的差异来区分小鼠的不同基因型。本研究通过PCR结合凝胶电泳的实验能够清晰区分CSE基因敲除小鼠的基因型,只在167 bp处有表达的是CSE+/+小鼠;在167 bp处、309 bp处均有表达的是CSE+/-小鼠;只在309 bp处有表达的是CSE-/-小鼠。
为了进一步验证凝胶电泳实验结果,采用western blot检测WT鼠与CSE-/-鼠肠道组织和巨噬细胞中CSE蛋白的表达。结果显示,与WT小鼠相比,CSE-/-小鼠肠道组织和BMDM几乎不表达CSE蛋白,且与凝胶电泳基因型检测结果一致,证明我们的鉴定方法较为准确。Ishii等[13]检测了CSE-/-小鼠外周组织肾脏和肝脏中CSE蛋白的表达,相比WT鼠,CSE-/-小鼠肝、肾组织中CSE蛋白表达显著性降低。此外,他们还检测了CSE+/-小鼠肾脏和肝脏中CSE蛋白的表达,结果显示其表达比WT鼠低,但远高于CSE-/-鼠。Liu等[1]也报道了CSE-/-小鼠心、肝、脾、肺、肾等脏器中CSE蛋白的表达,其结果与我们在肠道组织和BMDM中的检测结果类似。类比这些研究报道,可见我们的方法对于CSE基因敲除小鼠的基因型鉴定是比较准确可靠的。
综上所述,为了鉴定CSE基因敲除小鼠的基因型,我们采用的PCR结合凝胶电泳的方法是一种快速且较为准确的鉴定方法,可以为使用该动物的实验研究节约经济成本和时间成本。

