固定化离子液体分离石上柏穗花杉双黄酮的应用研究
李 刚,邱绍亮,张 凤,李思慧,刘 超,秦桂芳,王 刚
(遵义医科大学 药学院,贵州 遵义 563099)
石上柏(Selaginelladoederleinii)是卷百科卷柏属植物深绿卷柏全草,广泛分布于贵州、云南、四川等地,其主茎直立,侧枝密,分枝,具短刺尖,叶上面深绿色[1]。全草为药,味甘,性平,具有清热解毒、活血化瘀、祛风除湿等功效[2]。临床上主要用于治疗鼻咽癌、肺癌、肝癌等[3]。双黄酮类化合物广泛存在于卷柏属植物中,生物活性多样,其中穗花杉双黄酮(Amentoflavone,AME)是石上柏植物中主要活性成分,具有调节血糖、抗肿瘤、抗氧化、抗菌等作用[4-7]。传统的双黄酮提取方法包括回流提取法,渗漉法,碱溶酸沉法等,具有能耗高,环境危害大,提取率低的特点,制约了中药现代化的发展。因此有必要寻找一种快速、高效、绿色的提取方法。石上柏鲜品及AME结构见图1。
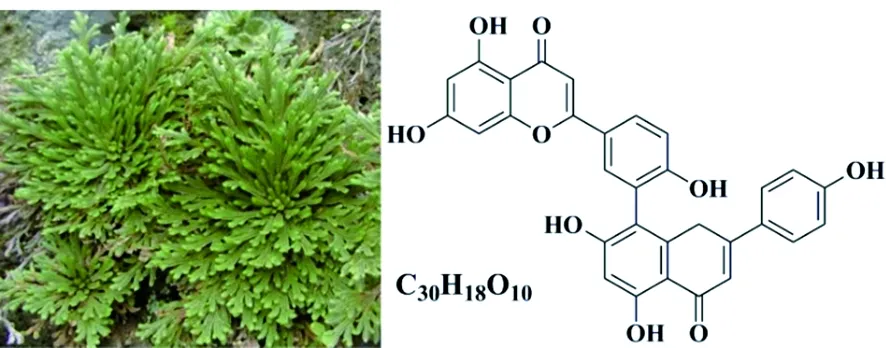
图1 石上柏鲜品与AME化学结构式
离子液体又称为室温熔盐、有机离子液体,主要是由有机阳离子和无机阴离子结合而形成的。离子液体在室温下呈液态的物质,具有不挥发、液程宽、溶解强、可设计调节等特性[8]。近年来离子液体受到很多研究者的关注和研究,因其具有较低的蒸气压,不挥发,不易燃特点,是传统易燃易挥发的有机溶剂的理想替代品[9]。然而随着对离子液体研究程度的不断加深,发现离子在提取方面存在着缺陷,比如成本高,回收困难,与目标化合物分离困难以及流失严重等。为克服这些缺陷,一项新的技术应运而生。固定化离子液体技术(supported ionic liquids ,SILs)是离子液体与固体载体通过化学键相结合得到具有离子液体结构的复合材料[10]。因SILs既有固体载体的特性又具有离子液体的独特优势,通过改变离子液体的结构可以得到多种具有不同性质的材料,用于天然产物中活性成分的吸附分离研究。Tian等[11]合成硅胶固定化咪唑类离子液体并成功从丹参中提取隐丹参酮、丹参酮Ⅰ和丹参酮Ⅱa。余燕影等[12]应用SILs技术从八角茴香人提取物中富集莽草酸,其富集率达到了80.34%。
咪唑类离子液体易于制备、成本较低、结构可调控,对黄酮类化合物的提取效果好。基于课题组之前的研究,本文采用SILs技术将咪唑类离子液体固定到硅胶载体上形成离子液体共价键合硅胶材料,并将其应用于吸附分离石上柏提取物中AME,并对吸附条件进行优化,提高AME的收率,为拓宽石上柏的综合开发途径提供理论依据。
1 材料和方法
1.1 材料与仪器 Agilent 1260-DAD-RID型高效液相色谱仪(美国安捷伦公司);RV-210M型旋转蒸发仪(一恒科学仪器公司);SHA-C型恒温水浴震荡仪(国宇仪器公司);DF-101Z型恒温磁力搅拌器(秋佐仪器公司);FW177型粉碎机(一恒科学仪器有限公司);FA1004N型电子天平(菁海仪器公司)。
3-氯丙基3甲氧基硅烷购自百灵威公司;硅胶购自青岛海洋化工厂分厂;N-甲基咪唑、四氟硼酸钠以及六氟磷酸钾均购自阿拉丁试剂公司;AME标准品购自瑞芬思生物公司;石上柏采自贵州省遵义市凤凰山,经遵义医科大学药学院生药学教研室张玉金副教授鉴定为卷柏科卷柏属深绿卷柏(Selaginelladoederleinii)的全草。
1.2 试验方法
1.2.1 SILs的合成
1.2.1.1 硅胶的活化 取硅胶(200-300目)加入液固比为20 g/mL的盐酸-水(1∶3,v/v)溶液中,静置 24 h后室温下搅拌2 h,然后回流10 h,过滤,水洗至中性,再用丙酮洗涤,最后105 ℃真空干燥10 h备用。活化硅胶是为了增加硅胶表面硅羟基的数量以及消除金属氧化物和含氮杂质。
1.2.1.2 SILs的制备 根据文献报道[13],SILs的合成方法如下。取N-甲基咪唑和3-氯丙基三甲氧基硅烷(摩尔比为1∶1)于100 mL三颈烧瓶中,在100 ℃、N2保护下搅拌24 h,反应完后用乙酸乙酯洗涤3次,然后将其置于65 ℃的真空干燥箱中干燥12 h,得到淡黄色粘稠状液体(A)。
取A、活化硅胶和无水甲苯于圆底烧瓶,加热回流24 h,过滤,产物分别用甲苯与丙酮洗涤,65 ℃真空干燥12 h,得到固定化咪唑氯盐SiO2·Im﹢·Cl﹣。
SILs合成路线下图2所示。

图2 SILs制备路线
1.2.2 对照品溶液的制备 精密称取对照品AME 7.8 mg,用95%乙醇稀释定容至10 mL,得AME对照品溶液(0.78 mg/mL)。
1.2.3 供试品溶液的制备 取50.0 g过80目的石上柏粉末,加入600 mL的95 %乙醇回流提取3次,每次1 h,过滤,合并提取液,减压浓缩,用95%乙醇定容至250 mL,得到石上柏提取物溶液。
1.2.4 色谱条件 色谱柱:DiK-ma Diamons C18色谱柱(250 mm×4.6 mm,5 μm),流动相:乙腈(A)- 0.1%甲酸水(B);检测波长:330 nm;柱温:25 ℃;流速:1.0 mL/min;进样量:10 μL,流动相梯度如表1所示[14]。

表1 HPLC梯度洗脱程序
分别精密吸取AME对照品溶液1、2、3、4、5、6 mL,分别置于10 mL 容量瓶中,加甲醇定容,摇匀,得系列对照品溶液。将对照品溶液按照上述色谱条件进行HPLC分析,绘制标准曲线,得到AME的回归方程为:y=22116x-108,相关系数R2=0.9995,其中y和x分别代表AME标准品的吸光度值和浓度(mg/mL)(石上柏提取物及AME标准品HPLC图如图3所示),表明AME在0.078~0.468 mg/mL范围内与峰面积积分值呈良好线性关系。

A:AME标准品;B:石上柏提取物,1:AME。图3 石上柏提取物、AME标准品HPLC
1.2.5 静态吸附与解析实验

(1)
(2)
式中C0为吸附前AME的浓度 (mg/mL);C1为吸附后AME的浓度(mg/mL);V为样液AME溶液的体积(mL);m为吸附剂使用的质量(g)。
1.2.5.2 单因素实验考察 以AME为指标,考察在不同吸附时间(10、20、30、40、50、60 min),吸附温度(10、20、30、40、50、60 ℃),固液比 (0.25∶6,0.5∶6,0.75∶6,1∶6,1.25∶6,1.5∶6 g/mL)以及不同初始浓度(0.1、0.15、0.2、0.25、0.3 mg/mL)的条件下SILs对石上柏提取物中AME吸附率的影响。
1.2.5.3 静态解吸实验 将静态吸附饱和的SILs和适量甲醇混合均匀,在30 ℃下震荡30 min(150 r/min),待SILs中AME充分解吸后,过滤,在“1.2.4”项色谱条件下测定滤液中AME的含量,根据公式(3)计算出解析率D %。
(3)
式中C0为吸附前AME的浓度(mg/mL);C1为吸附后AME的浓度(mg/mL); V1为样液AME溶液的初始体积(mL);C2为解析后AME的浓度(mg/mL);V2为解析后AME溶液的体积(mL)。
1.2.6 动态吸附与脱附实验
1.2.6.1 动态吸附实验 取2.0 g SILs填充在玻璃柱(200 mm×10 mm),将0.44 mg/mL的AME溶液以0.2 mL/min的流速通过吸附柱,收集流出液(每只试管收集4 mL流出液),按照“1.2.4”项色谱条件下测定流出液中AME浓度。以上样体积为横坐标,AME浓度为纵坐标,绘制动态吸附曲线。
1.2.6.2 动态脱附实验 吸附平衡后,将洗脱剂(甲醇)以0.2 mL/min流速通过吸附柱进行洗脱,收集洗脱液(每只试管收集4 mL洗脱液),按照“1.2.4”项色谱条件下测定洗脱液中AME浓度。以洗脱剂体积为横坐标,AME浓度为纵坐标,绘制动态脱附曲线。
2 结果
2.1 静态吸附与解析实验
2.1.1 最佳SILs的筛选 3种固定化离子液体和硅胶对AME的效果如表2所示。从表2中可知,SiO2·Im﹢·Cl﹣的对AME的吸附效果最好,因此选择SiO2·Im﹢·Cl﹣为最佳的SILs,下实验选择SiO2·Im﹢·Cl-作为吸附剂(图4为提取液稀释前后对比)。
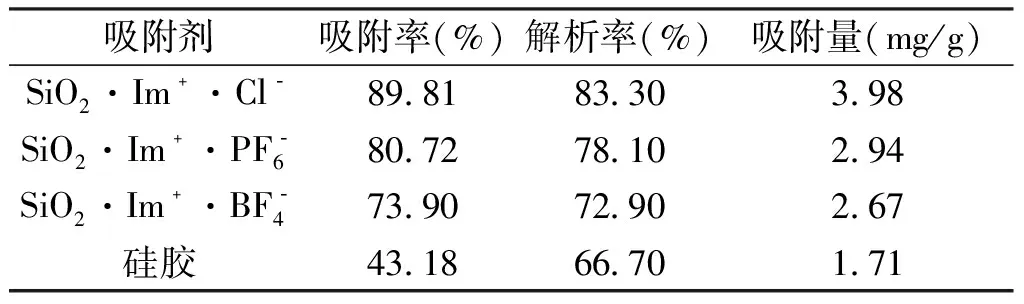
表2 不同吸附剂对AME的吸附与解析能力

图4 AME供试溶液吸附前 (Ⅰ) 和吸附后 (Ⅱ) 的照片对比
2.1.2 吸附时间的影响 不同时间(10,20,30,40,50,60 min)内SiO2·Im﹢·Cl-对AME吸附率的影响如图5所示。从图5可知,当吸附时间从10 min增加到30 min 时,吸附率从50.72%上升到80.01%;当吸附时间超过30 min后,吸附率几乎不再变化,说明此时吸附已经达到饱和,因此选择30 min为最佳吸附时间。

图5 吸附时间对吸附率的影响
2.1.3 吸附温度的影响 不同吸附温度(10,20,30,40,50,60 ℃)下SiO2·Im﹢·Cl-对AME吸附率的影响如图6所示。由图6可知,当吸附温度从0升高到30 ℃时,吸附率从72.23%上升到83.00%;当温度达到30 ℃时吸附率最大,达到83.51%;当温度从30 ℃升高到60 ℃时,吸附率反而从83.00%降低至75.55%,这可能是由于温度升高吸附物质被氧化所致,因此选择30 ℃为最佳吸附温度。
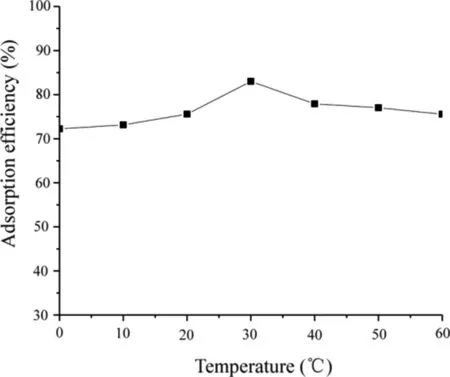
图6 吸附温度对吸附率的影响
2.1.4 固-液比的影响 不同固液比(0.25∶6,0.5∶6,0.75∶6,1.0∶6,1.25∶6,1.5∶6 g/mL)下SiO2·Im﹢·Cl-对AME吸附率的影响如图7所示。由图7可知,当固液比从0.25∶6 g/mL增加到1.0∶6 g/mL吸附率从 45.22%上升到87.54%;当固液比超过1.0 g/mL后,吸附率几乎不再随着固液比的变化而变化,说明此时吸附已经达到饱和,因此选择1.0∶6 g/mL为最佳固液比。
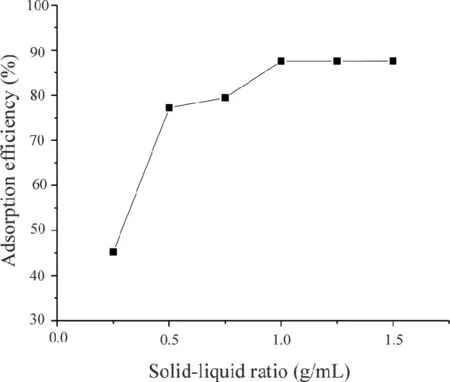
图7 固液比对吸附率的影响
2.1.5 提取物初始浓度的影响 不同初始浓度(0.1,0.15,0.2,0.25,0.3 mg/mL)下SiO2·Im﹢·Cl-对AME吸附率的影响如图8所示。由图8可知,提取物初始浓度0.1 mg/mL增加到0.2 mg/mL时,吸附率从75.06 %上升到88.81%;当提取物初始浓度达到0.2 mg/mL时,吸附率最大达到88.81%;当提取物初始浓度从0.2 mg/mL增加到0.3 mg/mL,吸附率反而从88.81%降至75.08%,这可能是由于上样液AME浓度过大导致样品分子间的距离减小,分子间作用力增大,阻碍SILs与样品之间的作用力,因此选择0.2 mg/mL为最佳初始浓度。

图8 样液浓度对吸附效率的影响
2.2 动态吸附与脱附实验
2.2.1 动态吸附实验 SiO2·Im﹢·Cl-对AME的动态吸附结果如图9所示。由图9可知,当上样体积从4mL增加到24 mL时流出液中AME浓度几乎不变;上样体积在 24 mL增加到72 mL时,流出液中AME浓度急剧上升;上样体积达到72 mL时流出液中AME浓度达到最大为0.39 mg/mL,此时的AME的吸附率为88.63%;当上样体积存超过72 mL后,流出液中AME浓度几乎不发变化,此时吸附达到饱和状态。

图9 SiO2·Im﹢·Cl﹣动态吸附曲线
2.2.2 动态脱附实验 SiO2·Im﹢·Cl-对AME的动态脱附结果如图10所示。由图10可知,脱附曲线是对称的,说明脱附性能良好;当脱附剂体积达到24 mL 时,洗脱液中AME浓度达到最大,此时脱附率为89.72%;当脱附剂体积超过64 mL后洗脱液中AME浓度几乎不发生变化,此时洗脱完全。
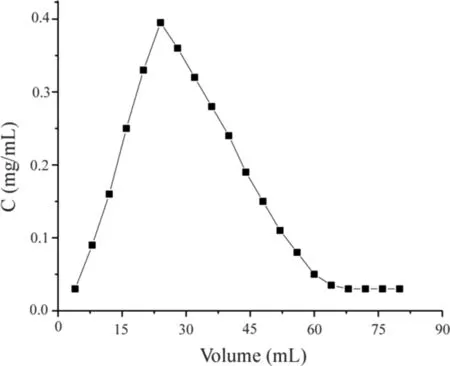
图10 SiO2·Im﹢·Cl﹣动态脱附曲线
2.3 重复利用SILs的考察 根据“1.2.5”项下实验方法,SiO2·Im﹢·Cl-重复吸附AME两次,其吸附率达到65.5%、62.3%,第3次重复使用时其吸附率下降到原来的一半,说明合成的SiO2·Im﹢·Cl-可重复使用。
3 讨论
离子液体含有羟基、氨基、羧基等活性基团,能够通过的共轭作用、氢键作用、静电作用等相互作用力与黄酮分子结合从而达到分离的目的。SILs技术是将离子液体固定到固体载体上形成复合材料,具有制备简单、富集效率高、吸附容量高、pH 稳定性好、识别位点多、萃取选择性强、离子液体利用率高等优点。将离子液体负载于硅胶后,有利于增强离子液体黄酮类分子识别能力以及增大离子液体与双黄酮类分子接触面积,因此能够对黄酮类分子进行选择性吸附分离。随着对SILs技术研究程度的不断加深,其应用范围也不断拓展。王志兵等[15]合成了3种SILs并通过固相分散法来分离蜂房中5中酚酸类和黄酮类物质,结果发现固相分散法的最佳条件是:10% SiO2·[C6min]·Cl为分散剂,20 mL正己烷为淋洗剂,15mL甲醇为洗脱剂,样品与分散剂的质量比为1∶4,在此条件下5种化合物的分离效率分别为咖啡酸183.45±11.28 μg/g,阿魏酸119.01±9.47 μg/g,桑色素75.22±6.89 μg/g,白杨素392.10±12.21 μg/g,山奈素328.08±12.29 μg/g。
本文合成并筛选的SILs对石上柏提取物中AME进行吸附分离,并考察了吸附过程中吸附时间、温度、液固比及初始浓度对AME吸附率的影响以及SILs重复使用性能,动态吸附与脱附实验结果表明SiO2·Im﹢·Cl﹣具有良好的吸附和脱附能力。对于0.44 mg/mL的溶液样品,曲线穿透点在上样体积为72 mL时其吸附量为72 mg/g,动态脱附以甲醇作为脱附剂,使用24 mL的甲醇,AME洗脱率可达89.72%。结果表明,SILs分离AME效果好,可重复使用,拓宽了天然产物中活性成分的分离纯化研究思路。

