MiR-671-3p通过CKAP4抑制结肠癌细胞的增殖和迁移
杨 欣,卢癸凤,胡文慧,肖 智,耿 飞
(1.遵义医科大学 生理学教研室,贵州 遵义 563099;2.遵义医科大学 病理生理学教研室,贵州 遵义 563099)
结肠癌目前是世界上确诊排名前列的肿瘤,并且易复发和对化疗药物耐药,患者致死率逐年上升[1]。目前,手术和化疗是结肠癌的主要治疗手段,手术影响患者的生活质量,化疗具有毒副作用[1-2]。基因的异常表达被认为参与结肠癌的发生、发展。然而,关于结肠癌的发病机制仍有待于进一步的研究,新的生物学标志物和治疗靶点的发现将有助于结肠癌诊疗方法的发展。
微小RNA(miRNA)是一类非编码RNA,长度为20~22个核苷酸,被认为可以调控基因的表达[3-4]。微小RNA通过结合靶基因的3’UTR区抑制信使RNA的翻译[5-6],从而参与细胞的增殖、凋亡和分化[7-8]。已有大量微小RNA被揭示参与调控肿瘤的进程[9-12]。然而,结肠癌相关的微小RNA和它们的调控机制还有待于新的发现。最近的研究显示miR-671-3p在多种癌症中发挥着重要作用[13-14]。在胶质瘤细胞中,过表达miR-671-3p可以通过靶基因CDR1-AS、CDR1和ASNL1显著增加细胞的迁移和增殖能力[13]。miR-671分为miR-671-5p和miR-671-3p,其中miR-671-5p可以促进结肠癌的增殖[15]。然而,miR-671-3p在结肠癌中的作用及其机制还有待于研究。本研究主要探讨了miR-671-3p在结肠癌中的作用及其潜在的机制。
1 材料与方法
1.1 材料与试剂 人结肠癌细胞株RKO及SW620由遵义医科大学生理学教研室保存。RMPI 1640培养基购买自美国Hyclone公司;胎牛血清和胰酶购自Gibico生物公司;miR-671-3p mimic及抑制剂购自广州锐博生物科技公司;Trizol试剂购买自Invitrogen公司;Lipofectamine TM 2000转染试剂及BCA蛋白检测试剂盒购买自美国赛默飞世尔科技公司;荧光定量PCR相关试剂购买自TAKARA公司;miR-671-3p RT-PCR引物由锐博公司合成; CCK-8试剂盒购买自日本同仁公司;PVDF膜购买自美国Millipore公司;CKAP4一抗购买自武汉三鹰生物公司;辣根过氧化物酶标记的二抗购买自Abcam公司;Boyden Transwell小室购买自美国BD公司。6孔板、24孔板、96孔板、培养瓶等购买自NEST公司。
1.2 方法
1.2.1 结直肠癌细胞株RKO和SW620细胞培养 RKO及SW620来源于美国模式培养物集存库,由遵义医科大学生理学教研室保存,采用含10%胎牛血清的RMPI 1640培养基,置于37 ℃,含5%CO2的细胞培养箱中培养。
1.2.2 质粒扩增 商品化的CKAP4过表达及对照质粒购买自维真生物公司(济南),经过转化、质粒小摇等一系列扩大培养,以获取足够质粒用于后续的回复实验。
1.2.3 RKO和SW620,及CKAP4过表达质粒的转染 miR-671-3p mimic及抑制剂由锐博公司设计和合成。选取状态良好的结直肠癌细胞株RKO及SW620,胰酶消化吹打成均匀细胞悬液后铺于6孔板内,第2天待细胞长到合适密度(70%~80%),给予每孔5 μL mimic或抑制剂瞬时转染,分为阴性对照组(NC)及实验组,转染6~8 h后更换含有10%胎牛血清的RMPI 1640继续培养。过表达CKAP4的实验则分为阴性对照组及过表达组,每孔转染4 μg质粒6~8 h后,更换含10%胎牛血清的RMPI 1640继续培养。
1.2.4 实时荧光定量PCR 收集转染24 h后的细胞,用Trizol提取细胞总RNA,测定浓度后,用逆转录试剂盒逆转成cDNA,反应条件为37 ℃ 60 min,85 ℃ 5 min。逆转录产物稀释5倍后备用。荧光定量PCR被用来检测miR-671-3p的水平,U6作为内参对照。检测相应的Ct值,以Ct值计算实验组和对照组miR-671-3p的相对表达量,计算公式为ΔΔCt=(CtmiR- CtU6)实验组-(CtmiR- CtU6)对照组。
1.2.5 蛋白免疫印迹实验 收集培养的细胞,用RIPA缓冲液裂解,缓冲液里含有蛋白酶抑制剂。蛋白浓度通过BCA蛋白检测试剂盒测定。取30 μg蛋白通过10%聚丙烯酰胺凝胶分离。而后,蛋白转移到PVDF膜上。膜用5%的脱脂奶粉封闭1 h,然后CKAP4一抗(16686-1-AP,1∶1 000)孵育过夜。第二天,用含有辣根过氧化物酶的二抗孵育,ECL试剂盒检测。β-actin作为内参对照。
1.2.6 细胞迁移实验 孔径8 μm的Transwell小室(不含Matrigel)被用来检测细胞的迁移能力。用200 μL不含有胎牛血清的培养基消化重悬细胞,取1×105个细胞接种在小室的上层。500 μL包含胎牛血清的培养基加入到小室的下层。37 °C孵育2~6 d(其中RKO细胞2~3 d,SW620细胞4~6 d),用棉花擦去上室的细胞,穿越到下室的细胞用甲醇固定1 h,0.1%结晶紫染色30 min至1 h。显微镜下观察穿过膜的细胞,随机取5个视野进行拍照,计算5个视野细胞的平均值作为迁移的细胞数。
1.2.7 细胞增殖实验 选取生长状态良好的结肠癌细胞株RKO及SW620铺板瞬时转染。24 h后,胰酶消化重悬细胞,计数。按照96孔板每孔1 000个细胞接种转染的细胞,每组3个复孔。培养24 h后使用CCK8法检测每孔的OD值:吸出培养基,加入100 μL CCK8混合液(培养基:CCK8试剂为9∶1的比例),37 ℃孵育2~4 h。酶标仪检测490 nm处的OD值,隔天测1次,得出细胞增殖曲线。
1.2.8 数据库数据分析 来源于TCGA数据库(http://cancergenome.nih.gov/)的临床数据用来分析CKAP4在结肠癌中的表达。同时,相关的临床信息也被用来分析CKAP4对结肠癌患者预后生存时间的分析。
1.3 统计学分析 数据采用SPSS 16.0统计软件处理,两组均数间比较采用独立样本t检验,多组间均数比较采用单因素方差分析,增殖实验数据采用重复测量双因素方差分析,取α=0.05为检验标准。
2 结果
2.1 过表达miR-671-3p抑制结肠癌细胞的迁移和增殖 为了检测miR-671-3p在结肠癌生物学行为中作用,进行了一系列实验。首先,在RKO和SW620细胞转染miR-671-3p mimic及其空白对照(NC),qRT-PCR检测过表达效率,结果显示miR-671-3p被成功过表达(见图1A)。Tranwell小室及CCK8实验用来检测细胞的迁移和增殖能力。和对照组相比,RKO细胞过表达miR-671-3p可以使细胞的增殖能力降低(图1B,F=10.525,P=0.032)。同样,miR-671-3p也减少了SW620细胞的增殖(图1C,F=19.09,P=0.012)。在细胞迁移实验中,过表达miR-671-3p后RKO细胞的迁移能力显著被抑制(图1D和E,t=11.688,P<0.001)。而miR-671-3p也抑制了SW620细胞的迁移(图1D和E,t=5.84,P=0.004)。以上实验结果提示miR-671-3p可以显著抑制结肠癌细胞的增殖和迁移能力。

A:转染miR-671-3p mimic后miR-671-3p在RKO和SW620细胞中的表达;B:miR-671-3p对RKO细胞增殖的影响;C:miR-671-3p抑制SW620细胞的增殖;D和E:miR-671-3p对RKO和SW620细胞迁移能力的影响;*:与对照组比较,P<0.05;**:与对照组比较,P<0.01;***:与对照组比较,P<0.001。图1 过表达miR-671-3p对结肠癌细胞迁移和增殖的影响
2.2 抑制miR-671-3p促进结肠癌细胞的增殖和迁移 为进一步确证miR-671-3p的效应,在RKO和SW620细胞转染miR-671-3p抑制剂及其对照,qRT-PCR检测抑制效率,结果显示miR-671-3p被成功抑制(见图2A)。和对照组相比, miR-671-3p抑制剂可以促进RKO细胞(图2B,F=142.137,P<0.001)和SW620细胞(图2C,F=27.886,P=0.006)的增殖,提示了增强的增殖能力。而细胞转染miR-671-3p抑制剂使miR-671-3p表达降低后,RKO细胞(图2D和E,t=-4.867,P=0.008)和SW620细胞(图2D和E,t=-7.991,P=0.001)迁移的数量增加,意味着可以显著增强细胞的迁移能力。

A:转染miR-671-3p抑制剂后miR-671-3p在RKO和SW620细胞中的表达;B:miR-671-3p抑制剂促进RKO细胞的增殖;C:miR-671-3p抑制剂促进SW620细胞的增殖;D和E:miR-671-3p抑制剂增强RKO和SW620细胞的迁移;**:与对照组比较,P<0.01;***:与对照组比较,P<0.001。图2 抑制miR-671-3p促进结肠癌细胞的迁移和增殖
2.3 miR-671-3p调控CKAP4的表达 本课题组之前关于胶质瘤的研究揭示了miR-671-3p可以和CKAP4结合,并在胶质瘤细胞中调控CKAP4的表达[16]。为了探索miR-671-3p是否能调控结肠癌细胞中CKAP4的表达,分别在RKO细胞和SW620细胞中过表达miR-671-3p,应用蛋白免疫印迹实验检测CKAP4的表达水平。结果显示,miR-671-3p能显著降低RKO细胞(图3A和B,t=3.315,P=0.03)和SW620细胞(图3A和B,t=3.189,P=0.033)中CKAP4的表达水平。这揭示了miR-671-3p能调控结肠癌中CKAP4的表达。
2.4 CKAP4在结肠癌中表达上调 上面的结果揭示了miR-671-3p可以直接调控结肠癌细胞CKAP4的表达。为了探索CKAP4在结肠癌进程中的角色,TCGA数据库中结肠癌患者的数据被用来分析CKAP4的临床相关性。结果显示,CKAP4在结肠癌中表达显著上调(图4A,P<0.001),但是对结肠癌患者的生存时间没有影响(见图4B),揭示了CKAP4在结肠癌中的潜在作用。

A和B:miR-671-3p抑制CKAP4蛋白的表达;*:与对照组比较,P<0.05。图3 miR-671-3p调控CKAP4的表达

A:CKAP4在结肠癌患者标本中的表达;B:CKAP4表达对结肠癌患者生存率的影响; ***:与对照组比较,P<0.001。图4 CKAP4在结肠癌中的表达
2.5 过表达CKAP4逆转miR-671-3p所导致的抑癌效应 为了揭示CKAP4对体外结肠癌细胞增殖和迁移的影响,进一步确证CKAP4参与miR-671-3p对结肠癌细胞调控的过程,构建了CKAP4过表达质粒。过表达miR-671-3p后,CKAP4的表达降低,因此,在过表达miR-671-3p的同时过表达CKAP4基因,检测是否能消除miR-671-3p的效应。结果显示,过表达CKAP4可以逆转miR-671-3p所导致的效应,RKO细胞(图5A,F=13.728,P=0.006)和SW620细胞(图5A,F=8.586,P=0.017)的增殖能力增加。另外,在过表达miR-671-3p的同时过表达CKAP4也能增强RKO细胞(图5B和C,F=24.213,P=0.001)和SW620细胞(图5B和C,F=87.762,P<0.001)的迁移能力。这些结果显示,miR-671-3p对结肠癌细胞的调控是通过下游基因CKAP4实现的。
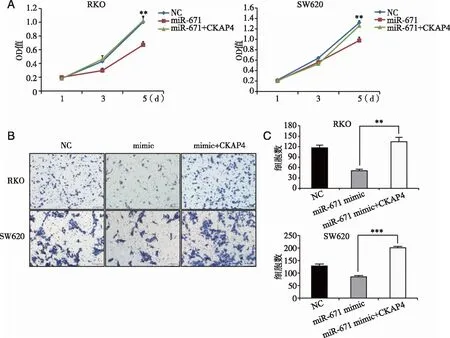
A:过表达CKAP4阻断了miR-671-3p对RKO和SW620细胞的增殖;B和C:转染miR-671-3p mimic和CKAP4过表达质粒对RKO和SW620细胞迁移的影响;**:与对照组比较,P<0.01;***:与对照组比较,P<0.001。图5 过表达CKAP4逆转miR-671-3p所导致的抑癌效应
3 讨论
最近的一些研究显示,微小RNA已被应用于结直肠癌的诊断和分类[17-18],显示了微小RNA的巨大潜能。在本研究中,首先探讨了miR-671-3p在结肠癌细胞中的生物学作用,miR-671-3p可以调控体外结肠癌细胞CKAP4的表达水平,利用网上数据库数据分析了miR-671-3p的下游靶基因CKAP4在结肠癌中的表达,而过表达CKAP4可以逆转miR-671-3p对结肠癌的抑癌效应。这些结果提示miR-671-3p/CKAP4信号影响结肠癌的进程。
研究显示miR-671在乳腺癌中是一个抑癌因子,过表达miR-671抑制乳腺癌细胞的增殖和侵袭[14]。然而,在胶质瘤中过表达miR-671则可以促进肿瘤细胞的增殖和迁移[13]。这些结果表明,miR-671在不同的肿瘤中发挥着不同的效应。miR-671分为miR-671-5p和miR-671-3p两种形式,其成熟序列不同。miR-671-3p在结肠癌中的作用还不清楚。本研究中,在结肠癌细胞过表达和抑制miR-671-3p,结果显示miR-671-3p在结肠癌中发挥着抑癌的效应。那么miR-671-3p是怎么发挥效应的呢?本课题组之前的研究表明,miR-671-3p能结合CKAP4,并在胶质瘤细胞中调控CKAP4的表达[16]。本研究中,在结肠癌细胞中过表达miR-671-3p,CKAP4的表达也下降,提示了miR-671-3p能调控CKAP4的表达。CKAP4位于细胞的表面,属于Ⅱ型跨膜蛋白,它是多种配体的受体[19-20]。CKAP4参与到肿瘤的进程中,但是它可能发挥着促癌或者抑癌的效应[21]。本研究中,TCGA数据库中结肠癌的数据被用来分析CKAP4的表达及其对结肠癌患者预后生存时间的影响。分析结果显示,CKAP4在结肠癌中表达上调,但是对结肠癌患者的生存时间没有影响。CKAP4可以降低结肠细胞的凋亡[22],其异常变化和结直肠癌的严重程度相关[23]。这些表明CKAP4在结肠癌中是一个肿瘤促癌因子,它是miR-671-3p的下游靶分子。
虽然miR-671-3p能调控CKAP4的表达,那么CKAP4是否参与到miR-671-3p对结肠癌的调控过程呢?为了解决这个问题,本研究在过表达miR-671-3p的同时过表达CKAP4。结果显示,过表达CKAP4能增强结肠癌细胞的增殖和迁移能力,从而逆转了miR-671-3p的效应,提示了miR-671-3p通过CKAP4发挥对结肠癌细胞的抑制效应。
本研究利用结肠癌细胞株RKO及SW620,说明miR-671-3p抑制结肠癌细胞的迁移和增殖,提示其可能是抑癌因子,为结肠癌的诊疗提供了可能的靶点。在机制方面,本研究提出了miR-671-3p/CKAP4信号抑制结肠癌的进程,而关于体内方面的实验研究还有待于进一步的开展。
——一道江苏高考题的奥秘解读和拓展

