蛇床子素通过上调eNOS/PKG-1通路抗野百合碱所致大鼠肺动脉高压
任星桥,李晓彤,林小英,曾凡群,李叶丽,杨丹莉
(1.遵义医科大学 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室;2.遵义医科大学 药学院,贵州 遵义 563099)
肺动脉高压(Pulmonary arterial hypertension,PAH)是一种严重危害健康的疾病,主要特征为肺血管阻力进行性增加、肺小动脉发生重构,可继发右心室重构、右心衰竭,严重导致死亡。目前认为PAH发病机制主要涉及基因突变、血管活性物质失衡(例如:内皮素与一氧化氮平衡失调)、离子通道改变等多个方面[1-4]。研究认为,在PAH的发生发展中,血管病变是肺小动脉重构的核心环节,而肺小动脉内皮细胞受损是肺小动脉重构的始动环节。动脉内皮细胞受损导致内皮素生成增多,一氧化氮(Nitric oxide,NO)生成减少[5]。动脉内皮细胞损伤引起内皮型一氧化氮合成酶(Endothelial nitric oxide synthases,eNOS)下调,NO生成减少,抑制可溶性鸟苷酸环化酶的活化,环磷酸鸟苷(Cyclic guanosine monophosphate,cGMP)生成减少,继而蛋白激酶G1(Protein kinase G1,PKG-1)失活,细胞内游离Ca2+浓度升高,引起肺小动脉收缩和肺小动脉平滑肌细胞增殖,导致肺动脉压力升高。故eNOS/PKG通路受阻可促进PAH发生、发展。因此,激活eNOS/PKG-1通路是抗PAH的重要策略之一。
蛇床子素(Osthole,Ost)是中药蛇床子中含量最高的香豆素类成分。研究表明Ost具有抗炎、扩血管、抑制血管平滑肌细胞增殖、抗心律失常、保护心脏等作用[6-8]。课题组前期研究结果表明,Ost具有降低PAH大鼠肺动脉平均压、减轻肺小动脉重构等作用。L-精氨酸(L-Arginine,L-arg)是体内合成NO的底物。NG-硝基左旋精氨酸甲酯(L-NAME)作为内皮型一氧化氮合成酶(endothelial nitric oxide synthases,eNOS)的抑制剂,可阻断eNOS催化L-arg生成NO。本研究以L-NAME作为工具药,采用野百合碱(Monocrotaline,MCT)建立大鼠PAH模型,于造模后第14天至第28天给予Ost干预,探讨eNOS/PKG-1通路在Ost干预PAH中的作用。
1 材料与方法
1.1 药品与试剂 蛇床子素(纯度≥99.90%)、L-精氨酸、L-NAME均购自MCE公司;MCT购自Sigma公司;BCA法蛋白定量试剂盒购自上海捷瑞生物工程有限公司;eNOS抗体购自abcam公司;PKG-1抗体购自Cell Signaling公司;β-actin抗体购自Proteintech公司;ECL发光剂购自Tanon公司。
1.2 仪器 PowerLab/8SP生物监测仪(澳大利亚AD instruments公司);组织切片机(德国Leica公司);正置显微镜及照相系统(日本Olympus公司);5417R离心机(德国Eppendorf公司);Supply Mini-Protean3电泳仪、Mini Trans-Blot转移系统、ChemiDoc成像系统(美国BIO-RAD公司)。
1.3 实验动物及分组 SPF级180~200 g雄性SD大鼠60只,随机抽取10只大鼠为正常对照组(Control组),其余大鼠均采用颈背部一次性皮下注射MCT(55 mg/kg)建立PAH模型,Control组大鼠注射等体积生理盐水。模型建立14 d后,将所有模型大鼠随机分为模型组(MCT,n=10)、蛇床子素组(Ost,n=10)、蛇床子素+NG-硝基左旋精氨酸甲酯(Ost+L-NAME,n=10)、L-精氨酸组(L-arg,n=10)、L-精氨酸+L-NAME组(L-arg+L-NAME,n=10)。模型大鼠后四组于造模后第14天至第28天分别灌胃Ost、L-NAME,及腹腔注射L-arg等,每天1次。每日观察大鼠的一般状况,包括大鼠的毛发、呼吸、活动及死亡情况。
1.4 实验方法
1.4.1 血流动力学检测 给药14 d后,称大鼠体重,采用右心导管术检测大鼠肺动脉压力,剪开大鼠颈部右侧皮肤,游离右锁骨下静脉。剪开“V”型小口,将连接压力传感器的导管插入右侧锁骨下静脉,经右心房插入右心室,转入肺动脉,根据压力波形判断导管是否进入相应位置,并采集肺动脉压力数据。
1.4.2 大鼠肺重指数的测定 血流动力学检测后迅速摘取肺组织,置于预冷的生理盐水中清洗,滤纸蘸干表面水分并称重记录,计算肺重指数(Lung weight index,LI=肺重/体重。)
1.4.3 大鼠肺动脉形态学观察 取大鼠右肺下叶远离肺门的肺组织,置于4%甲醛溶液中固定48 h后进行石蜡包埋,并按照H&E染色相关步骤进行操作,于正置显微镜下观察肺动脉形态学变化。
1.4.4 Western blot检测大鼠肺组织eNOS和PKG-1蛋白表达 取大鼠肺组织并提取蛋白,按照BCA蛋白定量试剂盒说明书操作测定样品总蛋白浓度,经蛋白变性,上样,蛋白样品电泳分离和电转后,于4 ℃过夜孵育相应一抗,并于室温下孵育相应二抗,在成像系统中显影并采集图像。
1.5 统计学分析 实验数据采用SPSS 20.0软件进行分析,结果以均数±标准误(mean±SEM)表示,用单因素方差分析比较多组实验数据,方差齐选用LSD法,方差不齐选用Dunnett’T3法,P<0.05时认为差异有统计学意义。
2 结果
2.1 Ost对大鼠一般状况的影响 研究结果显示,Control组大鼠毛发光泽、呼吸平稳;MCT组大鼠毛发无光泽、呼吸急促、活动减少;Ost组和L-arg组大鼠与MCT组相比,毛发较为光滑、呼吸较为平稳、活动量有所增加;Ost+L-NAME组和L-arg+L-NAME组大鼠一般状况与MCT组大鼠相似,均出现毛发黯淡、呼吸较为急促等情况。期间Control组大鼠无死亡,MCT组大鼠死亡4只,Ost组和L-arg组大鼠各死亡1只,Ost+L-NAME组和L-arg+L-NAME组大鼠各死亡2只。
2.2 Ost对大鼠肺动脉平均压的影响 与Control组相比,MCT组大鼠mPAP升高了81.81%(P<0.05);与MCT组相比,Ost组和L-arg组大鼠mPAP分别降低28.01%、31.04%(P<0.05);与Ost组相比,Ost+L-NAME组大鼠mPAP升高34.24%(P<0.05);与L-arg组大鼠相比,L-arg+L-NAME组大鼠mPAP升高41.51%(P<0.05,见图1)。

#:vs Control,P<0.05; *:vs MCT,P<0.05; ▲:vs Ost,P<0.05; △:vs L-arg,P<0.05。 图1 Ost对大鼠肺动脉平均压的影响及L-NAME的拮抗作用(mean±SEM,n=5)
2.3 Ost对大鼠肺重指数的影响 与Control组相比,MCT组大鼠LI明显升高,是Control组的1.73倍(P<0.05);与MCT组相比,Ost组和L-arg组大鼠LI分别降低38.49%、44.84%(P<0.05);与Ost组相比,Ost+L-NAME组大鼠LI升高25.42%(P<0.05);与L-arg组大鼠相比,L-arg+L-NAME组大鼠LI升高24.52%(P<0.05,见图2)。

#:vs Control,P<0.05; *:vs MCT,P<0.05; ▲:vs Ost,P<0.05; △:vs L-arg,P<0.05。 图2 Ost对大鼠肺重指数的影响及L-NAME的拮抗作用(mean±SEM,n=5)
2.4 Ost对大鼠肺远端小动脉形态学的影响 H&E染色结果显示,MCT组代表性图片显示大鼠肺小动脉血管壁增厚且管腔狭窄明显,周围组织有炎性细胞的明显浸润;Ost组和L-arg组代表性图片显示肺小动脉血管壁增厚、管腔狭窄及周围组织炎性细胞的浸润等病理变化明显减轻;Ost+L-NAME组和L-arg+L-NAME组代表性图片显示肺小动脉的血管壁增厚、管腔狭窄明显,且伴随周围组织炎性细胞的明显浸润(见图3)。

标尺:50 μm,放大倍数:×400。A:Control; B:MCT; C:MCT+Ost; D:Ost+L-NAME; E:MCT+ L-arg; F:L-arg+L-NAME;图中箭头指向大鼠肺动脉。 图3 大鼠肺动脉形态学及L-NAME的拮抗作用
2.5 Ost对大鼠肺组织eNOS蛋白表达的影响 研究结果显示,与Control组相比,MCT组大鼠肺组织eNOS蛋白表达降低55.07%(P<0.05);与MCT组相比,Ost组和L-arg组大鼠肺组织eNOS蛋白表达均明显升高,分别是MCT组的1.40、1.44倍(P<0.05);与Ost组相比,Ost+L-NAME组大鼠肺组织eNOS蛋白表达降低54.50%(P<0.05);与L-arg组大鼠相比,L-arg+L-NAME组大鼠肺组织eNOS蛋白表达降低71.87%(P<0.05,见图4)。

#:vs Control,P<0.05; *:vs MCT,P<0.05; ▲:vs Ost,P<0.05; △:vs L-arg,P<0.05。 图4 Ost对肺组织eNOS蛋白表达的影响及L-NAME的拮抗作用(mean±SEM,n=4)
2.6 Ost对大鼠肺组织PKG-1蛋白表达的影响 研究结果显示,与Control组相比,MCT组大鼠肺组织PKG-1蛋白表达降低52.68%(P<0.05);与MCT组相比,Ost组和L-arg组大鼠肺组织PKG-1蛋白表达分别升高98.01%、97.94%(P<0.05);与Ost组相比,Ost+L-NAME组大鼠肺组织PKG-1蛋白表达降低34.39%(P<0.05);与L-arg组大鼠相比,L-arg+L-NAME组大鼠肺组织PKG-1蛋白表达降低45.16%(P<0.05,见图5)。
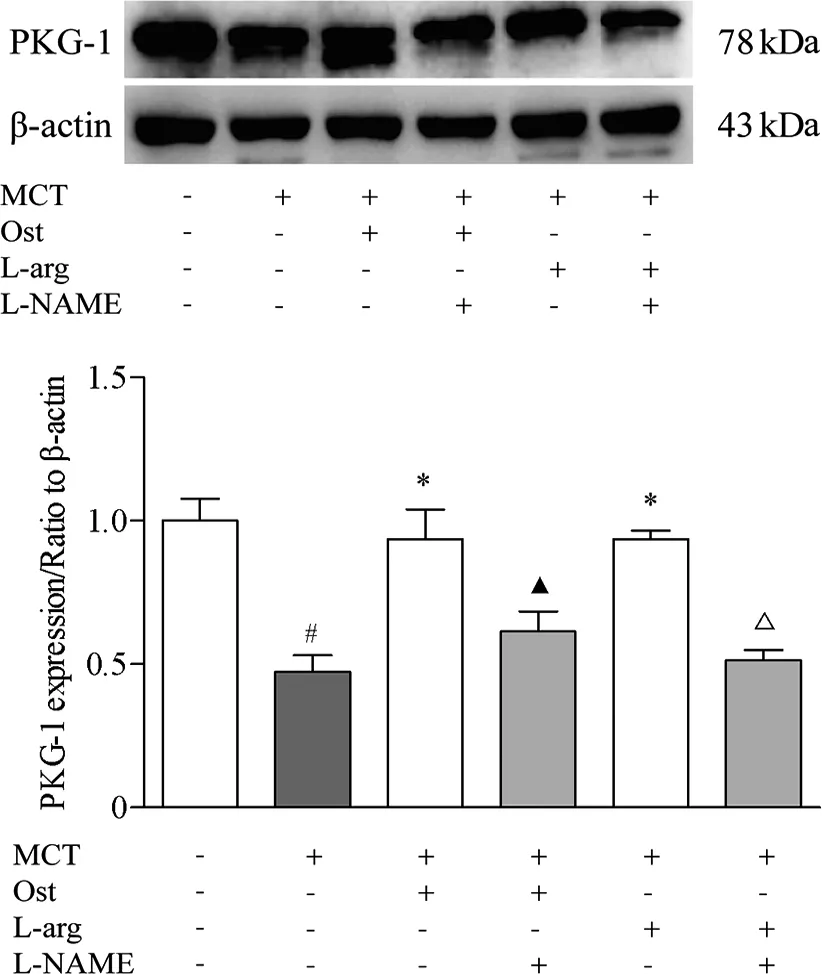
#:vs Control,P<0.05; *:vs MCT,P<0.05; ▲:vs Ost,P<0.05; △:vs L-arg,P<0.05。 图5 Ost对肺组织PKG-1蛋白表达的影响及L-NAME的拮抗作用(mean±SEM,n=4)
3 讨论
肺动脉高压(PAH)是一种危及生命的疾病,以肺小动脉重构、肺动脉阻力增加为主要特征。MCT经肝脏转化并进入肺组织引起肺血管内皮细胞损伤,导致肺小动脉重构,进而引起肺动脉压升高[9]。一次性颈背部皮下注射MCT诱导的肺动脉高压模型,操作简单,2周左右即可成模,是常用来研究PAH的病理模型。L-arg是体内NO的供体,文献报道L-arg可上调大鼠血浆中NO水平[10]。本研究结果显示,MCT组大鼠毛发较为毛糙、呼吸急促、活动减少;mPAP、LI和肺小动脉血管病理形态学等变化均提示本研究PAH模型建立成功。与MCT组相比较,Ost组大鼠毛发较为光滑、呼吸较为平稳;mPAP和LI明显降低;MCT所致的肺小动脉血管壁增厚、管腔狭窄的病理变化有所改善;阳性药L-arg组大鼠的上述变化与Ost组一致。而给予eNOS的抑制剂——L-NAME能拮抗Ost、L-arg的以上作用。
NO是一种内源性小气体分子,研究表明NO能够舒张血管,抑制血管平滑肌细胞增殖,目前临床已应用吸入性NO治疗PAH[11-12]。血浆内的NO由eNOS催化底物L-arg生成NO,NO扩散进入肺动脉平滑肌细胞内,激活鸟苷酸环化酶,使cGMP生成增加,激活PKG-1,降低细胞内Ca2+浓度,产生扩张肺小动脉和抑制肺动脉平滑肌细胞异常增殖等作用。有文献报道,在MCT诱导的大鼠PAH模型中,肺组织eNOS和PKG-1的蛋白表达明显降低[13-14],这与本研究MCT组大鼠肺组织eNOS和PKG-1蛋白的变化一致。Lee等[15]发现利拉鲁肽通过上调肺组织eNOS、PKG的蛋白表达,对MCT诱导的大鼠mPAP升高、肺小动脉血管腔狭窄等有改善作用。有研究显示,在野百合碱诱导的大鼠肺动脉高压模型中,iNOS表达上调,eNOS表达下调,而L-arg可上调eNOS蛋白的表达,下调iNOS蛋白的表达,恢复eNOS和iNOS平衡,产生扩张肺小动脉血管等作用从而改善肺动脉高压[16]。值得注意的是,本研究给予Ost、L-arg处理后发现,Ost、L-arg能抑制MCT所致大鼠肺组织eNOS和PKG-1蛋白表达的明显下调;而eNOS的抑制剂L-NAME能抑制Ost、L-arg对MCT所致大鼠肺组织eNOS和PKG-1蛋白表达的明显上调。
综上,本研究揭示了Ost通过上调eNOS/PKG-1通路改善MCT诱导的大鼠PAH。

