超声引导下喉上神经阻滞用于支撑喉镜下声带息肉摘除术中的效果
何敏,吴立
昆山市第一人民医院麻醉科,江苏苏州 215300
支撑喉镜下声带息肉摘除术是一种临床耳鼻喉科常见的手术方法,该术式用时较短,效果明显[1],但支撑喉镜置入及相关手术操作容易导致患者血压、心率提升,因此需要保证麻醉具有一定的深度及声带固定处理的合理性[2]。相关临床研究显示,通过喉上神经阻滞的方法能够降低喉镜下声带息肉摘除术血管不良反应发生率[3],传统的喉上神经组织方法具有一定的局限性,并不适用于肥胖患者、颈部活动受限患者,这类患者使用该方法不容易触及舌骨大角,并且穿刺进入血管和周围组织容易造成一定的损伤。现如今随着医疗技术的不断发展,超声在外周神经阻滞中的应用愈发广泛,通过该方法能够全面显示喉上神经周围结构[4],在可视前提下使用该方法效果理想,能够减少并发症发生风险。 基于此, 该研究将2017年1月—2019年12月在该院接受支撑喉镜下声带息肉摘除术的50 例患者作为研究对象, 对超声引导下喉上神经阻滞用于支撑喉镜下声带息肉摘除术中的效果展开分析,现报道如下。
1 资料与方法
1.1 一般资料
研究对象为在该院接受支撑喉镜下声带息肉摘除术的50 例患者, 按照入院先后顺序将其分为对照组(25 例)和观察组(25 例)。 对照组男12 例,女13例;年龄42~61 岁,平均(50.6±4.3)岁;平均体质量(58.3±9.5)kg;ASAⅠ级10 例,ASAⅡ级15 例; 平均手术时间(12.1±4.3)min。观察组男11 例,女14 例;年龄42~61 岁,平均(50.3±4.5)岁;平均体质量(58.8±9.8)kg;ASAⅠ级11 例,ASAⅡ级14 例; 平均手术时间(12.5±4.9)min。 两组患者性别、年龄、平均体质量、ASA 分级及手术时间等一般资料比较,差异无统计学意义(P>0.05),具有可比性。 纳入标准:接受支撑喉镜下声带息肉摘除手术;自愿参加该研究,且签署知情同意书。排除标准:合并其他严重脏器疾病患者;具有严重精神、意识障碍患者。 该次研究通过该院伦理委员会审核。
1.2 方法
术前30 min 对患者肌内注射阿托品(国药准字H12020382)0.5 g,进入手术室后帮助患者保持仰卧位,对其进行无创心电监护,双侧喉上神经阻滞后10 min对患者进行静脉麻醉诱导插管。观察组喉上神经阻滞药物为1%利多卡因(国药准字H20065388),对照组喉上神经阻滞药物为2%利多卡因。 观察组通过超声引导对喉上神经进行定位,观察组通过传统定位方法进行喉上神经阻滞麻醉。诱导药物:咪达唑仑(国药准字H10980025)、丙泊酚(国药准字H20123138)、瑞芬太尼(国药准字H20030198)、顺式阿曲库铵(国药准字H20090202)、地塞米松(国药准字H37020289),剂量分别为0.05 mg/kg、2.5 mg/kg、2 μg/kg、0.2 mg/kg、10 mg,麻醉维持使用丙泊酚和瑞芬太尼,将BIS 保持在40~60。 完成手术后将支撑喉镜取出时停止使用麻醉维持药物。 手术通过1 名临床医师完成,麻醉通过1名麻醉医师完成,麻醉护理人员负责记录相关指标。
1.3 观察指标
记录两组患者治疗各时间段的心率(HR)、平均动脉压(MAP)、血氧饱和度(SpO2),各时间段分别为入室时(T0)、气管插管进入声门时(T1)、支撑喉镜置入成功时(T2)、支撑喉镜置入成功后5 min(T3)、拔管时(T4)、拔管后5 min(T5)。 抽取全部患者静脉血择本, 使用放射免疫法对血浆中去甲肾上腺素(NE)浓度进行测定。比较两组拔管时间及拔管后不良反应发生率,常见的不良反应包括吞咽困难、呼吸困难等。
1.4 统计方法
采用SPSS 21.0 统计学软件分析数据,计量资料用(±s)表示,比较采用t 检验,计量资料采用[n(%)]表示,比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者不同时间点HR 及MP 对比
观察组T0、T5 HR 均低于对照组,但差异无统计学意义(P>0.05);T1~4,观察组HR 均低于对照组,差异有统计学意义(P<0.05)。 观察组T0 MAP 低于对照组, 但差异无统计学意义(P>0.05);T1~5, 观察组MAP 均低于对照组,差异有统计学意义(P<0.05)。 见表1、表2。
表1 两组患者不同时间点HR 对比[(±s),次/min]
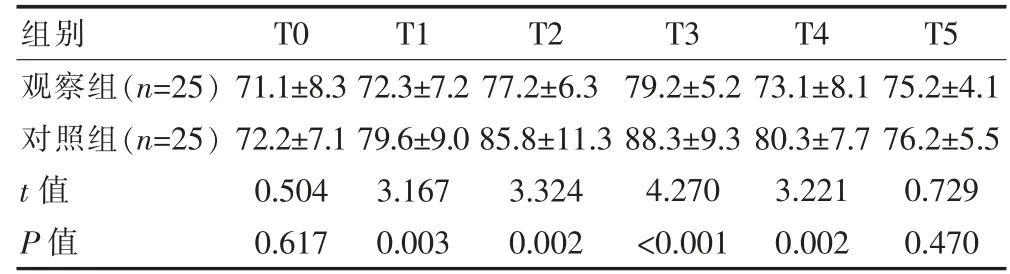
表1 两组患者不同时间点HR 对比[(±s),次/min]
组别T0 T1 T2 T3 T4 T5观察组(n=25)对照组(n=25)t 值P 值71.1±8.3 72.2±7.1 0.504 0.617 72.3±7.2 79.6±9.0 3.167 0.003 77.2±6.3 85.8±11.3 3.324 0.002 79.2±5.2 88.3±9.3 4.270<0.001 73.1±8.1 80.3±7.7 3.221 0.002 75.2±4.1 76.2±5.5 0.729 0.470
表2 两组患者不同时间点MAP 对比[(±s),mmHg]
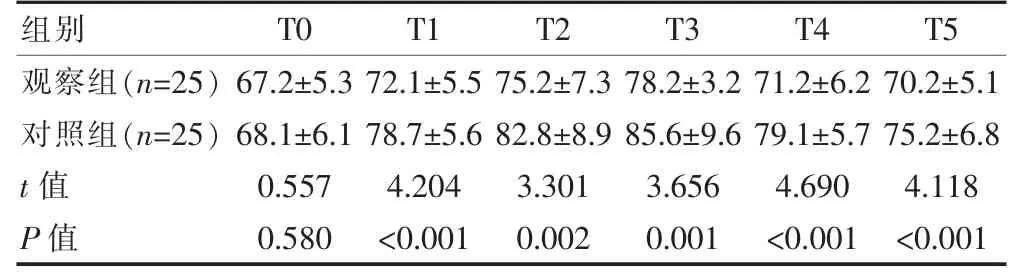
表2 两组患者不同时间点MAP 对比[(±s),mmHg]
组别T0 T1 T2 T3 T4 T5观察组(n=25)对照组(n=25)t 值P 值67.2±5.3 68.1±6.1 0.557 0.580 72.1±5.5 78.7±5.6 4.204<0.001 75.2±7.3 82.8±8.9 3.301 0.002 78.2±3.2 85.6±9.6 3.656 0.001 71.2±6.2 79.1±5.7 4.690<0.001 70.2±5.1 75.2±6.8 4.118<0.001
2.2 两组患者不同时间点血浆NE 对比
和对照组对比,观察组T1~T5 的血浆NE 浓度明显降低,差异有统计学意义(P<0.05)。 见表3。
表3 两组患者不同改时间点血浆NE 对比[(±s),ng/mL]
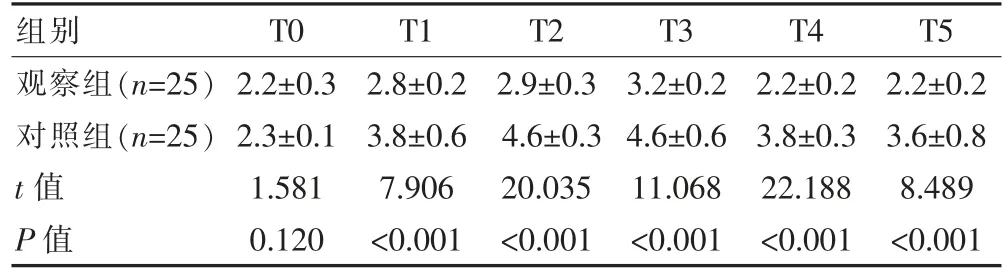
表3 两组患者不同改时间点血浆NE 对比[(±s),ng/mL]
组别T0 T1 T2 T3 T4 T5观察组(n=25)对照组(n=25)t 值P 值2.2±0.3 2.3±0.1 1.581 0.120 2.8±0.2 3.8±0.6 7.906<0.001 2.9±0.3 4.6±0.3 20.035<0.001 3.2±0.2 4.6±0.6 11.068<0.001 2.2±0.2 3.8±0.3 22.188<0.001 2.2±0.2 3.6±0.8 8.489<0.001
2.3 两组患者拔管时间及不良反应发生率对比
观察组和对照组的插管时间分别为(10.3±5.1)min和(16.7±3.4)min,观察组明显短于对照组,差异有统计学意义(t=5.221,P<0.001)。 观察组未出现任何并发症例数, 对照组出现2 例吞咽困难及1 例呼吸困难,并发症发生率为12.00%,两组并发症发生率对比,差异无统计学意义(χ2=3.192,P=0.074)。
3 讨论
通常情况下,支撑喉镜下声带息肉摘除术中喉镜置入及相关操作具有有创性,对患者咽喉部位产生较大刺激,会导致血流动力学发生严重改变,导致患者血压和心率持续上升, 进而导致心血管不良反应出现,但是该术式用时较短通常为10 min 左右,因此需要一定的麻醉深度才能减少不良反应发生风险。
超声引导下喉上神经组织方法:使用高敏线阵探头,将其横放于甲状软骨上方,暴露舌骨,向后移动另一侧发现舌骨大角和同侧甲状舌骨膜,在舌骨大角及甲状舌骨膜之间能够发现喉上动脉搏动,喉上动脉附近神经结构便是喉上神经[5]。 通过5mL 注射器针头超声引导平面技术穿刺, 将3 mL 麻醉药物注射在喉上神经下方,对药物扩散现象进行严密观察。 喉上神经阻滞,触及舌骨大角及甲状软骨角,使用5 mL 注射剂在舌骨大角和甲状软骨角中点位置进针,存在落空感后回抽无血时注射麻醉药物,剂量为3 mL。 对侧穿刺采用相同的方法[6]。喉上神经为迷走神经的一部分,通过结状神经节下缘产生,可分为内支和外支,内支通过甲状舌骨膜入喉, 对舌根及喉部黏膜感觉形成支配,外支对环甲肌和咽下缩肌运动进行支配[7]。通过超声引导喉上神经组织能够全面观察喉上神经周围结构情况,弥补传统方法的局限性,降低穿刺血管发生率,提高阻滞成功效果[8]。
支撑喉镜置入过程中刺激性较强会导致血浆儿茶酚胺迅速升高,相关研究显示喉上神经阻滞对于清醒经鼻插管[9]及食管异物取出术[10]均具有良好的效果,能够抑制插管和支撑喉镜置入过程中出现的不良反应。该次研究结果显示,相较于传统解剖定位方法,超声引导下喉上神经阻滞能够抑制声带息肉摘除术中插管及喉镜置入过程中产生的刺激, 循环较为稳定。 并且观察组拔管时间短于对照组,主要原因为超声引导下喉上神经阻滞效更好,能够减少术中使用药物[11]。 因为手术用时较短,2%利多卡因双侧喉上神经阻滞使患者存在不良反应,如吞咽障碍、呼吸困难等,风险较大。 该次研究结果显示,1%利多卡因的安全性更强,同卢希等[12]关于利多卡因双侧喉上神经阻滞联合静脉全麻的方法安全性更好的结论一致。其研究结果显示 观察组支撑喉镜置入成功时MAP(74.6±5.3)mmHg 明显低于对照组(80.2±8.3)mmHg(P<0.05),与该次研究结果相同, 观察组支撑喉镜置入成功时MAP (75.2±7.3)mmHg 明显低于对照组(82.8±8.9)mmHg(P<0.05)。
综上所述,对支撑喉镜下声带息肉摘除术患者来说, 采用超声引导下1%利多卡因双侧喉上神经阻滞联合静脉全麻的方法效果最为理想,能够减少不良反应发生风险,减少拔管时间,具有一定的安全性,值得临床采纳。

