电针对帕金森病模型小鼠纹状体背侧的c-Fos表达的选择性调节
粟文婷 於佳楠 贾 军 王晓民,*
(1. 首都医科大学脑重大疾病研究中心 北京脑重大疾病研究院 北京市脑重大疾病重点实验室——省部共建国家重点实验室培育基地 脑重大疾病防治省部共建协同创新中心,北京 100069; 2. 首都医科大学基础医学院神经生物学系,北京 100069; 3. 首都医科大学基础医学院生理学与病理生理学系,北京 100069)
帕金森病(Parkinson’s disease,PD)是最常见的中老年神经退行性疾病之一,其典型的病理特征为黑质多巴胺能神经元的病变缺失,出现了肢体震颤、运动迟缓、肌僵直以及姿势异常等运动障碍[1]。目前,针灸作为一种替代疗法,在特定穴位上实施手针或电针(electroacupuncture,EA)刺激,能缓解PD患者和PD动物模型的运动障碍[2-3]。在笔者团队多年的EA治疗PD的基础转化研究中,充分证实了EA能有效改善PD模型的运动症状[4-11]。其中,在双侧的“足三里”和“三阴交”两个穴位实施4周的100 Hz EA治疗,可以有效改善6-羟基多巴胺(6-hydroxydopamine,6-OHDA)单侧损伤PD小鼠模型的运动障碍[9]。然而,外周穴位的EA刺激是否能影响到脑内神经元的活动,以及这种影响是否关联着其对运动功能的改善,尚未研究清楚,而这正是阐述EA作用机制的基本问题。原癌基因c-fos是一种早期激活基因,其表达的蛋白c-Fos被用来作为神经元活性的标志[12]。目前在多种疾病模型中已有报道[13],EA可以调控神经元c-Fos的表达;但EA对与运动环路相关核团神经元的调控效应目前尚未见报道,这可能是其对PD具有调节效应的神经基础。因此,本研究选取脑内涉及运动调控的主要输入核团——纹状体作为研究对象,通过“足三里”和“三阴交”穴位实施电针刺激后,检测纹状体内神经元c-Fos蛋白的表达,揭示电针对PD小鼠纹状体神经元活性的调控效应,试图阐述EA改善PD运动障碍的作用基础。
1 材料与方法
1.1 主要药品与试剂
6-羟基多巴胺(6-hydroxydopamine,6-OHDA,H116)、阿扑吗啡(apomorphine, APO,A4393)、酪氨酸羟化酶(tyrosine hydroxylase,TH,鼠抗, SAB4200699)抗体购于美国Sigma-Aldrich公司;c-Fos (兔抗,ABE457)抗体购于美国Millipore公司;ABC免疫组化试剂盒(PK-4002)购于美国Vector Laboratories公司;DAB显色液购于中国中杉金桥公司。
1.2 实验动物
C57BL/6小鼠(6~8周龄,20~25 g,雄性)购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2016-0008,实验动物的使用遵循医学实验动物管理实施细则(1998年卫生部令第55号)以及首都医科大学实验动物管理细则。小鼠饲养于首都医科大学实验动物部,每笼最多5只,可自由进食和饮水,提供12 h/12 h的明/暗饲养环境。所有涉及实验动物的实验流程和操作都经过首都医科大学伦理审查委员会批准,伦理审批号:AEEI-2018-044。
1.3 主要仪器
立体定位仪(Kopf公司,德国)、电针仪(HANS-1008,韩氏疼痛治疗仪,中国)、动物行为学分析系统(SuperMaze,上海欣软信息科技公司)、冰冻切片机(CM 3050S,Leica公司,德国)、玻片扫描仪(Pannoramic scan,3DHISTECH公司,匈牙利)、正置荧光显微镜(BX51, Olympus公司,日本)。
1.4 实验方法
1.4.1 6-OHDA单侧损伤的PD小鼠模型制备
腹腔注射戊巴比妥钠麻醉小鼠,将其头部置于立体定位仪固定。根据前囟、后囟的位置,在右侧纹状体内进行药物的双位点注射:AP=+0.5 mm,ML=-2.0 mm,DV=-3.0 mm和-2.0 mm;每个位点注射6-OHDA 0.78 μL(5.14 g/L)。对照组小鼠注射等体积的0.9%(质量分数)氯化钠注射液(以下简称生理盐水)。2周后,用APO诱导的旋转行为来筛模。净旋转圈数为向左侧旋转圈数减去向右侧旋转圈数。30分钟内,净旋转圈数达到2 r/min以上的小鼠,视为造模成功的单侧PD模型[14]。
1.4.2 电针方法
APO筛模后,将对照和PD小鼠采用抽签法随机各分为两组,分别为对照组(Sham)、对照电针组(Sham+EA)、模型组(Model)和模型电针组(Model+EA)。Sham+EA组和Model+EA组小鼠于“足三里”(ST36,膝关节后外侧、腓骨小头下约2 mm)和“三阴交”(SP6,内踝尖上部2 mm,胫骨后缘)接受电针刺激,刺激频率为100 Hz,刺激电流强度逐步递增,分别为1.0、1.2、1.4 mA各10 min,总电针时间30 min。刺激完成后90 min灌流取材,进行后续的免疫组化实验。
1.4.3 TH和c-Fos蛋白检测
小鼠用戊巴比妥钠麻醉,依次心尖灌流生理盐水和4%(质量分数)多聚甲醛,脑组织经脱水处理后OCT包埋,用冰冻切片机分别选取包含纹状体和黑质的部位进行冠状连续切片,厚度为40 μm;每隔5张取1张脑片进行c-Fos或TH免疫组化实验,依次经c-Fos抗体(1∶1 000)或TH抗体(1∶2 000)、ABC免疫组化试剂盒中的二抗和A、B液孵育后,用DAB显色液避光显色。
黑质和纹状体的TH染色用正置荧光显微镜拍摄。c-Fos染色切片用玻片扫描仪扫描,用CaseViewer 2.1.2 (3DHISTECH公司,匈牙利)软件分别在双侧纹状体的背侧和腹侧截取一个长方形区域(0.85 mm×0.46 mm),在双侧的扣带回皮质也截取一个长方形区域(0.46 mm×0.24 mm),再用Image-Pro Plus 6.0(Media Cybernetics公司,美国)统计各截取区域内c-Fos的阳性细胞数。
1.5 统计学方法
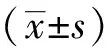
2 结果
2.1 6-OHDA右侧损伤PD小鼠模型的建立
造模手术实施2周后,用APO诱导的旋转行为筛选出的Model组小鼠净旋转圈数显著高于Sham组小鼠(P<0.001,图1A)。同时TH免疫组化的结果表明,Model小鼠右侧的黑质多巴胺能神经元及纹状体内TH阳性纤维的表达与左侧相比均减少(图1B),以上结果表明6-OHDA单侧损伤的PD小鼠模型建立成功。
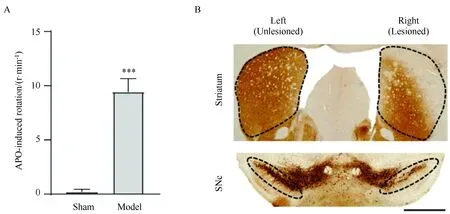
图1 小鼠单侧损伤PD模型的建立Fig.1 Establishment of the unilateral lesioned mice model of PDA: APO-induced rotation test; B: Representative tyrosine hydroxylase immunostaining images of striatum (up) and SNc (down) from a 6-OHDA unilaterally lesioned PD Model mouse. Scale bar=1 mm. The data were presented as unpaired t-test, ***P<0.001 vs Sham group, n=6. PD: Parkinson’s disease; SNc: substantia nigra pars compacta; APO: apomorphine; 6-OHDA: 6-hydroxydopamine.
2.2 EA对PD小鼠背侧纹状体c-Fos阳性细胞数量的影响
在左侧纹状体部位,Model组背侧纹状体内c-Fos阳性数目较Sham组有降低的趋势,但差异无统计学意义(图2);而EA刺激对Sham和Model组小鼠的c-Fos阳性细胞数目未产生明显的调控作用。在右侧纹状体,Model组背侧纹状体区域内c-Fos阳性数目较Sham组明显降低(P<0.001,图2B),EA刺激有效地增加了Model组小鼠此区域内c-Fos表达的阳性细胞数目(P<0.05,图2B),却并未影响Sham小鼠该区域内c-Fos的表达。
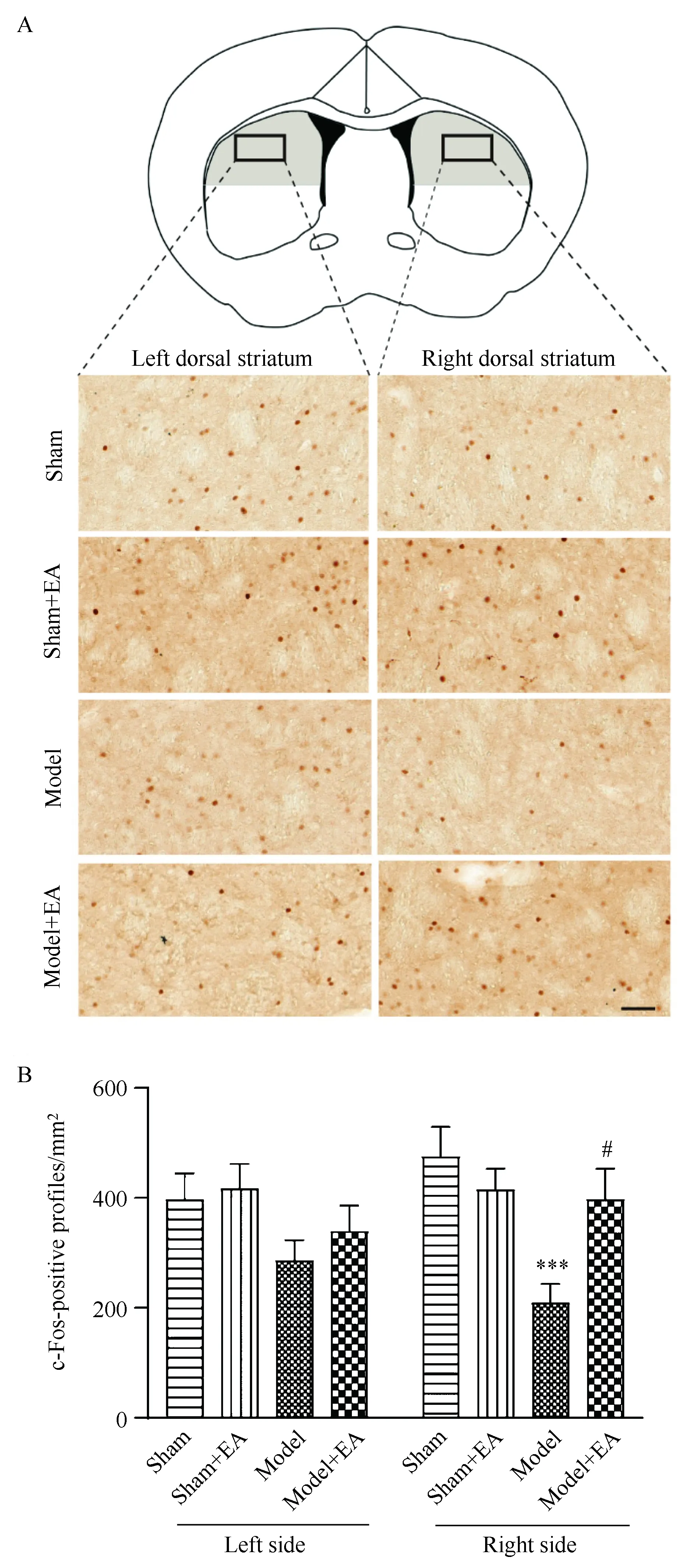
图2 EA对背侧纹状体c-Fos阳性细胞数量的影响Fig.2 The effect of EA on the c-Fos positive profiles in dorsal striatumA: Up, the schematic diagram of coronal slice containing striatum and cingulate cortex, the black box represents the selected area in dorsal striatum (gray region). Down, representative c-Fos immunostaining images of left and right dorsal striatum from Sham,Sham+EA,Model and Model+EA group mice. Scale bar=50 μm. B: c-Fos positive profiles per mm2 in left and right dorsal striatum. The data were presented as one-way ANOVA analysis, ***P<0.001 vs Sham group, #P<0.05 vs Model group, n=16 slices/3 mice. EA: electroacupuncture.
2.3 EA对PD小鼠腹侧纹状体c-Fos阳性细胞数量的影响
在左侧纹状体, Model组腹侧部位的c-Fos阳性细胞数量与Sham组相比差异无统计学意义,EA刺激虽有增加Model组小鼠该部位c-Fos阳性细胞数量的趋势,但差异无统计学意义。在右侧纹状体,Model组腹侧部的c-Fos阳性细胞数量较Sham组有下降的趋势,同样差异无统计学意义,但EA刺激适度上调了Model组小鼠此区域内的c-Fos阳性细胞数量(P<0.05,图3)。

图3 EA对腹侧纹状体c-Fos阳性细胞数量的影响Fig.3 The effect of EA on the c-Fos positive profiles in ventral striatumA: Up, the schematic diagram of coronal slice containing striatum and cingulate cortex, the black box represents the selected area in ventral striatum (gray region). Down, representative c-Fos immunostaining images of left and right ventral striatum from Sham, Sham+EA, Model and Model + EA group mice. Scale bar=50 μm. B: c-Fos positive profiles per mm2 in left and right ventral striatum. The data were presented as one-way ANOVA analysis, #P<0.05 vs Model group, n=16 slices/3 mice. EA: electroacupuncture.
2.4 EA对PD小鼠扣带回皮质的c-Fos阳性细胞数量的影响
实验显示,无论是左侧还是右侧,Model组小鼠c-Fos阳性细胞数量与Sham组相比差异均无统计学意义,EA刺激虽然对Sham和Model组小鼠均有上调c-Fos阳性细胞数量的趋势,但差异无统计学意义(图4)。

图4 EA对扣带回皮质c-Fos阳性细胞数量的影响Fig.4 The effect of EA on the c-Fos positive profiles in cingulate cortexA: Up, the schematic diagram of coronal slice containing striatum and cingulate cortex, the black box represents the selected area in cingulate cortex (gray region). Down, representative c-Fos immunostaining images of left and right cingulate cortex from Sham, Sham+EA, Model and Model+EA group mice. Scale bar=50 μm. B: c-Fos positive profiles per mm2 in left and right cingulate cortex. The data were presented as one-way ANOVA analysis, n=16 slices/3 mic. EA: electroacupuncture.
3 讨论
经典的基底节(basal ganglia, BG)环路放电模型常用于解释PD运动症状的发生[15-16]。该理论认为,PD病变中从黑质输入到纹状体内DA投射的丢失,使得纹状体内直接通路与间接通路活动失衡而导致了PD运动障碍的发生。纹状体作为基底节的主要输入核团,主要接受黑质的多巴胺以及运动皮质的谷氨酸投射;同时,核团内的中型棘突神经元又通过γ-氨基丁酸将整合的信号分别沿直接通路和间接通路向下游传递。因此,纹状体是负责运动控制的基底神经节中“承上启下”的关键核团,也是PD发病和治疗机制研究中的重要靶点[17-18]。
EA在治疗PD的临床和基础研究中都显示出良好的疗效。临床研究[3]显示,针灸能够有效地缓解PD患者的临床症状,包括EA治疗可促进PD患者主观症状的好转及客观运动评分的增加[19],并可降低药物的服用剂量[20]。基础研究[4-10]也证实,EA能有效改善PD动物模型的运动症状,涉及的治疗机制包括增强神经营养因子表达[4]、抑制炎症反应[8]、抗氧化应激[5,7],以及调整递质平衡[6, 9-10]等。然而,这些研究尚未直接探究EA对运动控制密切相关的纹状体神经元的反应性。因此,本研究通过考察单次EA对纹状体神经元活性的影响有利于阐述EA治疗PD的作用机制。
原癌基因c-fos是中枢神经系统中广泛存在的一种即刻早期基因,其编码的c-Fos蛋白常被用来表征神经元的活性[12]。在本研究的 PD模型中,笔者发现Model组小鼠未损伤侧纹状体c-Fos表达较Sham小鼠差异无统计学意义,但在损伤侧纹状体背侧的c-Fos表达表现为显著的下降,表明其神经元活性的下调。
EA能调节神经元c-fos基因的表达,已经在多种疾病模型中得到了证实[21-24],这可能是EA发挥功效的最基本的生理基础。本研究所建立的PD模型中,背侧及部分腹外侧是右侧纹状体主要损伤的部位,此区域c-Fos表达的降低,而EA有效增加了Model小鼠损伤背侧和腹侧纹状体c-Fos的表达,表明神经元活性被EA激活。因此,本实验提示了PD模型小鼠纹状体内由于多巴胺投射减少而引起纹状体区域内神经元的活性降低,电针可以特异性地提高纹状体背侧和腹侧神经元的活动,促使其功能状态的改善,进而可能通过蓄积效应在慢性的电针治疗中得以缓解PD的运动障碍。但是,对未损伤侧纹状体c-Fos阳性细胞的检测却并未发现明显异常,EA刺激也未见明显的调节作用,进一步提示EA可以选择性改善损伤区纹状体神经元的功能活动。
为了全面比较电针的效应,本团队也检测了EA对扣带回皮质的c-Fos表达。扣带回的功能主要是与认知和情感相关[25]。在本实验中笔者发现该区域内的表达未出现明显改变,而EA刺激也没有对扣带回的神经元产生明显的调控。因此,EA刺激呈现出一种与损伤相关联的区域调控。此外,有报道[26-28]显示,APO和L-dopa可以增加6-OHDA模型损伤侧纹状体内神经元的活动,同时也明显的特异性增强了损伤侧纹状体c-Fos蛋白的表达水平,与EA的作用相似。
综上所述,本研究以纹状体内神经元的c-Fos反应性为研究切入点,证明了EA能对损伤区域神经元活性进行特异性调控,此研究结果有利于更深入地理解EA对PD的治疗机制。但是,EA对纹状体内神经元活性的调控在直接通路和间接通路上是否存在差异,还有待更进一步的研究。

