rmIL-4和rmGM-CSF联合应用诱导小鼠骨髓造血干细胞向树突状细胞分化的结果
赵商岐,夏开德,武娟,周彦霞,刘玉武,周文涛,周晓涛
1新疆医科大学基础医学院免疫学教研室,乌鲁木齐830011;2贵阳市妇幼保健院;3新疆医科大学第五附属医院
抗原提呈细胞(APC)是抗原进入机体后引发免疫反应的第一关[1],其中,树突状细胞(DC)是机体功能最强的APC,起源于造血干细胞[2]。DC功能的发挥与自身的活化与成熟密不可分[3]。DC包括未成熟DC、成熟DC,在免疫反应中作用不同。未成熟DC有较强的抗原内吞和加工处理能力,而成熟DC则高表达MHC-Ⅱ类分子及共刺激分子CD86等[4],具有较强的抗原提呈能力,能够特异性激活初始T细胞。近几年,在病原体感染免疫及相关疫苗研制等领域对DC功能的研究越来越多[5]。然而,DC在外周组织中含量极低,体外分离难以获得大量的DC,需要建立成熟的DC诱导培养技术,以获得高纯度的DC。2021年4—6月,本研究联合应用rmIL-4和rmGM-CSF诱导培养小鼠骨髓造血干细胞向DC分化,并进行细胞形态学、表型、抗原捕获能力鉴定,现将结果报告如下。
1 材料与方法
1.1 小鼠、试剂及仪器 SPF级C57小鼠,6~8周,体质量17~23 g,购于新疆医科大学实验动物中心。RPMI-1640培养基购自Hyclone公司,胎牛血清购自BI公司,1%青链霉素购自Hyclone公司,红细胞裂解液购自北京索莱宝科技有限公司,重组小鼠白细胞介素-4(rmIL-4)、重组小鼠粒细胞巨噬细胞集落刺激因子(rmGM-CSF)购自Peprotech公司,流式单克隆抗体CD11c+、CD86+、CD45+配体、Ⅰ-Ab与anti-HIS Tag抗体购自BD biosciences公司,HISEgG1Y162抗原由本实验室储存。高速台式低温离心机购自德国Eppendorf公司,电泳仪购自美国Bio-Rad公司,电泳槽购自SUB-CELL GT公司,温控摇床购自上海精密实验设备有限公司,凝胶成像仪购自BIO-RAD公司,CO2培养箱购自美国Thermo公司,超净工作台购自中国Heal Force公司,光学显微镜购自日本奥林巴斯公司,倒置显微镜购自德国LEICA公司,流式细胞仪购自美国BD公司,高速冷冻离心机购自德国Eppendorf公司。
1.2 小鼠骨髓造血干细胞来源DC的诱导方法取6~8周的C57小鼠,颈椎脱臼法处死,浸入75%的乙醇中10 min,无菌条件下剥除肌肉组织,取出股骨和胫骨,将股骨和胫骨浸入70%的乙醇中0.5 min,浸泡2次,用PBS缓冲液洗去乙醇,重复4次。剪去股骨和胫骨两端,用5 mL的注射器吸取5 mL PBS缓冲液后插入骨骺,用力推出骨髓,反复冲洗直至骨变白。用移液枪反复吹打冲洗下来的骨髓至细胞完全分散,然后用无菌200目滤网过滤细胞到15 mL离心管中,除去组织碎片,1 000 r/min离心5 min,弃上清,加入3 mL红细胞裂解液,轻轻混匀,4℃裂解10 min;加PBS缓冲液至10 mL,终止红细胞裂解,室温下1 000 r/min离心5 min,弃上清。骨髓细胞用含10%FBS的RPMI-1640完全培养基悬浮,进行细胞计数,将细胞稀释为3×106/mL的细胞悬液,接种到6孔板中,每孔3 mL,同时加入终浓度20 ng/mL的rmIL-4和终浓度10 ng/mL的rmGMCSF,放置于37℃、5%CO2培养箱中培养,隔日半量换液。
1.3 小鼠骨髓造血干细胞来源DC的鉴定方法
1.3.1 细胞形态学观察 第0、3、8、12天时,取诱导完成的细胞培养液,在倒置显微镜下观察细胞形态及生长状况。
1.3.2 细胞表型鉴定 采用流式细胞术。诱导第0、6、12天时收集细胞,加入2 mL PBS缓冲液轻轻吹打混匀后,4℃条件下1 000 r/min离心5 min,弃上清,加入50μL含有1μL CD11c+抗体、1μL CD86+抗体与1μL CD45+配体抗体的PBS缓冲液,4℃避光孵育30 min;加入1 mL PBS缓冲液洗涤细胞,4℃条件下1 000 r/min离心5 min,收集细胞;加入300μL PBS缓冲液重悬细胞,70μm滤器过滤细胞悬液,使用流式细胞仪检测CD45+细胞数、CD11c+CD86+细胞数,计算CD45+的细胞中CD11c+CD86+细胞占比。
1.3.3 细胞抗原捕获能力鉴定及成熟度观察 诱导第6天时,收集细胞悬液培养于6孔板中,每孔加入500 ng/mL HIS-EgG1Y162抗原,分别于培养12、24 h后收集细胞悬液。取收集的细胞悬液,每管加入2 mL PBS缓冲液轻轻吹打混匀后,4℃条件下1 000 r/min离心5 min,弃上清,加入50μL含有1μL Anti-HiS Tag抗体、1μL CD86+抗体、1μL CD11c+、1μL CD45+抗体与1μLⅠ-Ab抗体的PBS缓冲液,4℃避光孵育30 min,加入1 mL PBS缓冲液洗涤细胞,4℃条件下1 000 r/min离心5 min,收集细胞,加入300μL PBS缓冲液重悬细胞,70μm滤器过滤细胞悬液,使用流式细胞仪检测细胞总数、结合HIS-EgG1Y162抗原的细胞数、CD45+细胞数、CD11c+CD86+细胞数、CD11 c+MHC-Ⅱ+细胞数,计算结合HIS-EgG1Y162抗原的细胞占比、CD45+的细胞中CD11c+CD86+细胞占比、CD45+的细胞中CD11c+MHC-Ⅱ+细胞占比。以结合HIS-EgG1Y162抗原的细胞占比表示细胞抗原捕获能力,以CD45+的细胞中CD11c+CD86+、CD11c+MHC-Ⅱ+细胞占比表示细胞成熟度。
1.4 统计学方法 采用SPSS22.0统计软件。计量资料以±s表示,比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态学变化 诱导第0、3、8、12天时的细胞形态见图1。由图1可见,诱导第0天时,细胞体积较小,形态规则,呈类圆形悬浮于细胞培养液中;诱导第3天时,细胞大小不一,形态不规则,少量细胞开始出现“伪足”,细胞成团生长且数量开始增多;诱导第8天时,细胞体积增大,细胞出现明显的“突触”,细胞呈多边形聚集于培养皿中央;诱导第12天时,细胞形态不规则,突触明显变长,集落细胞团形成。
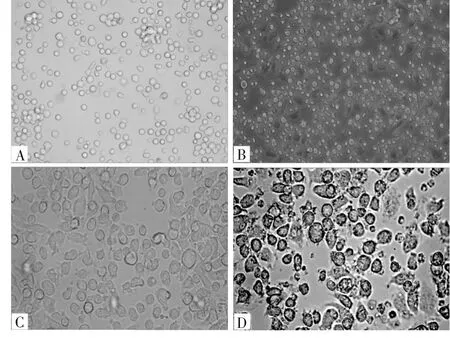
图1 诱导第0、3、8、12天时的细胞形态(×400)
2.2 细胞表型鉴定结果 诱导第0、6、12天时,CD45+的细胞中CD11c+CD86+细胞占比分别为1.170%±0.302%、6.120%±0.245%、16.000%±0.294%,两两比较,P均<0.05。
2.3 细胞抗原捕获能力鉴定结果及细胞成熟情况 诱导第6天时,加入HIS-EgG1Y162抗原共培养12 h后,结合HIS-EgG1Y162抗原的树突状细胞占比为1.760%±0.065%,CD45+的细胞中CD11c+CD86+、CD11c+MHC-Ⅱ+细胞占比分别为8.67%±0.38%、11.90%±0.49%。;加入HIS-EgG1Y162抗原共培养24 h后,结合HIS-EgG1Y162抗原的树突状细胞占比为13.400%±0.408%,CD45+的细胞中CD11c+CD8 6+、CD11c+MHC-Ⅱ+细胞占比分别为20.10%±0.29%、16.70%±0.24%;两者相比,P均<0.05。
3 讨论
DC广泛分布于全身除脑以外的各组织器官中,是生物体内主要的专职APC,在肿瘤免疫[6]、寄生虫感染与免疫应答中起重要作用[7-8]。DC的分化与成熟可分为4个阶段,据此可将其分为4类:前体细胞、未成熟的树突状细胞(imDC)、迁移期DC与成熟的树突状细胞(mDC)[9]。DC的前体细胞尚无表型及功能,但在细胞因子或感染情况下可转化为imDC。DC前体细胞向imDC转化过程中高表达与吞噬有关的膜受体,因此具有较强的抗原摄取及加工能力,可诱导与维持抗原特异性免疫耐受,为获得性免疫所必需[10]。经病原体刺激后,imDC发生迁移分化为mDC,失去吞噬相关受体,并高表达MHC-Ⅱ类分子及共刺激分子CD86等,可将抗原进一步呈递给初始T细胞,使之激活,从而启动细胞介导的免疫应答反应[11-12]。由于DC在体内血液及组织中含量极低,体外仅可存活数天,极大的限制了DC的研究,如何建立成熟的DC诱导培养技术、获得大量的DC已成为开展免疫学相关实验的基础。
目前,获得DC的方法主要有梯度离心法[13]与诱导扩增法。梯度离心法是从外周血中利用免疫磁珠或流式细胞仪等方法分离DC,此方法获得的DC纯度高,但是细胞数量少,分离的DC处于不同的分化阶段,而且一旦单抗选择不当,很容易丢失部分DC。诱导扩增法可用细胞因子体外诱导不同来源的前体细胞获得DC。研究[14]表明,GM-CSF在DC培养中可促进单核细胞向巨噬样细胞分化,增强抗原提呈能力,IL-4可抑制单个核细胞分化为中性粒细胞及巨噬细胞,从而引导单核细胞向DC分化,因此经GM-CSF和IL-4体外诱导外周血、脾脏等器官来源的前体细胞,可沿不同的分化途径扩增为DC;但是,脾脏及外周血来源的DC不仅产量少且诱导周期长,无法满足实验对DC数量及功能的需求。于是,我们通过体外分离小鼠骨髓来源的造血干细胞经rmGM-CSF和rmIL-4联合诱导,从而获得骨髓来源的DC。因骨髓来源的前体细胞具有含量多、取材方便等优点,经诱导扩增可获得大量高纯度的DC。
与其他免疫细胞不同,DCs是一类具有不同分化阶段的异质细胞群,且各阶段具备差异性细胞形态及免疫功能。本研究发现,在DC诱导培养中,倒置显微镜下可见初时细胞体积较小,呈类圆形悬浮于细胞培养液中。在诱导第3天时,少量细胞开始出现“伪足”,细胞成团生长且数量开始增多。在诱导第8天时,细胞体积增大,细胞出现明显的“突触”聚集于培养皿中央。在诱导第12天时,突触明显变长,集落细胞团形成,已基本具备典型的DC形态。CD11c高表达于髓系DC表面。本研究发现,在诱导DC细胞分化过程中,随着诱导天数的增加,CD45+的免疫细胞中,CD11c+CD86+细胞明显增高,表明此体外诱导培养方法可获得大量高纯度的小鼠骨髓造血干细胞来源的DC。在病原体感染的免疫应答中,DC在抗原刺激下可分化为成熟DC,并诱导T细胞应答反应。DC的功能状态在一定程度上反应了机体免疫应答能力,并且随着DCs的发育成熟,捕获抗原的能力逐渐下降,因此我们收集诱导第6天的DC,将细粒棘球绦虫特异性抗原HIS-EgG1Y162与DC共培养,通过流式细胞术分析DC表面的蛋白结合情况从而检测DC的抗原捕获能力,发现随着与抗原共培养时间的延长,DC的蛋白结合百分率明显增强,此外,在大量抗原刺激下,成熟DC百分率也随之增高。
综上所述,本研究使用rmIL-4和rmGM-CSF刺激小鼠骨髓造血干细胞,获得了不同分化阶段的DC,且获得的成熟DC具有较强的抗原捕获能力,这为后期开展DC相关的免疫学实验研究奠定了基础。

