基于聚(N-异丙基丙烯酰胺)的温度响应型可注射水凝胶的制备及其性能研究
*潘穗萍 陶倩 王怡婷
(鲁东大学化学与材料科学学院 山东 264025)
水凝胶通常是柔软的固体材料,具有三维网状结构,其网络中的孔隙使得水凝胶能够保存大量的溶液,有利于传递和运输生物分子、营养物质以及细胞生理活动过程中的代谢废物。然而预制成型的水凝胶在组织工程应用中会遇到很多问题,如手术过程复杂、创伤面积较大、凝胶形状不能与缺损处完全吻合等。可注射凝胶可以有效避免这些问题,因为它在进入人体之前处于低粘度的流体状态,进入人体之后通过某种物理或化学变化快速原位转变为非流动的凝胶状态[1-2]。目前已经报道了多种基于不同机理的可注射凝胶[3-4],其中利用手术环境和人体的温度差异设计出来的温度响应型水凝胶因其组分简单、安全低毒、操作简便等优势而备受瞩目[5-6]。
温度响应型材料的研究和发展比较广泛,其中的典型代表是聚(N-异丙基丙烯酰胺)(PNIPAAm),它的最低临界温度(LCST)接近且略低于人体体温,在37℃环境中能够快速发生相转变[7]。然而仅依靠PNIPAAm并不能构成三维网状结构,同时其力学性能和其它功能也难以调控和扩展。因而本文采用天然聚合物壳聚糖(CS)作为可注射水凝胶的结构主体[8],通过自由基聚合的方法在壳聚糖分子上引入PNIPAAm链段,以期能够制备出具有良好力学性能和药物传递功能的温度响应型可注射水凝胶。
1.实验部分
(1)试剂与仪器
壳聚糖(CS,脱乙酰度≥95%)购于上海阿拉丁试剂有限公司;N-异丙基丙烯酰胺(NIPAAm,98%)购于上海麦克林生物有限公司;四甲基乙二胺(TEMED,≥99.5%)购于上海阿拉丁试剂有限公司;过硫酸铵(APS,分析纯)购于国药集团化学试剂有限公司;盐酸阿霉素(DOX,98%)购于上海麦克林生物有限公司。
核磁共振波谱仪(AVANCE NEO,瑞士布鲁克)用于测试产物结构;旋转流变仪(DHR-2,美国TA)用于测试样品的多种流变性能;紫外可见分光光度计(T6新世纪,北京普析通用)用于测试载药释药实验中的药物浓度。
(2)壳聚糖/聚(N-异丙基丙烯酰胺)(CS/PNIPAAm)的制备
准确称取壳聚糖和NIPAAm(两者的质量和为0.5g,每组实验设计为不同的配比),共同溶于10mL 1%的乙酸溶液中。伴随着电磁搅拌,依次滴加NIPAAm质量0.45倍的TEMED和0.3倍的APS,分别作为催化剂和引发剂。将反应体系密封后在25℃继续反应24h。将反应产物移入透析袋中,用去离子水透析三天以纯化,之后冷冻干燥得到固体样品。称取少量样品溶于氘代水后用于核磁共振测试。
(3)温度响应性能测试
配制浓度为5%的CS/PNIPAAm水溶液,静置24h以达到完全溶解状态。然后放入37℃的恒温水浴中,观察其在室温和37℃时的状态变化。
(4)流变性能测试
使用旋转流变仪对上述浓度为5%的CS/PNIPAAm水溶液进行多项测试。固定温度为37℃,应变为1%,在频率0.1~100rad/s范围内进行了频率扫描;固定温度为37℃,频率为1rad/s,在应变0.1%~10000%范围内进行了应变扫描。
(5)载药和释药实验
载药:取0.5g CS/PNIPAAm,按照投药比m(DOX):m(CS/PNIPAAm)=1%、2%和3%分别加入DOX与1mL磷酸缓冲溶液(PBS,pH=7.5),充分溶解后将所得样品标注为DOX@CS/PNIPAAm。
释药:将多组DOX@CS/PNIPAAm样品放入37℃的恒温摇床中,待转变为凝胶状态后,加入8mL PBS缓冲溶液。分别在1h、2h、3h、4h、8h、12h、24h和36h后取样并测试释放到PBS中的DOX浓度。每次取样3mL,并同时补充等量的新鲜PBS缓冲溶液。DOX浓度是利用紫外可见分光光度计在495nm处根据标准曲线确定。
2.结果与讨论
(1)CS/PNIPAAm的结构鉴定与温度响应性能
CS/PNIPAAm的合成是通过自由基聚合实现的。在这个过程中,不仅是NIPAAm单体自身发生聚合反应,同时也会与壳聚糖上的氨基键合在一起,形成壳聚糖分子的主链接枝PNIPAAm链段的结构[9]。在CS/PNIPAAm的1H核磁共振谱中可以找到壳聚糖羟基的吸收峰(δ=3.90ppm)和PNIPAAm上异丙基的吸收峰位置(δ=1.15ppm),这表明壳聚糖与NIPAAm的聚合反应是成功的(图1)。
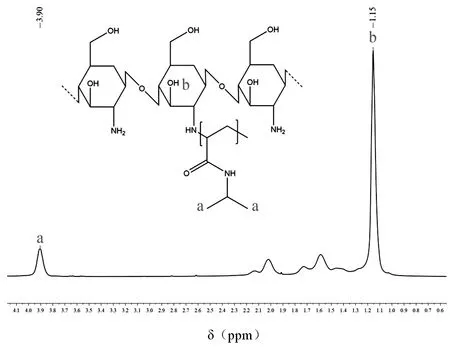
图1 CS/PNIPAAm的1H核磁共振谱
CS/PNIPAAm的温度响应性能可以直接观察到,溶解后的CS/PNIPAAm室温时是透明可流动的溶液状态(图2左),当置于37℃水浴中后很快就形成了不透明不能流动的凝胶状态(图2右)。而且这个转变是可逆的,当样品在室温中冷却一段时间后又可以恢复到透明可流动的溶液状态。这是因为PNIPAAm分子链中含有疏水的异丙基和亲水的酰胺基,当温度低于其LCST时,由于酰胺基和水形成氢键,PNIPAAm链段在水中的溶解度高,分子链呈现伸展或者水合线圈构象;当温度高于LCST时,氢键被破坏,PNIPAAm链段收缩团聚。接枝在不同壳聚糖分子上的PNIPAAm彼此聚集,起到了物理交联CS/PNIPAAm分子的作用,因而形成了具有三维网状结构的凝胶。

图2 CS/PNIPAAm的溶液-凝胶可逆转变(左图:室温,右图:37℃)
(2)CS/PNIPAAm的流变性能
从频率扫描测试的结果中可以看出,在整个频率范围内储能模量(G’)大于损耗模量(G”),这表明37℃时CS/PNIPAAm始终能保持住它的交联结构(图3)。随着频率的增加,G’和G”都在增加,这是因为CS/PNIPAAm的交联作用并非是分子间的共价键构成,而是一种物理交联作用。比较两图可知,NIPAAm含量较多的水凝胶体系的G’和G”均较大,意味着更高的力学强度,这是因为NIPAAm组分的增加为水凝胶结构带来了更大的交联密度。此外还可以观察到体系的复合黏度η随着频率的增大而逐渐减小,这里的频率和剪切速率正相关,因此这种黏度变化验证了CS/PNIPAAm水凝胶具有剪切变稀的性质,这是设计可注射水凝胶的重要特点[10]。
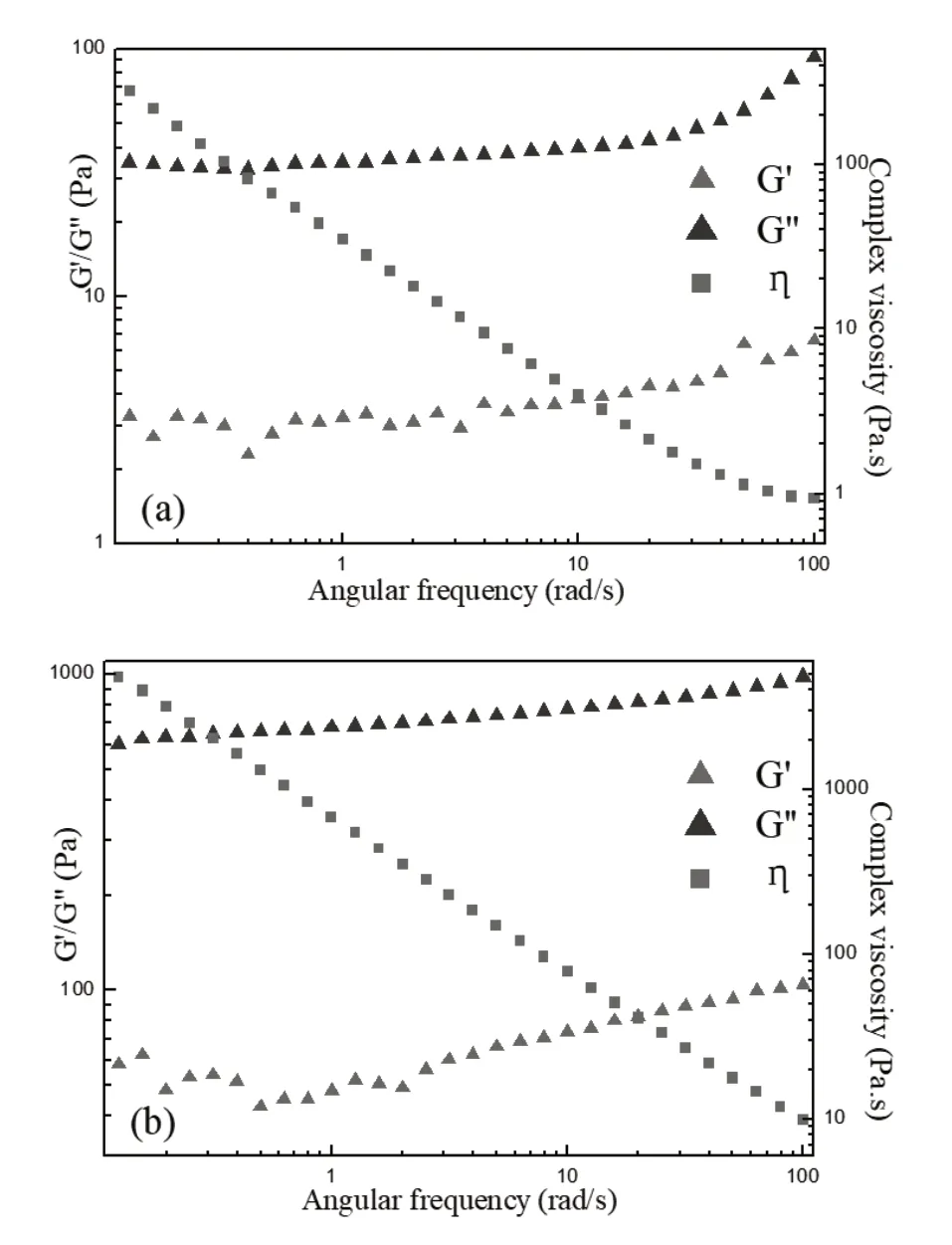
图3 两种CS/PNIPAAm水凝胶的频率扫描测试,CS和NIPAAm的质量比分别为1:6(a)和1:9(b)
应变扫描测试的曲线分为明显的两个部分(图4)。当应变较小时,G’维持在一个较为稳定的值并且始终大于G”,这说明在此范围内三维网状结构得以稳定保持。随着应变的继续增大,G’和G”均下降,但G’的下降速度更快,最终小于G”,说明此时水凝胶的三维网状结构已经遭到了破坏。同时发现,NIPAAm含量较多的水凝胶体系的屈服应变更大,表明了其具有更高的结构强度。结合上文所述频率扫描的测试结果,可以考虑通过改变NIPPAm含量来调控可注射水凝胶的力学性能。


图4 两种CS/PNIPAAm水凝胶的应变扫描测试,CS和NIPAAm的质量比分别为1:6(a)和1:9(b)
(3)CS/PNIPAAm的释药行为
六组释药实验完成后,统计每次取样时的累计药物释放量,并绘制出其随时间变化的曲线,如图5所示。可以看出所有负载了DOX的CS/PNIPAAm水凝胶初期释放速度较快,随后发生不同程度的减速,最终20h后趋于稳定,具有一定的缓释效果。总体来看,累计释放量随投药比的增大而增大,且大部分样品最大释放量可达75%~90%。此外,NIPAAm含量较多的样品其累积释放量大于NIPAAm含量较少的,这可能是因为更多的NIPAAm造成了37℃时更高的交联密度,CS/PNIPAAm分子间的聚集和塌缩更严重,所以药物小分子更容易从凝胶孔隙中被挤出,导致了更快的释药速度和更大的累计释放量。

图5 DOX@CS/PNIPAAm的累计药物释放曲线(CS和NIPAAm的质量比为1:6或1:9,投药比为1%或2%或3%)
3.结论
本文通过自由基聚合成功制备了CS/PNIPAAm共聚物,将其溶解后可实现温度响应可逆的溶液-凝胶转变,这一特性赋予了它作为可注射凝胶的重要应用前景。流变测试结果表明这种可注射水凝胶具有良好的力学性能,并且可以根据不同的应用场景,通过改变原料组分中NIPPAm的含量来调控其力学性能。同时,CS/PNIPAAm水凝胶可以方便地负载药物并对其进行缓慢释放。此类水凝胶有望在组织工程、体内支架、药物传递等领域得以应用。

