含水量和劣变时间对高丹草种子活力及幼苗生长的影响
闫慧芳 ,孙娟 ,2*
(1. 青岛农业大学草业学院,草地农牧业研究中心,山东青岛266109;2. 东营青农大盐碱地高效农业技术产业研究院,山东东营257300)
种子活力作为评价种子质量优劣的重要指标,通常在其生理成熟期达到最高峰[1]。贮藏过程中,种子劣变导致其活力水平不可逆下降,进而造成萌发滞缓,幼苗生长和植株发育受阻,给农业生产带来严重经济损失[2]。种子活力水平由自身遗传特性及外部环境条件共同决定[3]。McDonald[4]提出,种子含水量(moisture content,MC)和环境温度是影响贮藏过程种子活力保持的重要因素,较高温度和相对湿度促进种子活力损失。杨晗等[5]研究贮藏温度和含水量对扁穗冰草(Agropyron cristatum)种子质量的影响发现,含水量对种子造成的劣变作用远大于温度。Lehner 等[6]在小麦(Triticum aestivum)种子劣变生理研究中也报道,对种子内部氧化代谢等反应及种子寿命影响最关键的因子是含水量。贮藏的高含水量正常性种子(而非顽拗性种子),其呼吸和代谢活性迅速增加,储藏物质加速消耗,进而导致种子发芽和活力潜力过早丧失[7]。长期贮藏禾谷类作物和牧草种子的安全含水量为6%~7%,临 界 含 水 量 为 13%[8]。 燕 麦(Avena sativa)[9]、草 木 樨(Melilotus officinalis)[10]、老 芒 麦(Elymus sibiricus)[11]等多种植物中,均有关于含水量对种子活力影响的研究。
劣变(或贮藏)时间很大程度上也影响了种子寿命,是限制种子活力水平和发芽特性的重要因素[12]。陈泉竹等[9]在研究劣变时间对不同含水量燕麦种子活力影响中发现,45 ℃下随劣变时间延长,10%和16%MC 种子发芽率、发芽势和发芽指数均呈显著下降趋势。陈玲玲等[13]也报道,贮藏3 年的紫花苜蓿(Medicago sativa)种子活力下降,种用价值降低,不适宜在人工草地建植中使用。老芒麦种子随老化时间或贮藏年限延长,其发芽率、发芽势、发芽指数、活力指数也呈下降趋势[14-15]。类似研究在狗尾草(Setaria viridis)[16]、羊草(Leymus chinensis)[17]等种子中均有报道。长时间劣变处理(或贮藏)会导致种子老化,抗氧化酶活性降低,细胞结构受损,进而造成种子活力下降。
高丹草(Sorghum bicolor×Sorghum sudanense)是由饲用高粱(S. bicolor)和苏丹草(S. sudanense)杂交育成的一年生禾本科暖季型C4作物,具有非常明显的杂种优势,抗旱抗寒能力强、茎粗叶宽、产量高、营养价值高、适口性好等优良特性,可作为多种畜禽的优质饲草来源,在畜牧业和渔业生产发展中具有非常重要的作用[18-20]。此外,作为新型牧草品种,高丹草还具有一定生态保护价值,其耐贫瘠、耐盐碱等优良抗性在减少水土流失和减轻水资源压力方面发挥优势,是环境修复和资源开发利用方面具有广阔应用前景的生态修复植物[21-22]。随着草地畜牧业快速发展及牧草种植企业化生产,作为禾本科一年生高大饲草,高丹草优质种子需求量激增,其研究、开发和利用也越来越受人们关注。目前,关于高丹草的研究主要集中在优良品种选育与创制[23-24]、栽培与管理[25-27]、营养价值与饲用价值开发利用[28-29]等方面。高丹草所具有的优良特性均为杂种一代优势的表现,种子质量优劣直接关系到其有效建植与生产利用,并影响畜牧业健康发展。高丹草种子劣变及其对种子活力影响的研究较少,王媛媛等[30]在老化时间和温度对高丹草种子发芽率影响的研究中报道,老化时间是促进种子老化的关键因素。然而,含水量对高丹草种子活力的影响尚不清楚。因此,本试验采用控制劣变方法,研究不同含水量和劣变时间处理后高丹草种子活力及幼苗生长变化,比较不同含水量种子活力及抗劣变能力差异,以期为高丹草种质资源保存与利用、劣变生理与分子机制深入探索提供科学理论基础。
1 材料与方法
1.1 试验材料与处理
1.1.1 试验材料 供试高丹草种子(品种“冀草2 号”)保存于青岛农业大学草学实验室,种子初始含水量为9.4%;外形呈扁圆形;千粒重11 g。发芽情况:正常种苗96%,不正常种苗2%,新鲜未发芽种子0,死种子2%。
1.1.2 种子含水量测定 试验于2019 年10 月-2020 年1 月在青岛农业大学草学实验室进行。参照国际种子检验协会种子检验规程[31]进行种子含水量测定。选取均匀洁净高丹草种子放入样品铝盒内,用电子天平(AR223CN,奥豪斯,美国)准确称重约4.5 g(精确到0.001 g),设置2 次重复。预先将电热恒温鼓风干燥箱(DHG-9140A,上海一恒科学仪器有限公司,中国)设置为130 ℃,开启样品铝盒盖后放入干燥箱内烘2 h。到达规定时间后,盖好样品铝盒盖,放入干燥器内冷却30 min 后再次称重,并按照公式计算种子初始含水量(MC0)。
MC0=[(M2-M3)/(M2-M1)]×100%,M1为样品铝盒和盖重量(g),M2为样品铝盒+盖+样品烘前重量(g),M3为样品铝盒+盖+样品烘后重量(g)。
1.1.3 种子含水量调整 采用饱和盐溶液平衡静态称重法进行种子含水量调整。根据已测定的种子MC0和初始重量(initial weight,M0),按照以下公式计算种子所需调整含水量(MCr,10%、12%和16%)对应的种子重量(required weight,Mr)。将洁净的高丹草种子放入盛有NaBr 饱和溶液(平衡相对湿度57%)的密闭容器内,25 ℃下平衡并持续称量种子重量,待种子重量达到Mr时,立即将其装入120 mm×170 mm 铝箔袋内,并用多功能真空封装机密封,每袋25 g。
Mr=[(100-MC0)/(100-MCr)]×M0,Mr为所需调整含水量(MCr)对应的种子重量(g);M0为种子初始含水量(MC0)对应的初始重量(g)。
1.1.4 控制劣变处理 将装有调整好含水量(MCr,10%、12%和16%)高丹草种子的铝箔袋,置于45 ℃电热恒温水箱(CU-600,上海一恒科学仪器有限公司,中国)内进行控制劣变处理,每隔4 d 取样一次,即分别在劣变0(对照)、4、8、12、16、20、24 和 28 d 进行取样。种子取出后保存于-20 ℃冰箱,以备种子发芽及幼苗生长试验所用。
1.2 测定指标与方法
1.2.1 种子发芽试验 参照国际种子检验协会种子检验规程[31],选取均匀饱满、大小一致的高丹草种子50粒,将其摆入盛有10 mL 蒸馏水润湿3 层滤纸的有盖培养皿(110 mm×110 mm)中;将培养皿置于光照培养箱(GXZ-380A 型,宁波江南仪器厂,中国)内,在30 ℃光照8 h、20 ℃黑暗16 h 条件下进行发芽培养。每个处理设置4 次重复。以正常种苗作为发芽标准,每24 h 统计种子发芽情况,待第10 天发芽结束后,参照Abdul-Baki 等[32]的方法,计算种子发芽率(germination percentage,GP)、发芽指数(germination index,GI)和种子活力指数(vigor index,VI),以反映种子劣变后的活力水平变化。
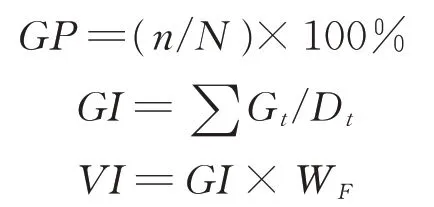
式中:n为前10 d 全部正常种苗数;N为供试种子总数;Gt为第t天内的发芽种子数;Dt为相应的发芽天数;WF为幼苗鲜重(g)。
1.2.2 幼苗生长状况测定 按照1.2.1 中方法进行高丹草种子发芽试验。待种子发芽第10 天结束后,用刻度尺测量全部正常种苗苗长(shoot length,SL)和根长(root length,RL),分别为从种胚到最长叶叶尖或最长根根尖的长度;用电子天平(AR223CN,奥豪斯,美国)称量苗鲜重(shoot weight,SW)和根鲜重(root weight,RW)。参照 Abdul-Baki 等[32]的方法,计算幼苗活力指数(seedling vigor index,SVI),SVI=(ASL+ARL)×GP,ASL(average shoot length)为平均苗长(cm),ARL(average root length)为平均根长(cm)。
1.3 数据统计与分析
采用Excel 2010 和SPSS 17.0 软件分析试验数据显著性,采用单因素方差分析(ANOVA)检验和Duncan 检验比较不同处理平均值(P<0.05),结果以平均值±标准误表示。采用SigmaPlot 10.0 软件作图。
2 结果与分析
2.1 含水量和劣变时间对高丹草种子活力的影响
随劣变时间延长,10%MC 高丹草种子GP 呈先升高后下降趋势,并在劣变4 d 达最大值94%,且显著(P<0.05)高于其他各劣变时间处理;12%MC 种子GP 在劣变过程中则呈不断下降趋势,并在劣变4、8、12 和 16 d 之间差异显著(P<0.05);16%MC 种子 GP也呈不断下降趋势,且劣变0、4 和8 d 之间差异显著(P<0.05)(图 1A)。同时,10%MC 种子 GP 在劣变28 d 时仍为10%,而12%和16%MC 种子GP 分别在劣变16 和8 d 时降低为1%,可见,3 种含水量种子的抗劣变能力存在差异。此外,控制劣变4~12 d 时,不同含水量种子间GP 均差异显著(P<0.05);其中,劣变8 d 时,各含水量种子GP 分别为83%、53%和1%,相比于对照(0 d),下降了2%、28%和88%;控制劣变16~28 d 时,10%MC 种子 GP 显著(P<0.05)高于12%和16%MC 种子,而12%和16%MC 种子间差异不显著(P>0.05)。
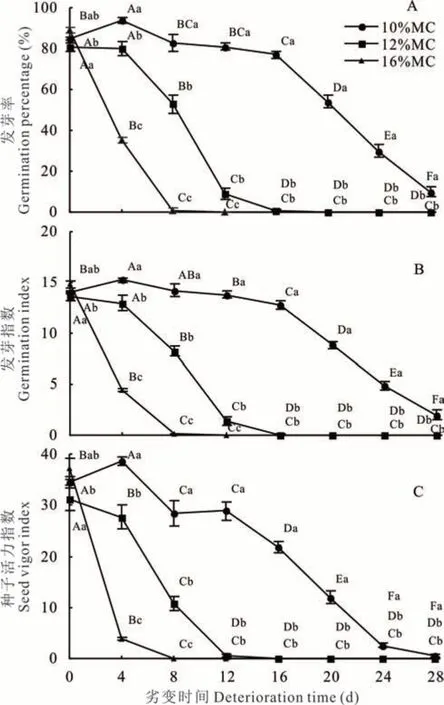
图1 含水量和劣变时间对高丹草种子活力的影响Fig. 1 Effect of moisture content and deterioration time on seed vigor of S. bicolor×S. sudanense seeds
控制劣变过程中,10%MC 种子GI 呈先升高后下降趋势,在劣变4 d 时达最大值,且显著(P<0.05)高于对照和劣变 12~28 d;12%MC 种子 GI 随劣变时间延长则呈不断下降趋势,且劣变 4、8、12 和 16 d 之间差异显著(P<0.05);16%MC 种子 GI 也呈不断下降趋势,并在劣变 0、4 和 8 d 之间差异显著(P<0.05)(图1B)。控制劣变4、8 和12 d 时,不同含水量种子间GI均 差 异 显 著(P<0.05);控 制 劣 变 16~28 d 时 ,10%MC 种 子 GI 显著(P<0.05)高于 12% 和 16%MC,而 12% 和 16%MC 种 子 间 GI 差 异 不 显 著(P≥0.05)。
随劣变时间延长,10%MC 种子VI 呈先升高后下降趋势,劣变4 d 时达最大值,且显著(P<0.05)高于其他劣变时间处理;12%MC 种子VI 在劣变过程中则呈不断下降趋势,且劣变0、4、8 和12 d 处理间差异显著(P<0.05);16%MC 种子 VI 也呈下降趋势,并在劣变 0、4 和 8 d 处理间差异显著(P<0.05)(图 1C)。控制劣变 4 和 8 d时,不同含水量种子间 VI 均差异显著(P<0.05);控制劣变 12~28 d 时,10%MC 种子 VI 显著(P<0.05)高于12%和16%MC,而12%和16%MC 间差异不显著(P≥0.05)。
2.2 含水量和劣变时间对高丹草幼苗生长特性的影响
10%MC 高丹草种子劣变 4~20 d 时,幼苗 SL 均与对照(0 d)差异不显著(P≥0.05);劣变 24 和 28 d 后,幼苗SL 显著(P<0.05)低于对照和劣变 4 d 时的 SL;与对照相比,幼苗 SW 在劣变4 d 时变化不显著(P≥0.05),但随劣变时间延长,幼苗SW 呈下降趋势,且各劣变时间之间差异显著(P<0.05)。然而,劣变时间对幼苗RL 影响不大,4~28 d 处理与对照间均差异不显著(P≥0.05);而对幼苗 RW 影响较大,相比于对照,4~28 d 处理均显著(P<0.05)降低幼苗RW,且各劣变时间处理间均差异显著(P<0.05)。SVI在劣变4~12 d 时均与对照差异不显著(P≥0.05),而劣变时间延长至16~28 d 时显著(P<0.05)降低(表1)。
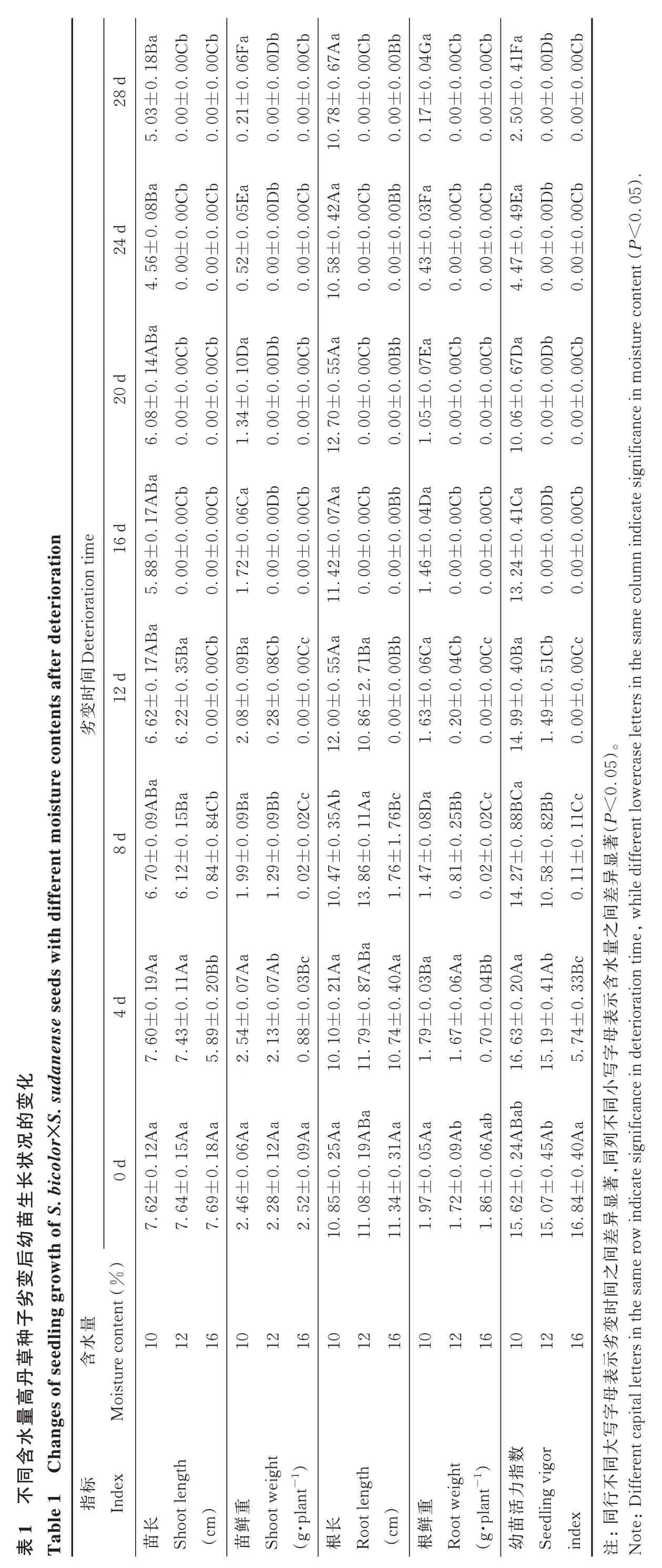
表Ta ab 8B 0C 0C ba 6F bb 0D 0C Aa bb 0C 0B 28 d .167±0.0.0.0.0.0 0..0.0 03±0±0±0±0±0 8±±0±0 5.00 0.00 0.21 0.00 0.00 0..700 0.00 0.ab ba 0C 8B bb Aa 0C bb 5E 0C 420C.0.0 10 0B.0 24 d±0.0.0 0D.0 0..0.0 5600±0±0 00±0±0±0 8±±0±0 4.0.0.52 0.00 0.00 0..500 0.00 0.4A 0C bb Ba 0C 0D ab 0D b Aa 0C bb 0C 0B.0.0.1.1 20 d .0±0.0 0.±0 55.0±0.0±0±0±0 080±±0 00±0 00 0.6.34 1.0.00 0.00 0..700 0.00 0.12 7A ab bb 10 0C Ba 0C 6C 0D b 0C Aa bb 0C 0B.0.1.0.0 16 d e .0±0±0 tion .0 0.±0.0±0.0 07±0±0 88 n tim ra 0072 00002±±0 00±0 0000 0.5.0.Deterioratio 1.0.0..4 eterio 110.0.B a 7A 5B fter d ab ab c 0C 9B 8C 0C Aa Ba 0B b.1 tents a 间.371.0.0.0 0.12 d±02.55±0±0±0.0.0变62±0±0 0±006±22±0 08280000劣6.6.0.2.时oisture con 0.0..0 12.8 100.ab Ba 9B 5B ab 9B c 2C Ab Aa 6B c 4C.0.8.011.1.0.035±0±0 8 d 0.±00.±0±0.7±0±1 709929 1202 846±7±ifferent m 0.6.6.1.1.0.76.8 1..4 1013 1A aa se seeds w 0B ba 7A ith d a bc 9A 7A 3B AB 9A Aa Aa 87.040.1.1.2 0.4 d±0.0 0.21±00..0±0±0 604389±0 en 54±0 0±139±884±7.5.2..1 2..7 0.7..7 an 11 1010变.sud 8A AB Aa aa aa 6A 2A的2A 9A aa Aa化a icolor×S 5A 25.1.0.1.119 0..0±0 0 d±00.±0 31±0.1±0长生.b 8±62状46况28±0 52 0.4±69苗f S 5±7.7.64 7.2.2.2..8.0.3 11后wth o 1011变ro幼草丹f seedlin g g ten t(%)re con劣101216101216101216水种子含量es o istu高水ng Mo含ha t h量ab 4G 0C ba 0C 1F 0D bb 0C.0.0.0.4.0.0±0±0±0±0±0±0 5)17 0.00 0.00 0.50 2.00 0.00 0..ab ba bb 3F 0C 0C 9E 0D 0C .0.0.0.0.4.0.0<0±0±0±0±0±0±0 43 0.00 0.00 0.47 4.00 0.00 0.tent(P ab 7E b Da 0C bb 0C 0D 670C oisture con.0.0.0 0..0.0±0±0±0 6±±0±0 0500 1.0.00 0.00.000 0.0.nificance in m b Ca bb ab 4D 0C 0C 410D 0C icate sig.0.0.0 0..0.0±0±0±0 4±±0 46±0 n ind 00000000 1.0.0..2 130.0.e colum a 4C bc 0C Ba bc 1C 0C 40.0.0.0 0..5.0±0±0±0 9±63±0 20±0 0049 0.6C 00 1.0..9 141.0.(P<0 5)ercase letters in the sam a c 8D BC Bb bc显ifferent low.0 5B 2C 881C 82.0.2.0 0.0..1著±0±0±0 7±8±±0 4781 1.0.0211 0..2 14.5 100.异间差wh ile d a aa 3B b Aa Ab 水6A 4B 2041之e,3B 含c量.0.0.0 0.0..3示ration tim表±0±0±0 3±9±±0 79677074 1.1.0..6 16.1 155.母eterio写小同ab ab字5A AB Ab Aa 9A 不nificance in d 6A 24列4540.0.0.0 0.0.±00.,同±0 ab±0著2±7±4±977286显dicate sig 1.1.1..6 15.0.8 15异in之间e row间 变劣差101216101216示。16表母字ital letters in the sam写t 数eigh大or ble 1 C同ig指dex同gt eigh标不不ifferent cap In 力t w lant-1)指(cm)gth重长oo lant-1)t len重活ling v行1 oo苗Sh 鲜Sh(g·p 长根Ro (cm)鲜ot w根Ro时10 ot len苗同苗(g·p幼Seed in dex:te:D注No
12%MC 高丹草幼苗 SL 和 SW 均随劣变时间延长而呈下降趋势,尽管劣变4 d 时均与对照差异不显著(P≥0.05),但劣变8~28 d 显著(P<0.05)降低,且 SW 在劣变4、8、12 和 16 d 之间差异显著(P<0.05)。幼苗RL 对劣变时间响应较晚,相比于对照 ,劣变 4~12 d 时均 无 显著变化(P≥0.05);随劣变时间延长,幼苗RW 呈下降趋势,除在劣变4 d 时与对照差异不显著(P≥0.05)外,劣变 8~28 d 时均显著(P<0.05)降低,且在劣变 4、8 和 12 d 之间差异显著(P<0.05)。SVI 在劣变 0~28 d 的变化情况与SW 一致(表1)。
随劣变时间延长,16%MC 高丹草SL、SW、RL、RW 和 SVI 均呈下降趋势(表 1)。除 RL 外,劣变 4 d 时 SL、SW、RW 和 SVI 均显著(P<0.05)低于对照;劣变 8 d 则显著(P<0.05)降低了SL、SW、RL、RW 和SVI,且与劣变4 d 之间差异显著(P<0.05)。
控制劣变 4、8 和 12 d 时,10% 和 12%MC 高丹草 SL 差异不显著(P≥0.05),但均显著(P<0.05)高于16%MC;而不同含水量间的 SW 和 SVI 均差异显著(P<0.05)。就RL 而言,各含水量种子在劣变4 d 时差异不显著(P≥0.05),而在劣变8 d 时差异显著(P<0.05);劣变 12 d 时,尽管 10% 和12%MC 间差异不显著(P≥0.05),但均显著(P<0.05)高于 16%MC。至于 RW,劣变 4 d 时 10% 和 12%MC 间差异不显著(P≥0.05),但 均 显 著(P<0.05)高 于16%MC;劣变 8 和 12 d 时,各含水量间差异 显著(P<0.05)。此外,劣变 16~28 d 时,10%MC 幼苗 SL、SW、RL、RW 和 SVI 均显著(P<0.05)高于 12% 和16%MC,但12%和16%MC 间差异不显著(P≥0.05,表1)。
2.3 含水量和劣变时间对高丹草种子活力及幼苗生长的双因素方差分析
双因素方差分析表明(表2),种子含水量、劣变时间及两者互作对种子GP、GI、VI 和幼苗SL、SW、RL、RW、SVI 均具有极显著(P<0.01)影响,二者对高丹草种子劣变过程中活力水平及幼苗生长变化起关键作用。
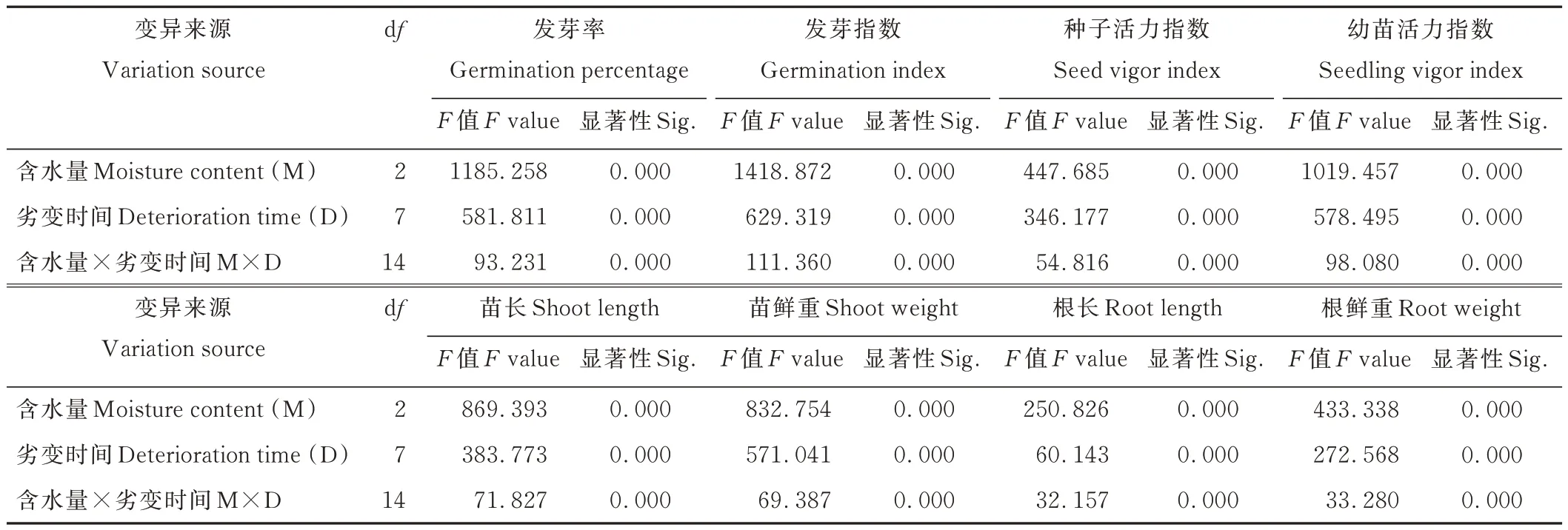
表2 含水量和劣变时间对高丹草种子活力及幼苗生长特性影响的双因素方差分析Table 2 Two-way variance analysis of moisture content and deterioration time on seed vigor and seedling growth characteristics of S.bicolor×S.sudanense
3 讨论
种子活力反映种子质量和综合特性,决定了其在复杂田间环境下萌发、出苗及幼苗生长的能力[33]。种子寿命及抗劣变能力也是种子质量的重要指标,受遗传、生理保护和贮藏条件影响[34]。通常种子活力越高,其萌发及幼苗生长潜在活性水平越高,种子抗劣变能力也越明显[35]。有关种子劣变生理研究报道,种子活力变化与含水量密切相关,长期贮藏应保持在适宜范围内[36-38],如水稻(Oryza sativa)种子含水量应在12%~14%以下[39]。本试验中,不同含水量高丹草种子劣变后活力水平均呈整体下降趋势,幼苗生长受到明显抑制,但变化速率因含水量差异而不同。10%MC 种子GP、GI 和VI 均下降最慢,至劣变28 d 时仍分别保持有原水平的10.0%、14.1%和1.5%,而12%和16%MC 种子活力各项指标均下降较快,分别在劣变12 和8 d 时已几乎降为0(图1),表明高丹草种子含水量越高,其活力越容易丧失,抗劣变能力也越差。这与对水稻[40]、紫花苜蓿[41]和香椿(Toona sinensis)[42]种子的研究结果相一致,均表明含水量是影响种子活力水平的重要因素,且随含水量升高,劣变后的种子活力下降速度加快。水分作为种子内细胞的重要组成成分,参与细胞生理代谢和种子正常生命活动。朱萍等[11]研究发现活性氧积累是引起4%~16%MC 老芒麦种子劣变和活力下降的原因,李吟平等[43]则发现15%高含水量造成黄精(Polygonatum sibiricum)种子膜系统破坏,也加快了劣变进程,进而导致种子活力下降。同时,由含水量引起的种子劣变也对高丹草幼苗生长产生了明显抑制作用。短时间(4 d)劣变处理时,除幼苗RL 不受影响外,16%高含水量导致幼苗生长状况(SL、SW、RW 和SVI)均显著低于10%安全含水量劣变后的幼苗生长,且随劣变时间延长,高含水量引起的种子劣变对后续幼苗生长造成的抑制作用越明显(表2)。种子萌发和幼苗生长过程主要发生有机物转化,适宜条件下种子贮藏物质被酶解为小分子化合物,而高含水量可能过度激活种子呼吸,消耗大量脂质、蛋白质等物质,无法满足幼苗生长所需要能量,从而使幼苗生长受到抑制。本试验表明,高丹草种子抗劣变能力与含水量密切相关,高含水量既加剧种子活力下降,又阻碍幼苗正常生长。
种子活力随贮藏时间延长而逐渐下降,陈泉竹等[9]研究劣变时间对10%和16%MC 燕麦种子活力影响发现,45 ℃条件下,劣变时间延长导致两种含水量种子发芽势、发芽率和发芽指数均显著下降。金小雯等[35]在研究贮藏1~8 年的燕麦种子活力变化中也报道,种子发芽率、发芽指数、活力指数、幼苗芽长和根长均随贮藏年限增加而显著下降,种子浸提液电导率明显上升,膜透性增大。王媛媛等[30]认为,老化时间是促进高丹草种子老化的关键因素,其发芽率在老化60 h 后降幅最大。本试验中,随劣变时间延长,除10%MC 高丹草种子GP、GI 和VI 呈先升高后下降趋势外,12%和 16%MC 种子活力指标(GP、GI 和 VI)及幼苗生长指标(SL、SW、RL、RW 和 SVI)均呈不断下降趋势,尤其16%MC 种子各项指标下降非常迅速(图1 和表2),表明长时间的高含水量条件对种子安全贮藏危害很大。Xia 等[44]在研究劣变1~40 d 对不同含水量燕麦种子发芽及生理变化影响中发现,10%含水量种子胚中抗坏血酸过氧化物酶、脱氢抗坏血酸还原酶、单脱氢抗坏血酸还原酶、谷胱甘肽还原酶活性随劣变时间延长先升高后降低,认为相对温和的劣变阶段有助于激活某些抗氧化酶的活性或合成。本试验中,10%MC 高丹草种子短期劣变4 d 后,种子活力升高,或许是因为相对温和的损伤或活性氧增加暂时激活了某些抗氧化酶活性,进而有效调节细胞内氧化状态,而随含水量升高和劣变时间延长,抗氧化酶保护和清除作用受限,细胞氧化还原失衡,物质转化和能量代谢等紊乱,从而使种子活力降低。
高丹草种子活力及幼苗生长指标随含水量增加与劣变时间延长均呈下降趋势。在相同劣变条件处理下,与10%安全含水量相比,16%高含水量导致高丹草种子活力下降更迅速,幼苗生长所受抑制作用也更明显;短时间(8 d)劣变就会使16%高含水量种子丧失活力,说明含水量是影响高丹草种子活力保持的关键因素。综合比较,高丹草种子含水量越高,种子活力越容易丧失,抗劣变能力也越差。45 ℃条件下劣变8 d 处理可以较好地评价不同含水量种子的活力水平。
4 结论
控制劣变处理降低了高丹草种子的活力水平、抑制了幼苗生长,且这种影响与种子含水量、劣变时间及两者互作有关。种子含水量越高,劣变时间越长,高丹草种子活力下降越快,幼苗生长所受抑制作用越明显。另外,10%、12%和16%含水量高丹草种子抗劣变时间分别为28、16 和8 d,劣变8 d 能够将各不同含水量种子区分开,可较好地评价不同含水量高丹草种子的活力水平。

