祁连山不同类型草地土壤细菌群落特征研究
赵文 ,尹亚丽 ,李世雄 ,2*,刘燕 ,刘晶晶 ,董怡玲 ,苏世锋 ,吉凌鹤
(1. 青海大学畜牧兽医科学院,青海西宁810016;2. 青海大学三江源区高寒草地生态教育部重点实验室,青海西宁810016;3. 甘肃农业大学草业学院,甘肃 兰州 730070)
祁连山位于青藏、蒙新、黄土三大高原交汇的生态脆弱地带,在维持动植物物种多样性和涵养内陆河水源方面发挥着不可替代的作用,被称为架构在西北地区生态安全屏障的“生态之脊”[1]。草地生态系统是祁连山主要的生态系统,在温度和水分因子的驱动下,祁连山地区从低海拔到高海拔分布着10 种不同类型的草地,呈现出明显的分异和组合[2-3]。不同类型草地的存在不仅对当地畜牧业发展起着至关重要的作用,亦在维持我国草地生态系统的稳定性和多样性等方面占有不可或缺的分量[4]。然而近几十年,尤其是从20 世纪90 年代实行的草场承包到户,导致了大面积的过度放牧,造成了草地退化、水土流失、啮齿动物大量繁殖以及一系列生态系统失衡问题[5-6]。其中高寒草甸生态系统气候寒冷,属多年冻土,是生物多样性变化的敏感区域[7];沼泽化草甸是介于草甸与沼泽之间的过渡类型,是易受环境干扰的生态脆弱区[8]。在过度放牧等因素的影响下,部分高寒草甸出现大面积裸斑块,优势物种减少,形成以毒杂草为主的黑土滩退化草地,失去了原有的生态功能和经济价值[9]。建植人工草地是快速恢复黑土滩最有效的办法,植被恢复的同时对土壤微生物区系产生影响[10]。土壤微生物与生态系统功能密不可分,在维持地上植被多样性和土壤养分平衡中发挥着重要作用,同时土壤微生物是动态变化的自组织系统,通过遗传维持其组成和结构的相对稳定,通过变异适应环境干扰[11-12]。因此,从微生物的数量组成和物种丰度了解土壤微生物系统[13],对了解草地微生物群落结构具有重要的意义。
微生物是土壤生态系统的重要组成部分,参与碳、氮循环,有机化合物分解及能量传输、运送等多种过程,对维持生态系统稳定和可持续性方面有重要的作用[14]。细菌可以提供本地化参照系中特定的生态系统指标,用以评估土地价值[15]。因此,探究细菌群落的多样性及群落结构,对评价和调控草地生态功能具有参考价值。已有研究表明,环境因素驱动了土壤微生物群落在全球尺度上的分布,呈现出不同生物地理模式[16],刘怡萱等[17]综合比较青藏高原区域大尺度,发现东部、中部和东北部地区细菌群落的丰富度和多样性较高,西部以及西北部地区较低;Wang 等[18]对新疆和内蒙古横跨3700 km 的多种草地类型长期研究发现,大区域尺度下微生物共存网络主要受年均降水量影响。也有研究指出土壤细菌随生态类型变化也出现相应改变,青藏高原由东向西从农用地到高寒草甸,细菌群落出现显著的差异[19]。但是区域大尺度下影响微生物群落的因素众多,且各因素间综合作用对于微生物影响也未可知,而小区域生境内环境因子的影响会显著降低,这将有助于了解土壤细菌群落的组成[20]。因此,本研究以祁连山区高寒草甸、沼泽化草甸和人工草地为对象,采用高通量测序技术,对3 种类型草地土壤细菌群落特征进行分析,阐明土壤细菌物种组成及群落结构等在草地类型间的异同点,揭示土壤环境因子与细菌群落间的网络调控关系,为祁连山草地生态环境保护及利用提供理论基础。
1 材料与方法
1.1 试验地概况
研究地位于青海省祁连县默勒镇瓦日尕村(37°56′48.60″N,100°13′13.80″E,海拔约3650 m),属高原大陆性气候,冷季长、暖季短,年均温-1.7 ℃,1 月平均气温-14.8 ℃,7 月平均气温9.8 ℃,气温日较差大,干湿分明,气温和降水垂直变化明显,雨热同期,年平均降水量为614.8 mm。该区光能资源丰富,日照时间长,辐射强,年蒸发量1162.3 mm[21]。草地植被主要以高寒草甸为主,其优势种主要有矮嵩草(Kobresia humilis)、垂穗披碱草(Elymus nutans)、草地早熟禾(Poa pratensis)、高山嵩草(Kobresia pygmaea)等,植被盖度和物种丰富度见表 1。人工草地主要以草地早熟禾、芒洽草(Koeleria litvinowii)、中华羊茅(Festuca sinensis)、冷地早熟禾(Poa crymophila)等为主。沼泽化草甸是苔草型沼泽化草甸,优势物种有青藏苔草(Carex moorcroftii)、线叶嵩草(Kobresia capillifolia)、矮嵩草等。
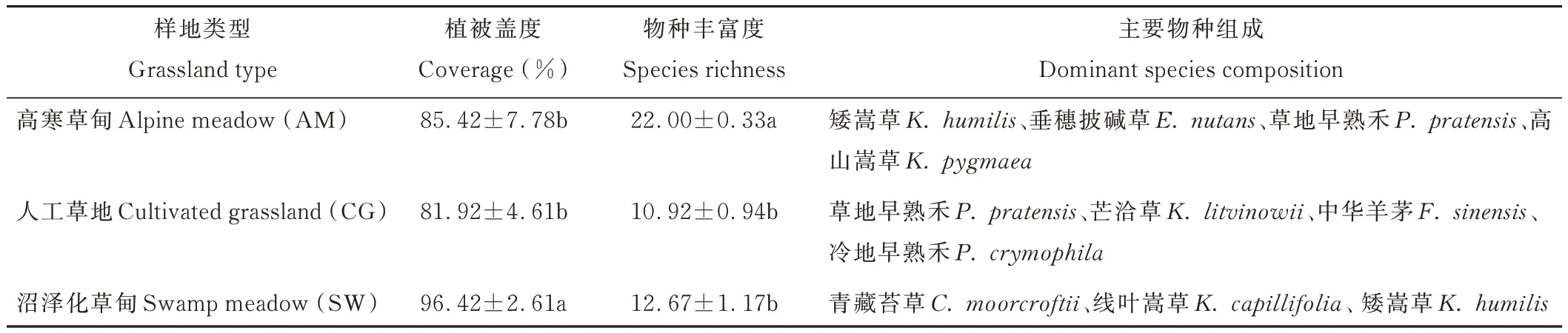
表1 不同草地类型植被盖度及物种丰富度Table 1 Vegetation coverage and species richness in different grassland types
1.2 样地设置与测定方法
在青海省祁连县默勒镇选择3 块面积分别约为50 hm2的高寒草甸、沼泽化草甸及人工草地为试验样地,样地间隔约5 km,各处理样地设4 个试验小区为重复,共12 个小区,每个小区面积约1200 m2。高寒草甸和沼泽化草甸均是原生草甸,分别为春季牧场(4-12 月放牧)和夏季牧场(7-9 月放牧)。人工草地是高寒草甸退化为黑土滩,经过深翻、耙平、施肥(一次性施 N 肥 61.5 kg·hm-2、P 肥 68.9 kg·hm-2)、撒种(播量 15 kg·hm-2)、覆土、镇压等农艺措施建植的混播人工草地,建植周期为4 年,返青期(4-6 月)完全禁牧,冬季放牧利用(每年11 月-次年4月),各草地放牧强度相同。
1.3 样品采集及测定方法
2018 年8 月中旬在每小区随机选取4 个面积为50 cm×50 cm 的样方,对植被群落特征进行调查。用直径3.5 cm 的土钻,每小区随机取5~8 点,采集0~10 cm 土样,每个小区混合为一个土样,并过2 mm 的筛,充分混匀后分成两份,1 份室内阴干用于土壤理化性质分析。采用酸度计电位法常温下(土水比1∶5)测定土壤pH;采用烘干称重法测定土壤含水量(soil water content,SWC);参照杨剑虹等[22]的测定方法,采用硫酸铜-硫酸钾(10∶1)-浓硫酸消解,凯氏定氮法测定土壤全氮(total nitrogen,TN)含量,采用氯化钾浸提法测定硝态氮(nitrate nitrogen,NN)和氨态氮(ammonia nitrogen,AN)含量;采用氢氧化钠熔融-钼锑抗比色法测定全磷(total phosphorus,TP)含量;采用H2SO4-K2Cr2O7外加热,硫酸亚铁滴定测定土壤有机质碳(total organic carbon,TOC)含量。
另一份土壤样品装于自封袋,夹棉塞透气,用冰盒带回实验室,装入10 mL 离心管,干冰运输至广州基迪奥生物科技有限公司进行测序,测序和生物信息服务在Illumina 250 PE 平台完成。土壤DNA 用HiPure Soil DNA kits 试剂盒按照步骤提取,获得DNA 总样在Nanorop 微量分光光度计(Nanorop 2000,美国)上进行质量检测。同时对核酸样本进行琼脂糖凝胶电泳检测,其目的是检验核酸样本的完整性,是否发生降解,是否有蛋白等污染。PCR 扩增是 用 带 有 barcode 的 特 异 引 物 扩 增 16S rDNA 的 V3~V4区 ,引 物 序 列 为 341F(CCTACGGGN GGCWGCAG)和 806R(GGACTACHVGGGTATCTAAT)[23]。PCR 反应体系[24]:5 μL KOD 缓冲液(10×),1 μL KOD 高保真 DNA 聚合酶,5 μL(2 mmol·L-1)dNTPs,正向和反向引物各 1.5 μL(10 μmol·L-1),加入适当的模板,使用一定量的ddH2O 将反应体系总体积扩充至50 μL 。扩增程序:94 ℃预变性2 min 后进行30 个循环,每个循环包括98 ℃变性10 s,62~66 ℃退火30 s,68 ℃延伸30 s,循环结束后68 ℃延伸5 min。PCR 扩增产物用核酸纯化试剂盒(AMPure XP Beads)进行产物纯化,纯化后使用Qubit(Qubit 3.0,美国)进行定量。使用AMPure XP Beads 对第 2 轮扩增产物进行纯化,用 ABI StepOnePlus Real-Time PCR System(Life Technologies,美国)进行定量,由广州基迪奥生物科技有限公司Illumina 250 PE 平台完成测序。
1.4 生物信息学分析
测序得到原始序列(raw reads)之后,对低质量序列(reads)进行过滤,然后进行组装和再过滤,用Uparse 软件对所有样品的全部有效序列聚类,以97%的一致性将序列聚类成为OTUs(operational taxonomic units)结果。Uparse 在构建OTUs 的过程中会选取代表性序列(OTUs 中丰度最高的那条Tag 序列),将这些代表性序列集合用 RDP 分类器的 NBA 算法,与 Silva(Quast,2013)数据库进行物种注释[24](设定置信度的阈值为 0.8~1.0)。
Simpson 指数(DS)是样本中物种的丰富度与均匀度的综合指标;Shannon 指数(H)是物种丰富度、均匀度的体现,是对群落结构的综合反映;Chao1 指数是用于估算样本物种总量的计算值。
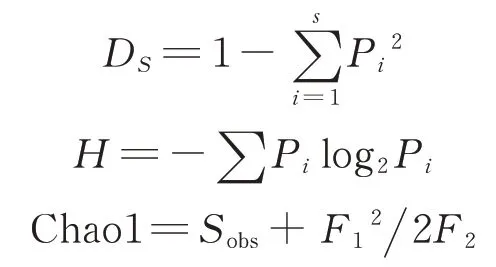
式中:S 表示物种种类总数;Pi表示样品中属于第i种的个体比例,如样品总个体为N,第i种个体数为ni,则Pi=ni/N;Sobs为观察到的物种数,也就是测序分析得到的物种数;F1是样本中数量为1 的物种数;F2是样本中数量为2 的物种数。
1.5 数据处理
采用SPSS 20.0 对植被、土壤理化性质、微生物多样性指数等数据进行单因素方差比较,结果均为平均值±标准误。用Anosim(analysis of similarity)非参数检验法检验组间差异,用矩阵相关性分析土壤理化性质与土壤细菌群落之间的关系,所有数据均采用Excel 2006 整理。
2 结果与分析
2.1 土壤理化性质
3 种类型草地0~10 cm 土壤理化性质均表现出不同程度的差异(表2),其中沼泽化草甸土壤全氮、全磷、有机质碳含量、含水量和硝态氮含量均显著高于高寒草甸和人工草地(P<0.05);人工草地与高寒草甸间除含水量和硝态氮含量表现显著差异外,其他指标均未表现显著差异。

表2 土壤基本理化性质Table 2 Basic soil physical and chemical properties in the three investigated grassland(n=4)
2.2 不同草地类型土壤细菌群落OTU 组成及结构
在祁连山高寒草甸、人工草地和沼泽化草甸土壤中共得到有效序列1022446 条,平均每个样本的有效序列为85203 条。以97%的一致性将有效序列聚类为OTU,3 种草地共检测到60905 条,其中高寒草甸、人工草地、沼泽化草甸的 OTU 均值分别是 4917、5233、5075 条。
稀释曲线分析显示,当抽取的序列数达到25000时,曲线趋向于平缓,说明测序的数据量基本合理,更多的数据量对于发现新的OTU 贡献不大(图1)。韦恩分析显示(图2),在OTU 水平上,高寒草甸的特异性细菌 OTU 数(744)占总 OTU 的 12.95%;人工草地中细菌OTU 数(1016)占17.68%;沼泽化草甸细菌OTU 数(1245)占21.67%。此外,高寒草甸和人工草地共有细菌OTU 数(2211)占38.48%;人工草地和沼泽化草甸共有特异OTU 数(1636)占28.47%;高寒草甸和沼泽化草甸共有细菌OTU 数(1751)占30.47%,3 个草地共有细菌 OTU 数(1429)占24.87%。

图1 不同类型草地土壤细菌稀释曲线Fig. 1 Rarefaction curves of microbial communities in different grassland types

图2 不同类型草地土壤细菌OTU 韦恩分析Fig. 2 Venn diagram of bacterial communities in different grassland types based on OTUs abundance
2.3 不同类型草地土壤细菌群落多样性分析
对3 种草地土壤细菌多样性指数进行分析,评估不同群落的均匀度和丰富度(表3)。Shannon 多样性指数在人工草地最高,高寒草甸次之,沼泽化草甸最低,但差异不显著;Simpson 指数在不同草地类型中差异不显著,具体表现为高寒草甸>沼泽化草甸>人工草地;Chao1 指数表现为人工草地显著高于其他两类草地(P<0.05),且高寒草甸显著高于沼泽化草甸(P<0.05)。
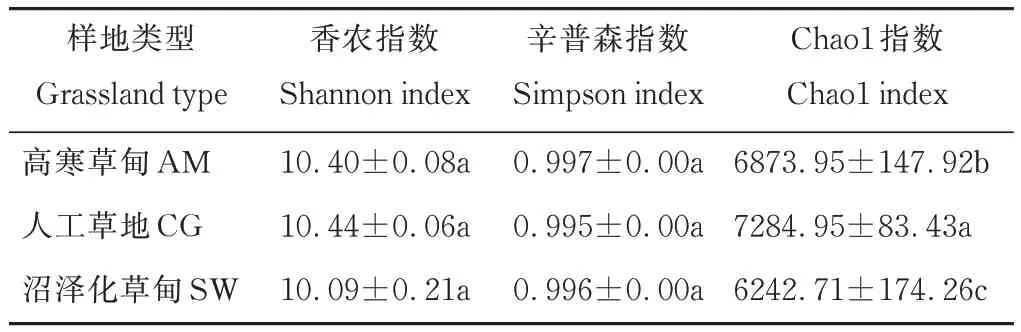
表3 不同草地类型土壤细菌群落丰富度和多样性指数Table 3 Richness and diversity indices of bacteria communities in different grassland types
2.4 不同草地类型土壤细菌群落PCoA 分析与Anosim 分析
基于Unweight unifrac 距离对3 种草地土壤细菌群落进行主坐标分析(principal co-ordinates analysis,PCoA),主坐标 1(PCo1)与主坐标 2(PCo2)对 3 种类型草地土壤细菌群落差异的解释率分别为21.70%、12.18%,累计贡献为33.88%。进一步的Anosim 分析结果表明3 种草地土壤细菌群落差异显著(r=1.000,P=0.001,图 3)。
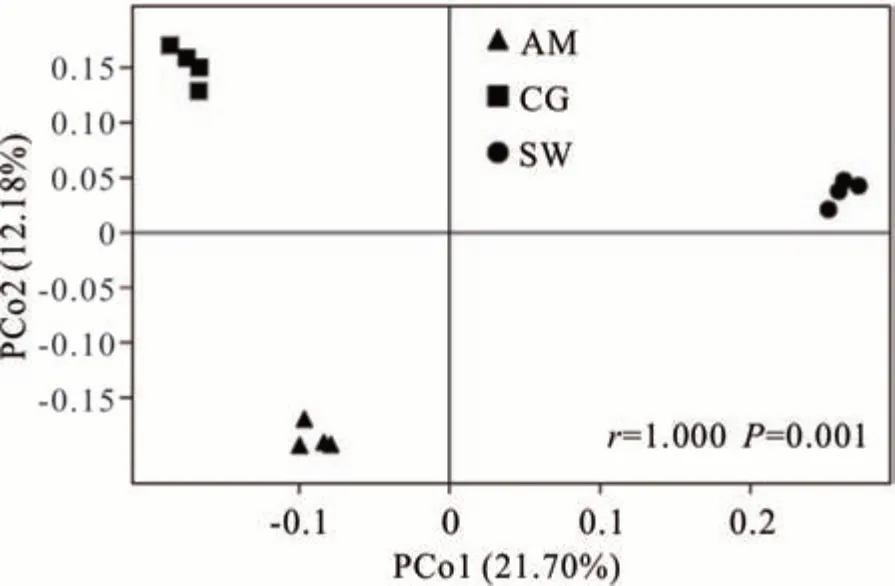
图3 不同类型草地土壤细菌群落PCoA 分析Fig. 3 PCoA analysis of bacterial communities from different grassland types
2.5 不同类型草地土壤细菌群落组成及结构变化
从3 种不同类型草地土壤中共检测到相对丰度均大于1%的细菌分属于10 个门(图4),其分别占高寒草甸、人工草地和沼泽化草甸土壤细菌总数的94.61%、95.51% 和94.96%。3 种类型草地均以变形菌门、酸杆菌门、放线菌门和浮霉菌门为主要类群。其中沼泽化草甸土壤细菌群落的变形菌门类群显著高于高寒草甸和人工草地(P<0.05);而沼泽化草甸的酸杆菌门和放线菌门丰度最低,显著低于其他两类草地;浮霉菌门在各草地间差异不显著。
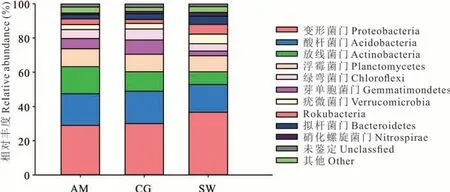
图4 不同类型草地土壤细菌群落门水平相对丰度Fig.4 Relative abundance of bacteria soil sample of different grassland types at the phylum level
在3 种类型草地土壤细菌属水平上共得到369 个细菌属水平类群,其中相对丰度大于1%的类群有18 个(图5,表4)。高寒草甸相对丰度大于1%的细菌类群有5 个,主要以RB41(6.57%)、鞘氨醇单胞菌属(3.43%)、慢生根瘤菌属(2.63%)等为主要类群;人工草地相对丰度大于1%的类群有7 个,主要以鞘氨醇单胞菌属(7.91%)、RB41(5.96%)、芽单胞菌属(1.53%)等为主要类群;沼泽化草甸相对丰度大于1%的类群有6 个,主要以RB41(3.90%)、硝化螺旋菌属(2.09%)、鞘氨醇单胞菌属(1.68%)等为主要类群。对不同类型草地土壤细菌属水平差异分析发现RB41、CL500-29_marine_group、中慢生根瘤菌属、土微菌属、类芽孢杆菌属和慢生根瘤菌属在高寒草甸显著富集(P<0.05);鞘氨醇单胞菌属、Subgroup_10、芽单胞菌属、MND1、出芽菌属、Ellin6067 在人工草地显著富集(P<0.05);硝化螺旋菌属、Massilia、Haliangium、假单胞菌属在沼泽化草甸显著富集(P<0.05,图5)。
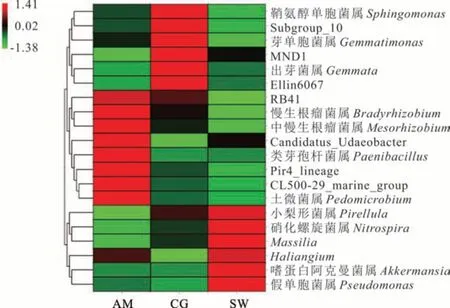
图5 不同类型草地土壤细菌属水平群落结构分析Fig.5 Analysis of soil bacterial community structure in different types of grassland at the genus level
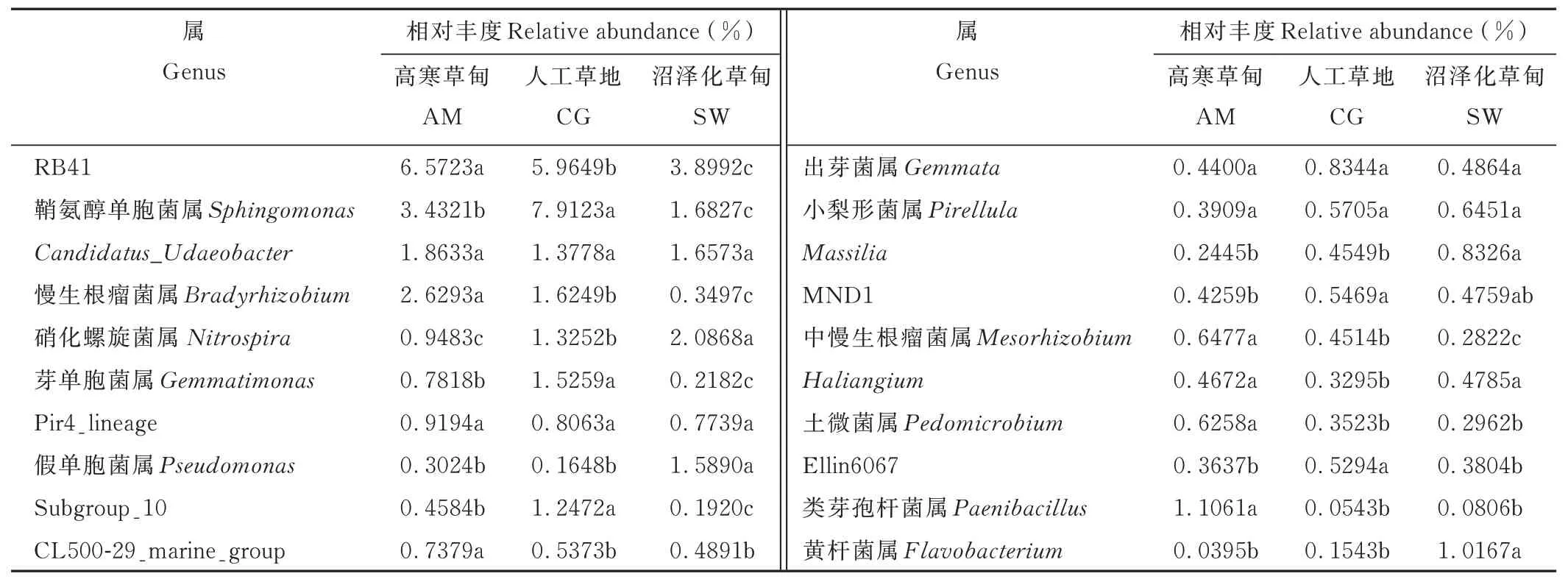
表4 不同草地土壤细菌属水平群落信息Table 4 Information regarding the bacterial community at the genus level in different grassland types
2.6 土壤环境因子与细菌群落的相关性分析
采用Mantel tests 分析土壤理化性质与细菌群落的相关性,土壤细菌群落结构与有机质碳、全磷、土壤含水量、硝态氮、全氮显著相关(P<0.05,表5)。

表5 土壤理化性质与细菌群落结构的相关性Table 5 Correlation between bacterial communities and soil properties
用显著相关的6 个土壤理化因子与细菌群落结构进行典范对应分析(CCA)。CCA 二维排序图可以直观地给出研究对象与环境变量之间的关系,排序轴与箭头连线夹角表示环境因子与排序轴的相关性,夹角越小表明关系越密切,而箭头连线表示环境因子与研究对象相关程度的大小,连线越短,相关性越小,反之越大。土壤有机质碳、全磷和含水量对细菌群落结构影响最大(P=0.001,图 6,表 6),pH 对细菌群落无显著影响。同时,沼泽化草甸与其他两类草地有明显的分异,土壤细菌主要聚类于土壤有机质碳、全磷、含水量高的区域,且沼泽化草甸土壤细菌群落受环境因子的影响大于其他两类草地。

表6 土壤理化性质与门水平优势细菌相关性Table 6 Correlation between properties and soil dominant bacteria at the phylum level
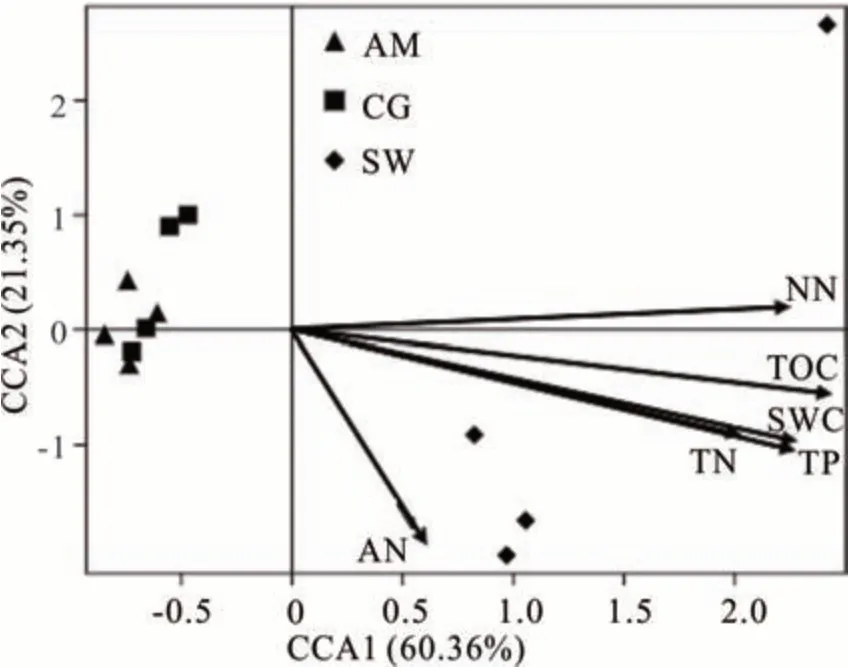
图6 土壤细菌群落与环境因子间的典范对应分析Fig.6 Canonical correspondence analysis of bacterial communities with basic soil physical and environmental factors
3 讨论
草地植被-土壤-微生物的作用与反馈是贯穿草地生态系统的重要纽带,植物通过凋落和分泌为土壤微生物提供营养,促使植物和微生物之间协同进化[25],土壤微生物通过选择植被间接反映生态系统在演替过程中土壤和植被群落的演替方向。本研究通过高通量测序技术对祁连山3 种草地类型土壤细菌群落变化进行探究,结果表明不同草地土壤细菌群落差异显著,多样性分析显示人工草地Chao1 指数显著高于高寒草甸和沼泽化草甸(P<0.05)。这可能是微生物对草地植被变化的响应,本研究中人工草地为建植4 年的草地,正处于人工草地暂稳态的演替阶段[26],植被的稳态可能重新塑造了适应于人工草地的微生物群落区系,Zhu 等[27]的研究表明,人工草地通过良好的根系网络发育和凋落物积累改善了土壤生境,导致微生物群落发生变化。伍文宪等[28]在川西北以天然草地和两种人工草地为研究对象,结果表明人工草地与天然草地的细菌Chao1、Shannon 指数无显著性差异,本研究的结论与之相反,可能是由于人工草地地上植被不同及区域独特性造成。本研究中高寒草甸的Chao1 指数显著高于沼泽化草甸,这可能与沼泽化草甸的性质有关,沼泽化草甸处于向草甸过渡末期,加之人为因素的影响,原来积累的养分流失,微生物数量也会相应地减少[29],另一方面植被的类型及其多样性也可能影响微生物的多样性,高寒草甸和沼泽化草甸植被物种组成有差异,造成对土壤表面的覆盖程度不相同,同时土壤温度、湿度的差异,加之不同植被群落结构植物的生长发育、枯枝落叶物多少有别,从而影响了土壤微生物数量和活动状况。
进一步分析不同草地类型土壤细菌群落组成,发现本研究中3 种草地均以变形菌门、酸杆菌门、放线菌门和浮霉菌门为优势类群,与绝大多数土壤优势细菌门基本相同[30]。王颖等[31]以固原半干旱典型草原为研究对象,发现放线菌门、变形菌门、酸杆菌门和绿弯菌门是土壤细菌的主要类群;Zhang 等[32]在青藏高原北麓河流域以草甸、草原为研究对象,发现土壤细菌群落结构主要由变形菌门、放线菌门、酸杆菌门、拟杆菌门组成;Li 等[33]对西藏高寒草甸土壤细菌的研究指出无论高寒草地退化程度如何,变形菌门,放线菌门和酸杆菌门都是主要细菌类群,本研究结果与其基本一致。表明区域大尺度上土壤细菌群落的组成和分布有差异,但细菌优势类群没有显著的差异。Chu 等[34]也探讨了区域尺度和环境因子对微生物的影响,发现环境因子是区域微生物分布的主要驱动力。而本研究中植被的差异是最有可能造成微生物差异的环境原因,植被类型不同影响土壤理化性质,而土壤微生物受理化性质的影响出现地域性特点[35-36]。本研究中发现变形菌门是各草地丰度最大类群,这与Bazylinski 等[37]的研究一致,证实了变形菌门是陆地土壤生态系统细菌群落的优势类群。差异性分析显示沼泽化草甸土壤细菌群落的变形菌门丰度显著高于高寒草甸和人工草地,进一步的相关性分析表明变形菌门与有机质碳、全磷和含水量极显著正相关(表6),这可能是沼泽化草甸生态脆弱的原因,超过1/3 的OTU 来源于变形菌门,群落组成的单一化可能导致其联系较为紧密,对外界的抵抗能力反而较弱[38]。而酸杆菌门和放线菌门在沼泽化草甸最低,并与土壤有机质碳、土壤含水量和氨态氮呈显著负相关(P<0.05),说明放线菌门和酸杆菌门易在偏贫瘠的地方富集。
祁连山3 种类型草地土壤细菌群落结构与土壤有机质碳、全磷和含水量极显著正相关。朱平等[39]分析了祁连山中段垫状植被、高寒草甸、沼泽草甸和高寒灌丛植被群落,发现土壤pH 是影响土壤细菌群落分布最主要的因子,本研究结果与之相反。pH 是大尺度上造成微生物群落差异的主要原因,张于光等[40]认为pH 是影响微生物海拔分布格局的主要原因。当pH 偏离中性,微生物群落会受到环境胁迫压力[7]。本研究pH 介于6.8~7.3,趋于中性,故对土壤细菌群落结构无明显影响。在本研究中有机质碳、全磷和含水量是微生物群落差异的驱动因子,也是造成沼泽化草甸与高寒草甸、人工草地微生物群落差异的主要原因。土壤有机碳与植被物种组成有关,不同的物种凋落物、根系分泌物为微生物提供了不同的碳源,由此导致细菌群落结构差异;其次含水量对细菌群落有影响,沼泽化草甸夏季雨后覆水,旱季淹水环境逐渐改善,但土壤通透性差且氧气含量低,尽管高含量的土壤有机质、全氮、全磷、硝态氮和适宜的pH 值为土壤细菌提供良好的生存条件,但该环境不利于好氧微生物的生长。如在本研究中沼泽化草甸细菌属水平上显著富集的硝化螺旋菌属、假单胞菌属是对水生植物重要的细菌,参与多种生态反应。而在高寒草甸富集的细菌RB41、中慢生根瘤菌属和慢生根瘤菌属是变形菌门的一种与寄主植物共生的细菌,能将游离铵(NH4+)固定[41]。一般高寒草甸中豆科类物种丰度较大,可能是造成此类菌富集的主要原因。
4 结论
本研究利用高通量测序技术测定并揭示了祁连山高寒草甸、人工草地、沼泽化草甸土壤细菌群落结构,探讨了土壤理化性质对细菌群落的影响。本研究发现细菌门水平上,3 地均以变形菌门、酸杆菌门、放线菌门和浮霉菌门为主要类群,属水平上表现出不同类型草地细菌富集类型不同。PCoA 分析显示3 种草地类型细菌群落结构有差异,土壤有机质碳、全磷、土壤含水量与土壤细菌群落结构极显著相关(P<0.01),是影响3 种草地类型土壤细菌分布的主要因素。

