肝纤维化评价指标预测肝癌患者肝切除术后肝功能衰竭
林水荣,林浩钟,钱柏锋,李牧其,彭 洪,华赟鹏,彭宝岗,沈顺利
(1.中山大学附属第一医院肝外科,广东广州,510080;2.中山大学附属第一医院胆胰外科,广东广州,510080)
肝细胞癌(hepatocellular carcinoma,HCC)是全球第六大最常见的癌症和第三大癌症相关死亡原因[1],在各种治疗策略中,手术切除仍被认为是目前最有效的治疗方法,对于能够获得根治性切除的HCC患者,5年生存率可以达到60%~80%[2]。肝切除术后肝功能衰竭(post-hepatectomy liver fail⁃ure,PHLF)是术后常见并发症,由于缺乏有效的治疗,仍是肝切除术后死亡的主要原因之一。PHLF常用的评估标准包括:“Mullen’s标准”[3]、“50-50标准”[4]以及国际肝脏外科研究组(ISGLS)标准[5],目前以“50-50标准”和ISGLS标准应用最为广泛,尚无有效预测PHLF的“金标准”。尽管围手术期管理已经取得了很大的进步,但我国多数HCC患者伴有肝纤维化或肝硬化的背景[6]。因肝实质损伤影响了术后的肝再生能力,因而更容易发生PHLF[7],能够准确的在术前预测PHLF并合理的选择手术患者具有重要意义[8]。Child-Pugh评分是目前应用最广泛的评价肝功能的方法,但是评分过于简单,难于细化患者肝功能状态[9]。无创肝纤维化评估指标如天冬氨酸转氨酶-血小板比率指数(as⁃partic aminotransferase-platelet ratio index,APRI)[10]和肝脏纤维化-4指数(liver fibrosis-4 index,FIB-4)[11]被证实可以经济、有效的预测肝纤维化和肝硬化,并可用于评估HCC患者的肝功能储备和预后[11-15]。有研究提示FIB-4和APRI在预测HCC患者肝切除术预后中具有一定作用[14,16],但两者在肝切除术后肝功能的预测效果有待证实。本研究中,我们旨在探讨术前APRI和FIB-4两种评分系统对HCC患者肝切除术后PHLF的预测效果。
1 材料与方法
1.1 数据来源及研究对象
本研究为回顾性研究,纳入了2014年1月至2020年12月在中山大学附属第一医院肝外科因肝细胞癌行肝部分切除术的426例患者。入组标准:①Child-Pugh A/B级患者;②术前未行TACE、PVE及靶向治疗等辅助治疗;③首次行肝部分切除手术,未行分阶段二步肝切除术;④术后病理证实为HCC。排除标准:①临床或病理数据缺失者;②同时合并有其他恶性肿瘤患者;③合并心肺疾病,肾功能不全或者严重脑病等。④合并乙型肝炎活动期患者。本研究已经通过中山大学附属第一医院临床医学研究伦理委员会审批并取得患者知情同意。
1.2 定义和诊断
根据“50-50标准”,PHLF被定义为:术后第5天或以后,血清总胆红素(total bilirubin,TBIL)>50 μmol/L(相当于>3 mg/dL),同时凝血酶原时间(pro⁃thrombin time,PT)<50%(或国际标准化比值INR>1.7)为特征[4];临床显著门静脉高压(clinically sig⁃nificant portal hypertension,CSPH)被定义为:根据内镜检查或术中发现胃底食管静脉曲张,或血小板计数低(platelet,PLT<100×109/L)同时伴脾肿大(超声、CT或MRI图像直径大于12 cm)的患者[17]。
APRI、FIB-4是根据诊断HCC时的实验室数据谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine transaminase,ALT)、PLT等计算的:APRI=(AST/正常值上限)/PLT(109/L)×100[10],FIB-4=[年 龄×AST(U/L)]/[PLT(109/L)×ALT(U/L)1/2][11]。
小范围肝切除术定义为手术肝切除范围少于3个肝段(包括单段切除以及两段切除),大范围肝切除术定义为切除3个或3个以上肝段(包括左/右三叶切除、半肝切除以及扩大半肝切除)。
1.3 统计学方法
所有统计分析均采用R(version 4.0.5)进行,符合正态分布的连续变量用均数±标准差表示,非正态分布的连续变量用中位数和四分位数M(P25~P75)表示。用Mann-WhitneyU检验和评价类别间的显著性差异,分类变量采用χ2检验或Fisher准确检验。采用Logistic回归模型进行单因素分析,P<0.05的变量纳入多因素Logistic回归分析,通过逐步回归分析进一步确定预测PHLF的独立危险因素,P<0.05被视为差异有统计学意义。采用受试者生成工作特征(ROC)曲线分析和评价不同无创方法预测PHLF的能力,并通过计算最佳临界值,确定FIB-4、APRI、Child-Pugh评分预测PHLF的最佳临界点。
2 结果
2.1 患者的基线特征
本研究总共纳入了426例患者,男性患者383例(89.9%),女性患者43例(10.1%)。其中Child-Pugh A级的患者有396例(93.0%),B级的患者30例(7.0%)。乙肝表面抗原阳性的患者364例(85.4%),伴有临床显著门静脉高压(CSPH)的患者32例(7.5%),行小范围肝切除术的患者200例(46.9%),其中单段切除术的患者有71例(16.7%),两段切除术的患者有129例(30.2%);行大范围肝切除术的患者226例(53.1%),其中行左/右三叶切除术的患者有58例(13.6%),行半肝切除术的患者有149例(35.0%),行扩大半肝切除术的患者有19例(4.5%);术后病理提示肝脏无纤维化或肝硬化的患者有113例(26.5%),肝纤维化患者158例(37.1%),肝硬化患者155例(36.4%;表1)。
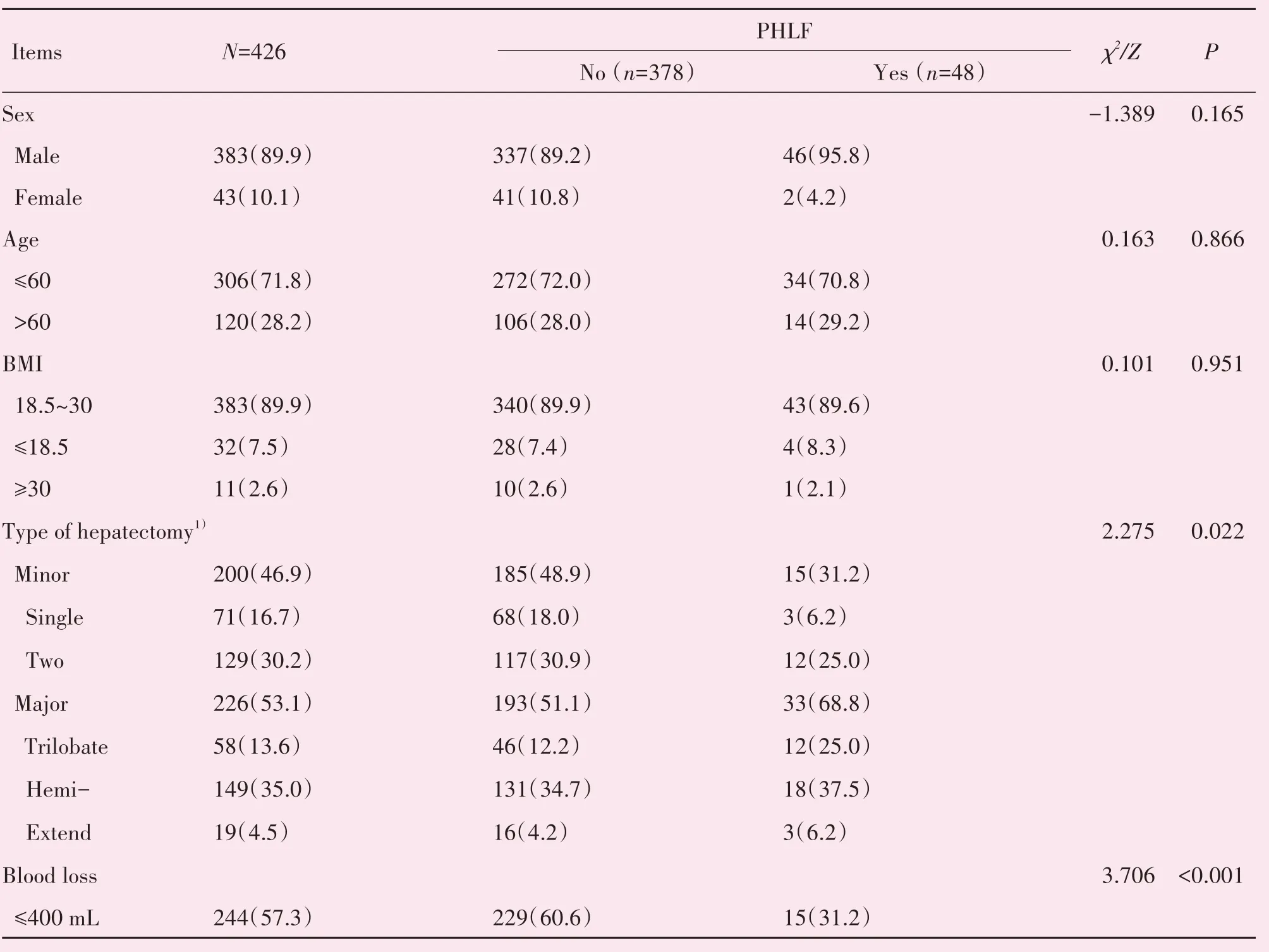
表1 患者基线资料表Table 1 The characteristic of patients [n(%),M(P25~P75)]
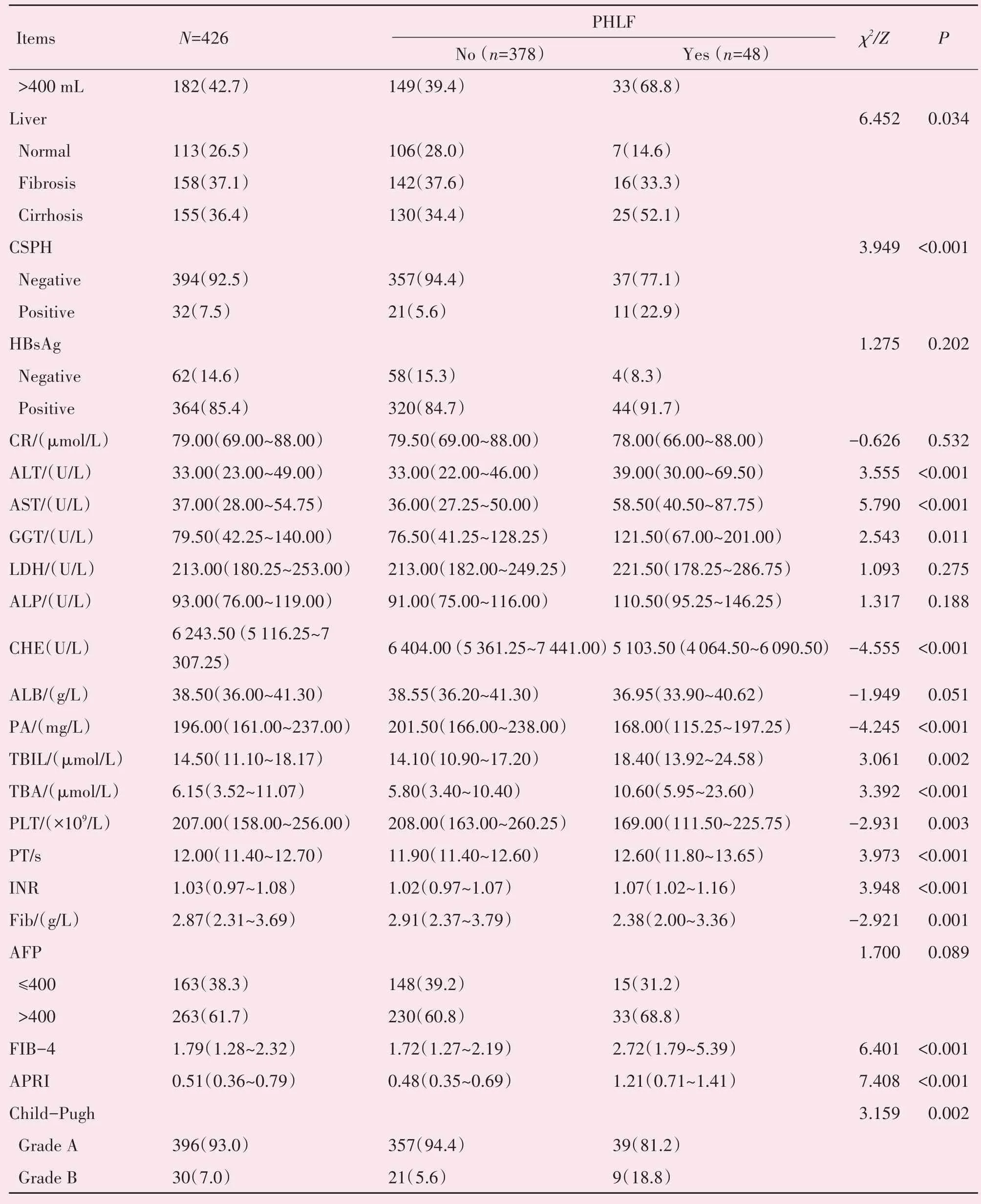
续表
2.2 肝切除术后肝功能衰竭危险因素的单因素和多因素分析
通过文献检索,我们将有可能对PHLF有影响的临床和实验室指标进行了总结并纳入单因素分析,结果显示:肝切除范围、术中失血量、肝脏质地、CSPH、ALT、AST、GGT、CHE、PA、TBIL、TBA、PLT、PT、INR、Fib、FIB-4、APRI、Child-Pugh评分均与PHLF显著相关(P<0.05)。将上述因素纳入多因素分析后显示:大范围肝切除术(OR=3.1,P=0.023),术中失血量>400 mL(OR=3.07,P=0.014),术前TBIL(OR=1.03,P=0.019),术前PLT(OR=1.008,P=0.007),术 前Fib(OR=0.43,P=0.002),FIB-4(OR=2.28,P<0.001),APRI(OR=7.12,P=0.003)为PHLF的独立危险因素(表2)。

表2 肝切除术后肝功能衰竭危险因素的多因素分析Table 2 Multivariable analysis of risk factors for post-hepatectomy liver failure
2.3 APRI、FIB-4及Child-Pugh评分对肝切除术后肝功能衰竭的预测分析效能
考虑到Child-Pugh评分为临床工作中评估肝功能最常用的参数之一,我们将APRI和FIB-4这两个独立预测因子与其进行对比。通过ROC曲线分析,APRI[AUC=0.816,95%CI(0.736,0.895);P<0.001]和FIB-4[AUC=0.728,95%CI(0.631,0.825);P<0.001]对PHLF的预测能力均优于Child-Pugh评分[AUC=0.566,95%CI(0.473,0.659),P=0.136;图1]。根据ROC曲线特征计算,APRI预测PHLF的最佳临界值为0.81,此时敏感性为83.1%,特异性为72.9%,APRI>0.81组的PHLF发生率高于APRI≤0.81组[35.4%(35/99)vs.4%(13/327);P<0.001];FIB-4指数的最佳临界值为2.83,敏感性和特异性为分别为92.9%、50.0%,根据最佳临界值分组,FIB-4>2.83组的PHLF发生率高于FIB-4≤2.83组[47.1%(24/51)vs.6.4%(24/375);P<0.001]。
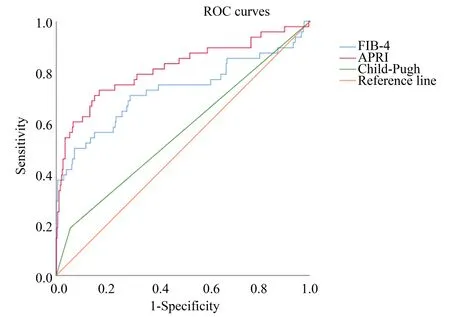
图1 APRI、FIB-4和Child-Pugh评分预测PHLF的ROC曲线分析Fig.1 The ROC curve analysis of APRI,FIB-4 and Child-Pugh scores in predicting PHLF
2.4 APRI、FIB-4、Child-Pugh评分在肝切除范围亚组中对肝切除术后肝功能衰竭的预测效能
通过对总体样本的多因素分析得出,肝切除范围是术后PHLF发生的独立危险因素之一。为进一步研究肝切除范围对PHLF发生的影响,本研究将纳入研究的患者分为小范围肝切除组(200/426,46.9%)和大范围肝切除组(226/426,53.1%)。
在小范围肝切除亚组中,共有15例(7.5%)患者发生PHLF,多因素Logistics回归分析提示:FIB-4(OR=2.68,P<0.001)、Child-Pugh(OR=14.56,P=0.028)是小范围肝切除亚组术后发生PHLF的独立危险因素之一(表3)。

表3 小范围肝切除亚组肝切除术后肝功能衰竭的多因素分析Table 3 Multivariable analysis of risk factors for post-hepatectomy liver failure in minor hepatectomy
通过ROC曲线分析得出APRI、FIB-4和Child-Pugh评分的AUC值分别为:APRI[AUC=0.839,95%CI(0.719,0.960);P<0.001]、FIB-4[AUC=0.757,95%CI(0.574,0.940);P=0.001]、Child-Pugh评 分[AUC=0.623,95%CI(0.506,0.739);P=0.115],APRI及FIB-4对PHLF的预测能力均优于Child-Pugh评分(图2)。
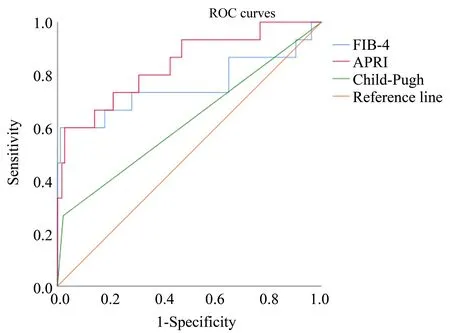
图2 APRI、FIB-4和Child-Pugh评分预测小范围肝切除亚组PHLF的ROC曲线分析Fig.2 The ROC curve analysis of APRI,FIB-4 and Child-Pugh scores for predicting PHLF in the subgroup of minor hepatectomy
在大范围肝切除亚组中,共有33例(14.6%)患者发生PHLF,多因素Logistics回归分析提示:APRI(OR=11.95,P<0.001)是大范围肝切除亚组术后发生PHLF的独立危险因素之一(表4)。
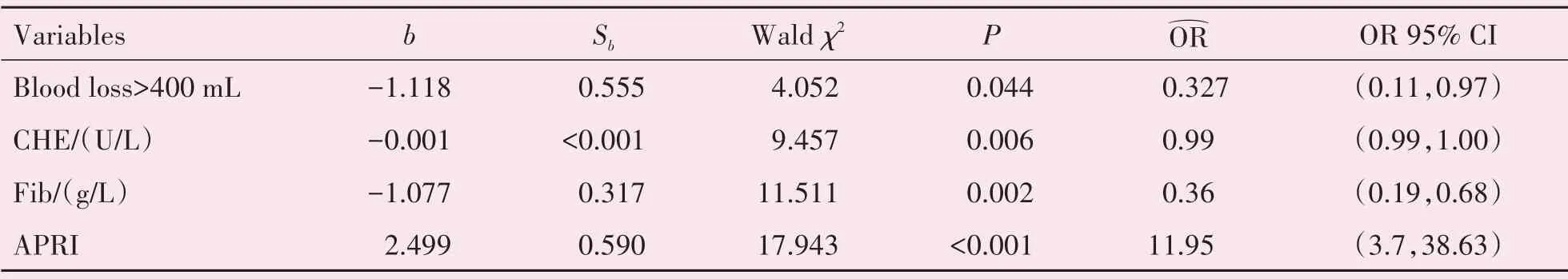
表4 大范围肝切除亚组肝切除术后肝功能衰竭的多因素分析Table 4 Multivariable analysis of risk factors for post-hepatectomy liver failure in major hepatectomy
进一步通过ROC曲线分析得出APRI、FIB-4和Child-Pugh评分的AUC值分别为:APRI[AUC=0.801,95%CI(0.696,0.905),P<0.001]、FIB-4[AUC=0.728,95%CI(0.609,0.847),P<0.001]、Child-Pugh评 分[AUC=0.532,95%CI(0.422,0.642),P=0.561;图3],APRI、FIB-4对PHLF的预测能力均优于Child-Pugh评分(P<0.05)。APRI与FIB-4两者分别在大、小范围肝切除中有作用,但都优于Child-Pugh评分。
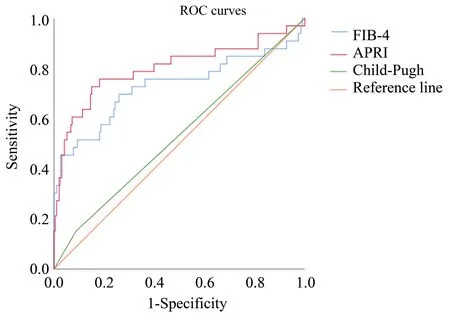
图3 APRI、FIB-4和Child-Pugh评分预测大范围肝切除亚组PHLF的ROC曲线分析Fig.3 The ROC curve analysis of APRI,FIB-4 and Child-Pugh scores for predicting PHLF in the subgroup of major hepatectomy
2.5 APRI、FIB-4在不同Child-Pugh分级状态下对肝切除术后肝功能衰竭的预测效能
根据Child-Pugh评分,426例患者中Child-Pugh A级的患者有396例(93.0%),Child-Pugh B级的患者30例(7.0%)。在Child-Pugh A级患者中共有39例(9.8%)患者发生PHLF,根据ROC曲线(图4)分析,APRI的预测效能[AUC=0.801,95%CI(0.707,0.895)]显著高于FIB-4[AUC=0.711,95%CI(0.603,0.820)],P=0.002。

图4 APRI、FIB-4预测Child-Pugh A级患者PHLF的ROC曲线分析Fig.4 The ROC curve analysis of APRI,FIB-4 for pre⁃dicting PHLF in patients with Child-Pugh grade A
在Child-Pugh B级患者中共有9例(30%)患者发生PHLF,APRI、FIB-4的AUC值分别为:APRI[AUC=0.820,95%CI(0.673,0.968),P=0.006]、FIB-4[AUC=0.788,95%CI(0.573,1.000),P<0.014],APRI对PHLF的预测效能略高于FIB-4(P=0.77;图5)。

图5 APRI、FIB-4预测Child-Pugh B级患者PHLF的ROC曲线分析Fig.5 The ROC curve analysis of APRI,FIB-4 for pre⁃dicting PHLF in patients with Child-Pugh grade B
3 讨论
PHLF是肝切除后严重的并发症之一,是肝切除术后死亡的主要原因,在我国,大多数HCC患者都伴随着肝纤维化或肝硬化的背景,本研究中伴有显著的肝纤维化或肝硬化的患者占73.5%(313/426),术前对肝纤维化和肝硬化的准确评估对减少术后并发症的发生,尤其是PHLF的发生显得至关重要。随着APRI和FIB-4等一些无创肝纤维化评估指标的提出,在一定程度上可作为代替肝脏活检的肝脏纤维化评估指标[12-13]。在本研究中,通过分析我们证明了APRI与FIB-4均是PHLF的重要预测因子,ROC曲线分析指出:在整体队列中,APRI(AUC=0.816,P<0.001)、FIB-4(AUC=0.728,P<0.001)相比较于Child-Pugh评分(AUC=0.566,P=0.136)有着更大的AUC值,意味着APRI与FIB-4相比较于Child-Pugh评分有着更强的预测能力(P<0.005),其中以APRI的预测能力最为显著。
本研究中,大范围肝切除被证实是肝切除术后发生PHLF的独立危险因素之一,既往有研究指出,接受大范围肝切除的患者其术后PHLF的发病率要远远大于接受小范围肝切除患者[18],这是因为术中肝切除体积越大,将导致术后剩余残肝体积减小,当剩余残肝体积不能满足机体代谢等基本要求时就有可能发展为PHLF[19]。为进一步研究肝切除范围对PHLF发生的影响,本研究将纳入研究的患者分为小范围肝切除组(200/426,46.9%)和大范围肝切除组(226/426,53.1%)。我们通过ROC曲线分析发现,无论是在大范围肝切除亚组或小范围肝切除亚组中,APRI与FIB-4对PHLF的预测效能都高于Child-Pugh评分,在小范围肝切除亚组中,APRI对PHLF的预测效能高于FIB-4(P=0.17)、Child-Pugh评分(P<0.05),FIB-4与Child-Pugh评分两者之间没有显著性差异(P=0.24);在大范围肝切除亚组中,APRI对PHLF的预测能力优于FIB-4与Child-Pugh评分(P<0.05)。
Child-Pugh评分系统一直用于肝切除术前的风险评估,但Child-Pugh评分对预测PHLF的预测价值有限[9],一方面指出,根据Child-Pugh评分的分类,大部分患者被划分为A级,Child-Pugh A级包括范围广泛的患者,同为Child-Pugh A级患者,他们的肝功能可能会有很大的差异,其预后可能完全不同[20]。另一方面,Child-Pugh评分部分参数的判定具有较强的主观性,因此需要更加客观的评分方法准确的评估术前的肝脏功能。在本研究中,在Child-Pugh A级患者中,共有9.8%(39/396)的患者发生PHLF,而在APRI≤0.81和FIB-4≤2.83的患者中,分别只有4%(13/327)、6.4%(24/375)的患者发生PHLF,远远低于Child-Pugh评分。同时相比较于FIB-4,APRI对PHLF的预测效能均高于FIB-4对PHLF的鉴别能力。
本研究的不足之处在于是单中心回顾性研究,同时,本研究未采用影像学方法对术中肝切除的体积进行计算,因为不同的肝段之间的体积不一致,可能导致术中切除的肝脏体积也不尽相同。此外,如果能够结合术前吲哚菁绿检测有可能取得更好的结果,未来研究中我们将对此予以探讨。
通过本研究我们发现术前APRI与FIB-4都是肝切除术后PHLF发生的显著预测因子,对肝切除术后PHLF的发生有良好的预测效能。

