变应性鼻炎患者血浆细胞外囊泡对树突状细胞和巨噬细胞的调控作用
方淑斌,付清玲
(中山大学附属第一医院耳鼻咽喉科医院,广东广州 510080)
变应性鼻炎(allergic rhinitis,AR)是一种以炎症浸润、气道重塑和气道高反应为特点,由多种细胞和细胞因子参与的呼吸道变应性炎症[1-3]。AR发病率逐年上升且治疗仍以对症治疗为主[4]。因此,深入探讨AR的发病机制可为AR的临床治疗提供新型靶点。细胞外囊泡(extracellular vesicles,EVs)是由细胞释放的纳米级别微囊泡,可分为由多囊泡体途径形成的外泌体和由胞膜释放形成的细胞外囊泡[5-6]。EVs在呼吸道变应性炎症的发病过程中扮演着极为重要的角色[5,7]。其中,变应性呼吸道炎症患者肺泡灌洗液中的EVs所包含的miRNA和蛋白质与正常人不同,这些差异性表达的miRNA和蛋白质可通过调控免疫细胞的功能促进炎症反应[8-13]。此外,气道组织中炎症反应所产生的EVs亦可进入血液循环,且其所携带的miRNA等生物活性分子的表达谱亦与正常人存在差异[14-15]。在呼吸道变应性炎症中,外周循环中树突状细胞(dendritic cells,DCs)可分为髓系DCs(my⁃eloid DCs,mDCs)和浆系DCs(plasmacytoid DCs,pDCs),其中pDCs和mDCs均可参与调控炎症反应[16-17]。巨噬细胞(macrophages,Mφ)可分为M1型和M2型巨噬细胞,M2型巨噬细胞中TGM2表达升高可促进嗜酸性炎症浸润,而MRC1和IL-10升高则可抑制炎症浸润[18]。外周血循环中的单核细胞可在特定炎症因子的作用下分化形成DCs和Mφ进而促进炎症的发生发展。血浆EVs可通过调控辅助性T细胞的分化促进多发性硬化和风湿性关节炎等炎症性疾病的发展[19-20],表明血浆EVs具备一定的免疫应答的作用。但是,关于呼吸道变应性炎症患者血浆EVs对DCs和Mφ分化成熟和功能的调控作用则有待进一步探讨。因此,本研究拟通过体外细胞实验探讨AR患者血浆EVs(AR-EVs)对DCs和Mφ调控作用,从而为AR的发病机制提供新的理解。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞 本实验所用单核细胞、巨噬细胞和树突状细胞是由白膜来源外周血单个核细胞(peripheral blood mononuclear cells,PBMC)分选和诱导所得。其中,白膜由广州血液中心所提供,中山大学附属第一医院伦理委员会批准豁免签署知情同意书。
1.1.2 实验试剂 GM-CSF和M-CSF购自美国Pe⁃protech公司,IL-4购自美国R&D公司。流式抗体购自美国BD公司,内毒素(lipopolysaccharide,LPS)购自美国Sigma公司,Ficoll液购自美国MP Biomed⁃icals,荧光定量PCR试剂盒购自瑞士Roche公司,逆转录试剂盒购自日本Takara公司,Western Blot抗体购自美国Abcam公司。
1.2 实验方法
1.2.1 志愿者招募 在本研究中,我们招募了6位HC健康志原者(healthy control,HC)和6位AR患者。其中,AR患者主要诊断依据为Allergic Rhini⁃tis and its Impact on Asthma 2008[1],主要包括:鼻部症状(流鼻涕、鼻痒、鼻塞、打喷嚏和鼻后滴漏)和尘螨检测阳性。HC无任何鼻部症状及变应性鼻炎病史。所有的志愿者未使用抗组胺药物或激素1个月以上,无吸烟史,无其他疾病病史。每位志愿者抽取20 mL静脉血,300×g离心5 min去除血细胞,取上清进一步于2 000×g离心10 min去除细胞碎片和血小板等,将标本按2 mL/管冻存于-80℃冰箱。本研究已通过中山大学附属第一医院临床科研和实验动物伦理委员会审批(伦审[2019]331号)并得到患者的知情同意。
1.2.2 血浆EVs的提取 我们利用超速离心法分离HC血浆EVs(HC-EVs)及AR-EVs[21]。简述之,将冻存的血浆于4℃融化,用无菌的PBS溶液稀释10倍,于12 000×g离心30 min,然后于110 000×g依次离心2 h和70 min,最后用50μL PBS重悬,-80℃冻存(图1A)。
1.2.3 纳米颗粒示踪分析 用无菌PBS按1:50比例将EV样品稀释,取1 mL稀释后的样本按照说明用NS300 Nanosight instrument(Malvern,UK)进行检测,每个样本重复检测3次,每次1 min.
1.2.4 透射电镜 用2%戊二醛固定EV样品,然后将10μL EV样品滴至铜网上,2 min后滴加3%磷钨酸(pH=7.0)于铜网,2 min后滴加纯水,用滤纸从铜网边缘吸取多余的水,晾干后使用透射电镜(H7650;HITACHI,Tokyo,Japan)进行观察拍照。
1.2.5 Western Blot 将EV样品按体积加入Loading Buffer后,在恒温金属浴机上95℃孵育5 min;配制质量分数10%的分离胶和5%的浓缩胶,按顺序加入20μg/孔样品进行电泳,80 V电泳25 min,145 V电泳45 min;于15 V恒压转膜1 h将样品转到PVDF膜,用5%的脱脂奶粉于摇床上室温孵育1 h;用质量分数5%的BSA溶液按比例稀释抗体:CD63(1:2 000),Alix(1:5 000)和TSG101(1:1 000),于4℃孵育过夜,洗涤后与二抗(1:5 000)于室温孵育1 h,最后用显影液曝光显影。
1.2.6 人PBMC的分选 首先将白膜按2:1用PBS进行稀释,在50 mL离心管中加入Ficoll液,体积为稀释后白膜体积的一半,然后进行离心(778×g,20 min,RT),用移液枪小心吸出中间的PBMC层,根据所吸取的PBMC的体积近1:5加入PBS,进行离心(778×g,20 min,RT),所获取细胞即为CD4+T细胞。
1.2.7 CD14+单核细胞的分选 吸取1×108个PBMC,用175μL MACS Buffer重悬后,加入25μL CD14+磁珠,于4℃孵育15 min;安装好分选磁柱,向磁柱加入500μL MACS Buffer湿润柱子;用2 mL MACS Buffer重悬孵育后的PBMC,300×g离心5 min后,用1 mL MACS Buffer重悬细胞,待其缓慢流干后,再向磁柱加入500μL MACS Buffer 3次;最后再将磁柱放置于新的15 mL离心管上,加入1 mL MACS Buffer后快速用活塞将吸附于磁柱上的细胞挤压至离心管中,所获即为CD14+单核细胞。
1.2.8 巨噬细胞和树突状细胞的诱导 将5×105个CD14+单核细胞种植于24孔板内,分别用含M-CSF(50 ng/mL)的完全培养基(RPMI 1640+10%FBS)培养6天将其诱导成巨噬细胞;同样地,用含GMCSF(50 ng/mL)+IL-4(10 ng/mL)的完全培养基培养5天可将其诱导成为不成熟树突状细胞(immature DCs,IDC),再加入100 ng/mL LPS刺激2天即可获得成熟树突状细胞。
1.2.9 血浆EVs与单核细胞、巨噬细胞和树突状细胞共培养 将单核细胞、巨噬细胞和树突状细胞按5×105种植于24孔板,用RPMI 1640+10%FBS进行培养,并分别加入5×108HC-EVs和AR-EVs,收样后用于流式分析、PCR检测或ELISA检测。
1.2.10 流式分析 收集细胞后,根据需要按说明书加入相应的抗体,包括:CD14-PC7、HLA-DRAPC-A750、CD40-APC、CD80-FITC、CD86-PC7和CD68-PC7,孵育30 min后,收集细胞后进行流式分析(Beckman Coulter,美国),每个样本最终分析的细胞数大约为2×104。
1.2.11 聚合酶链反应 收集细胞,加入1 mL RNAiso Plus对细胞进行裂解,加入1/5 RNAiso Plus体积的氯仿进行萃取,取上清液并加入等体积的异丙醇进行沉淀,最后用75%的乙醇洗涤2遍。本研究中PCR所使用的引物为(5′→3′):

1.2.12 酶联免疫吸附测定(Enzyme-linked immu⁃nosorbent assay,ELISA)根据说明书,利用R&D DuoSet ELISA Kit对细胞上清进行检测。
1.3 统计学分析
采用GraphPad Prism 6统计软件进行数据分析,计量资料以均数±标准误(Mean±SEM)表示。两组间比较采用t检验,多组间数据比较采用单因素方差分析。P<0.05表明差异有统计学意义。
2 结果
2.1 血浆EVs的提取与鉴定
我们招募了6位HC志愿者和6位AR患者,入组志愿者的基本信息见表1。通过超速离心法分别制备HC-EVs和AR-EVs(图1A),利用透射电镜观察其形态结构,发现HC-EVs和AR-EVs均为直径约100 nm的囊泡,具备完整的膜结构(图1B)。通过Western Blot鉴定HC-EVs和AR-EVs中的特异性标记物,发现其均表达CD63、Alix和TSG101,同时HC-EVs和AR-EVs中这些特异性标记物的表达水平无显著差异(图1C)。此外,我们利用纳米颗粒示踪分析对所获取的HC-EVs和AR-EVs的颗粒数进行定量分析(图1D),两者之间的浓度亦未见明显差异。上述这些结果表明超速离心法可成功从血浆中制备EVs用于后续的实验研究。
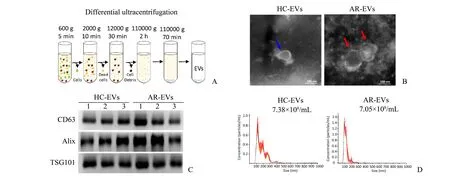
图1 血浆EVs的鉴定Fig.1 Characterization of plasma EVs

表1 志愿者基本信息Table 1 Baseline characteristics of volunteers
2.2 AR-EVs对树突细胞和巨噬细胞的分化无显著促进作用
由于巨噬细胞和树突状细胞均可从CD14+外周血单核细胞分化而来,因此,本研究首先探讨AR-EVs是否能够调控单核细胞向树突状细胞和巨噬细胞分化。我们分别于第0天和第3天给予单核细胞HC-EVs和AR-EVs进行刺激,并于第5天收集细胞进行分析(图2A)。通过流式分析,我们发现CD14(F=1.38,P=0.29)、CD80(F=0.86,P=0.45)、CD86(F=0.60,P=0.57)和CD68(F=2.35,P=0.14)的组间比较均无显著差异。此外,HC-EVs和AR-EVs对单核细胞特异性标记物CD14的表达水平无明显抑制作用(P=0.92)。同时,HC-EVs和AR-EVs对巨噬细胞特异性标记物CD68(P=0.13)的表达水平以及树突状细胞特异性标记物CD80(P=0.68)和CD86(P=0.71)的表达水平亦无明显的作用(图2B、C)。上述结果表明HC-EVs和AR-EVs在单核细胞向巨噬细胞和树突状细胞的分化过程均无显著促进作用。

图2 血浆EVs对树突状细胞和巨噬细胞分化的调控作用Fig.2 Effects of plasma EVs on differentiation of dendritic cells and macrophages
2.3 AR-EVs对树突状细胞成熟的调控作用
一般而言,单核细胞在GM-CSF和IL-4的作用下可分化形成iDC,其在LPS的作用下再进一步分化为成熟DC。既然AR-EVs对单核细胞向iDC分化无显著促进作用,那么其能否促进i DC向mDC的成熟呢?为此,我们进一步于第5天用5×108/mL HC-EVs和AR-EVs刺激iDC,并于第7天收集细胞进行分析(图3A)。结果表明,HLA-DR(F=8.04,P=0.008 5)、CD40(F=11.38,P=0.002 9)和CD80(F=14.50,P=0.001 3)的组间比较均具有显著差异。LPS作为阳性对照可显著上调HLA-DR(P=0.007 5)、CD40(P=0.004 6)和CD80(P=0.003 5)的表达水平。不过,HC-EVs和AR-EVs处理对HLA-DR(P=0.99)、CD40(P=0.99)和CD80(P=0.97)的表达水平没有明显作用(图3B)。上述结果表明,AR-EVs对DCs的成熟亦无显著调控作用。
2.4 AR-EVs可促进巨噬细胞向M2型分化
Mφ在不同的炎症环境中可分别极化为M1型和M2型Mφ,其分别主导Th1和Th2型炎型的发生发展,Th2介导的变应性鼻炎主要是由M2型Mφ参与介导。由于上述结果发现AR-EVs对Mφ分化无显著促进作用,那么AR-EVs对Mφ极化的调控作用又是如何的呢?为此,我们于第7天给予HCEVs和AR-EVs刺激成熟的Mφ,并于第9天收集细胞进行分析(图4A)。我们发现与HC-EVs相比,AR-EVs可显著抑制M1型Mφ标记物IL-6(P<0.001)和TNF-α(P<0.05)的表达水平,同时可显著促进M2型Mφ促炎标记物TGM2的表达水平,但是AR-EVs对M2型Mφ抑炎标记物MRC1和IL-10的表达水平则无显著调控作用(图4B)。综上所述,我们的结果表明AR-EVs可促进巨噬细胞向促炎的M2型分化。
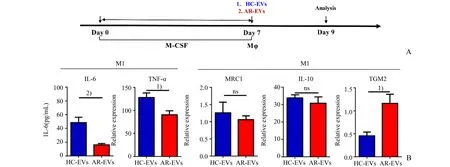
图4 血浆EVs对巨噬细胞极化的调控作用Fig.4 Effects of plasma EVs on polarization of macrophages
3 讨论
本研究发现AR-EVs对DCs和Mφ的分化以及iDCs的成熟无显著的调控作用,但其可显著促进Mφ向促炎的M2型极化和抑制Mφ向M1型极化,提示血浆EVs在AR发病过程中对巨噬细胞的功能调控扮演着重要的角色,为AR的发病机制提供了新的阐释。
既往研究已经表明,EVs具备显著的免疫调控作用。我们课题组前期已经证实经尾静脉给予间充质干细胞及其来源的EVs可通过调控DCs的分化成熟和巨噬细胞的分化与极化减轻呼吸道变应性炎症的发生发展[22-23]。在呼吸道变应性炎症中,树突状细胞可在外界环境变应原的作用下可释放携带抗原肽的EVs,并通过其表面的CD54与受体DCs表面的LFA-1结合进而促使CD4+T向Th2方向活化[24-25];单核细胞或巨噬细胞可在TGF-β,IL-1β和IFN-γ等炎症因子的作用下释放包含白三烯合成酶的EVs促进粒细胞的趋化和浸润[26]。这表明EVs一方面可通过其表面的膜蛋白与靶细胞膜蛋白相互作用,另一方面可通过EVs所包含的活性物质被靶细胞吞噬进入胞内而发挥作用,因而我们可通过调控EV中miRNA和蛋白质等有效成分的水平以及干扰EV与靶细胞之间的特异性接触等方式进行靶向治疗。与细胞来源的EVs相比,人体血浆中的EVs更为复杂,其主要是人体多种细胞在不同的炎症环境下产生的,因而单一细胞来源的EVs往往无法真实地明确呼吸道变应性炎症中EVs的作用。因此,在本研究中我们从HC和AR血浆中分离出EVs探讨其对树突状细胞和巨噬细胞的分化和功能的调控作用。值得注意的是,我们前期已经发现AR-EVs可显著促进CD4+T细胞向Th2分化(未发表数据),而在本研究中我们发现同样浓度的AR-EVs亦可显著促进Mφ向M2方向活化,抑制其向M1方向活化,尽管其对DCs和Mφ的分化以及iDCs的成熟则无显著调控作用。这证实了血浆EVs在Th2介导的AR发病过程中具备显著的免疫调控作用。
巨噬细胞是多种炎症反应发生发展的初始免疫细胞,其可通过释放多种炎症因子促进免疫反应。在气道组织中,原位巨噬细胞主要位于气道表面,保护机体免受外源微生物和过敏原等的侵害[27-28]。而在呼吸道变应性炎症中,外周血中的单核细胞可被趋化至气道组织中,并极化成M2型Mφ介导2型炎症反应。我们的研究结果证实,尽管血浆EVs对Mφ的分化成熟无显著调控作用,但是其可促进Mφ向M2型极化[29-31]。既往研究已经表明,M2型巨噬细胞中TGM2表达升高可促进炎症浸润,而相反地,M2型Mφ中MRC1和IL-10升高则可抑制炎症浸润[18]。我们的研究发现AR-EVs可抑制TGM2的表达,而对MRC1和IL-10的表达则无显著作用,表明AR-EVs可促进促炎的M2型巨噬细胞的极化。我们的结果初步证实了AR-EVs对Mφ的功能具备显著的免疫调控作用,证明血浆EVs是治疗AR的潜在靶点。然而,关于AR-EVs对Mφ的调控机制则有待进一步探讨。
综上所述,本研究通过体外细胞实验探讨AREVs对DCs和Mφ的分化成熟及其功能的调控作用,证实AR-EVs可显著促进Mφ向促炎的M2型极化,为AR的发病机制提供了新的诠释。

