电针联合神经导管移植对长缺损正中神经再生和功能恢复的影响
孟凡琪,裴文娅,焦博钰,阮经文,何冠蘅
(中山大学附属第一医院针灸科,广东广州 510080)
周围神经损伤(peripheral nerves injuries,PNI)是临床常见致残性疾病之一,其导致的一系列感觉与运动功能障碍,严重影响了患者的生活质量。而PNI的修复是一个漫长而又复杂的过程,特别是长节段神经缺损,由于患者的功能康复涉及神经解剖结构的完整性和连续性及神经传导性,所需时间更长,治疗难度更大。长节段外周神经损伤后,神经自体移植和神经导管桥接是目前修复神经结构的主流方式,其中文献和我们的预实验显示,自体移植优于导管桥接[1],但因会造成供区感觉功能缺失、并发神经瘤及遗留手术瘢痕等问题[2],故这种挖肉补疮式的自体移植并不是理想的桥接移植方法。随着技术的不断进步和完善,有研究表明壳聚糖神经导管移植能有效促进缺损外周神经的修复[3],甚至可以达到近似自体神经移植的结果[4]。因此,壳聚糖神经导管目前已成为临床移植、桥接的主要组织工程材料[5]。但问题是无论是自体移植还是壳聚糖神经导管桥接,虽然两者均能一定程度修复受损的外周神经结构,但许多患者的功能康复并没有因此而达到理想结果[6]。这种结构修复与功能康复的反差说明,长缺损外周神经通过神经导管桥接获得的仅是外在形式性结构的修复,而并非内在实质性结构的修复,从而说明壳聚糖神经导管桥接后虽然促进近端神经轴突再生,但并未能令再生纤维与远侧断端的残余神经重建靶向对接,故未能实现神经功能的恢复。这或许与缺损局部恶劣环境相关,如血供、神经营养因子等跟不上轴突再生需求,以及桥接后的应激反应令炎症加重,还有更为关键的外周神经损伤可导致相应脊髓节段脊神经元凋亡[7],令轴突纤维再生的数量减少等,都足以表明影响外周神经损伤再生的因素十分复杂。而雪旺细胞形成的Bungner带对神经纤维的再生起重要的诱导作用,因此,如何有效干预不利于神经再生的环境因素、降低神经元凋亡和引导近端轴突长入桥接导管并沿着雪旺细胞形成的Bungner带再生对接远端神经从而提高导管桥接成功率,是提升导管桥接后功能的关键。针灸作为临床治疗外周神经损伤常用治疗方法,研究表明其对改善患者的功能有很大帮助[8-9],尤其电针可使缺血性坐骨神经局部血流平稳增加,降低炎症反应作用[10],以及电针可以有效降低大鼠坐骨神经钳夹伤模型的脊髓中凋亡促进蛋白Caspase-3的机制,都说明电针可以有效改善PNI后的微环境[11-12],也有研究表明电针能促进雪旺细胞增殖和神经生长[13]。因此,若在壳聚糖神经导管桥接后立刻给予电针治疗,能否明显提升桥接后的功能?值得探讨。
1 材料与方法
1.1 材 料
1.1.1 实验动物 本研究采用的18只SPF级Sprague-Dawley(SD)(200±20)g大鼠均由中山大学东校区实验动物中心提供,实验动物许可证号为SYXK(粤)2016-0029,所有实验操作均按照《实验动物福利伦理审查指南(GB/T 35892-2018)》执行,并完全符合中山大学动物实验中心伦理委员会的要求。实验动物均置于安静环境下单笼饲养,房间采用12 h明-暗交替且保持恒温(22±0.5)℃、恒湿(55±10)%,保证大鼠自由饮食。
1.1.2 试剂与耗材 壳聚糖神经导管(发明专利号:ZL2004100094293),多聚甲醛(麦克林),封闭用山羊血清(北京中衫金桥),兔抗大鼠S100β(pro⁃teintech 15146-1-AP),小鼠抗大鼠NF(BioLegend 837904),羊抗小鼠Alexa Fluor488(abcam ab150113),羊抗兔Alexa Fluor555(Invitrogen A27039),Hoechst33342(Sigma),防淬灭封片剂(SouthernBiotech),PBS(中杉金桥),尼氏(Nissl)染色液(碧云天),95%酒精(广州化学试剂厂),二甲苯(广州化学试剂厂),中性树胶(中国上海标本模型厂),医用胶带,2 cm×2 cm金属网格,戊巴比妥钠,肝素钠注射液,生理盐水,10-0带线缝合针,止血钳,手术刀,眼科剪。
1.1.3 主要仪器 超纯水机(易普异达),激光共聚焦显微镜(Zeiss,LSM800,德国),全自动正置荧光显微镜(Leica,DM6B,德国)。体示显微镜(Zeiss),37℃烘箱。
1.2 实验方法
1.2.1 动物分组和长节段正中神经缺损模型的建立 将18只成年SD大鼠随机分为对照组(control group)、导管组(conduit group)、电针联合导管组(conduit+EA group),每组6只。1%戊巴比妥钠以0.4 mL/100 g剂量对大鼠进行麻醉,备皮。在消毒条件下于左侧腋下至肘关节部位切开皮肤,在显微镜下钝性分离肌肉,用玻璃分针分离出正中神经。将肘部近侧3 mm处的正中神经作为远端离断点,然后向上量度10 mm长为近端离断点,用眼科剪把上述两点处的正中神经剪断造成10 mm的神经缺损[14]。对照组在切除正中神经后不做任何处理,逐步缝合肌肉与皮肤。导管组、电针联合导管组皆在神经缺损区桥接壳聚糖神经导管,并使用医用10号带线缝合针将导管和正中神经两断端的神经外模缝合连接起来,随后逐层缝合各组大鼠的肌肉与皮肤。术后每只大鼠肌肉注射5万U/kg青霉素以防止感染,连续3 d。
1.2.2 电针治疗 电针联合导管组在术后第4天开始选取患侧上肢的曲泽、天泉穴治疗。穴位定位:参照《实验动物常用穴位名称与定位》曲泽穴位于大鼠前肢肘弯中,当肱二头肌腱的尺侧缘[15];天泉穴约位于大鼠臂内侧,腋前纹头下约5 mm处[16]。操作方法:使用直径为0.25 mm,长度为25 mm的穗鑫牌不锈钢一次性针灸针取相应穴位进行针刺,深度3~5 mm。随后接上英迪牌脉冲针灸治疗仪(常州英迪电子医疗器械有限公司生产),输出正极连接曲泽穴,负极连接天泉穴。选择疏密波,电流2 mA,频率2/100 Hz,治疗20 min后出针。每天治疗1次,每周连续治疗5次,共治疗4周,即28 d。
1.2.3 行为学观察 ①网格行走试验将大鼠置于的2 cm×2 cm的网格上,以患侧上肢掌心低于网格平面定为失足标准,分别计数3 min内大鼠患侧前肢的失足次数和迈出的总步数。大鼠失足率=(3 min内患侧前肢失足次数/3 min内大鼠患侧前肢迈出的总步数)×100%,各组分别在术后1周、2周、3周、4周进行检测。②除胶试验该试验是一简单易行的感觉、运动功能测定方法。将医用胶带剪为5 mm×5 mm大小,贴在大鼠患侧前掌,胶布需覆盖整个手掌和近端指间关节,以最长时间为3 min(180 s)内分别计算接触时间(contact time)和撕除时间(remove time)。接触时间为大鼠感觉到有胶带粘附于手掌并做出反应的时间点,即从胶带贴至患侧掌心并将大鼠放至地面时开始计时,直至大鼠摇晃手掌试图甩掉胶带或用嘴巴触碰胶带立即停止计时,记录该过程所耗时间。撕除时间为大鼠在健侧前肢的协助下,用嘴将胶带咬掉的时点[17]。各组大鼠在造模前、术后1周、2周、3周、4周进行测试,共测试5次。
1.2.4 动物灌注固定、取材及切片 1%戊巴比妥钠以0.4 mL/100 g剂量麻醉大鼠后进行心脏灌注与固定。打开胸腔,暴露心脏与主动脉。用灌注针从左心室心尖部插至主动脉后,剪开右心耳,灌注富含肝素钠的生理盐水约300 mL,直至大鼠肝脏变为乳白色,再灌注40 g/L多聚甲醛约300 mL,时间控制在30 min内。灌注完成后快速完整取出损伤处的导管及其近端远端神经纤维,并取对应C5节段脊髓,置于40 g/L多聚甲醛中3 d,30%蔗糖脱水3 d。OCT包埋正中神经与C5段脊髓组织进行冰冻切片,纵切正中神经损伤区的近端与远端,切片厚度为20μm;横切脊髓C5节段组织,切片厚度25μm。
1.2.5 免疫荧光组织化学染色 取出组织切片,用0.01 mol/L PBS洗10 min,重复3次。10%山羊血清封闭切片,置于37℃,30 min,弃去山羊血清后以1:200稀释比将R-S100β,M-NF稀释至1%Triton中(Triton用0.01 mol/L PBS配置)配制成一抗,阴性对照用0.01 mol/L PBS代替一抗,4℃过夜。隔天取出复温30 min,0.01 mol/L PBS清洗10 min,三次。以1:500稀释比将羊抗小鼠Alexa Fluor488、羊抗兔Alexa Fluor555稀释至1%Triton中,配制成二抗。加入二抗后置于37℃温箱1 h,0.01 mol/L PBS清洗10 min,三次。用Hoechst33342(以1:500稀释于PB中)进行染核,10 min,0.01 mol/L PBS清洗10 min,三次。防荧光淬灭封片剂进行封片。激光共聚焦显微镜下观察拍照,在1.1 mm×0.7 mm视野中计数。
1.2.6 尼氏染色 取出各组正中神经切片,75%酒精浸泡1 d,蒸馏水洗涤两次,每次2 min。尼氏染液染色15 min,并将其置于37℃温箱。随后蒸馏水洗涤两次,每次5 s。95%乙醇脱水2 min,重复两次。二甲苯透明5 min,两次。中性树胶封片。全自动正置荧光显微镜下观察并拍照。
1.3 统计学分析
实验数据用SPSS 20.0进行分析,Shapiro-Wilk检验数据的正态性,连续计量资料以均数±标准差()表示。两组间数据比较采用独立样本t检验;多组数据比较则采用单因素方差分析(oneway ANONA),采用LSD-t检验进行多样本均数间两两比较,若方差不齐则采用非参数检验。检验水准为0.05,P<0.05表示差异有统计学意义。用Graphpad Prism 8软件绘制统计图。
2 结果
2.1 各组大鼠正中神经运动和感觉功能恢复的情况
2.1.1 网格行走试验 各组大鼠在手术造模后1周、2周、3周、4周大鼠的前肢失足率均呈下降趋势(图1A)。在术后1周,三组间的前肢失足率差异无统计学意义(F=3.28,P=0.066)。在术后2周,三组间的前肢失足率差异有统计学意义(F=3.83,P=0.045),组间比较显示:电针联合导管组与对照组相比(P=0.021)、与导管组相比(P=0.048),差异均有统计学意义,而导管组与对照组之间差异无统计学意义(P=0.674)。在术后3周,三组间的前肢失足率差异有统计学意义(F=4.30,P=0.034),两两比较显示:电针联合导管组与对照组比较(P=0.013)、与导管组比较(P=0.048)差异均有统计学意义,导管组与对照组相比差异无统计学意义(P=0.524),在术后4周,三组间前肢失足率差异有统计学意义(F=28.89,P=0.000),电针联合导管组与对照组相比(P=0.000)、与导管组相比(P=0.004),导管组与对照组相比(P=0.001)差异均有统计学意义。
2.1.2 除胶试验 手术造模后1周、2周、3周、4周大鼠除胶试验中的接触时间(contact time)均呈下降趋势(图1B)。术前,三组间的接触时间差异无统计学意义(F=0.01,P=0.993)。术后1周,三组间的接触时间差异无统计学意义(F=0.39,P=0.682)。术后2周,三组间的接触时间差异有统计学意义(F=5.10,P=0.020),电针联合导管组与对照组相比(P=0.008)、与导管组相比(P=0.030)差异均有统计学意义,而对照组与导管组相比(P=0.538)差异无统计学意义。术后3周,三组间的接触时间差异有统计学意义(F=20.45,P=0.000),电针联合导管组与对照组相比(P=0.000)、与导管组相比(P=0.015),导管组与对照组相比(P=0.003)差异均有统计学意义。术后4周,三组间的接触时间差异有统计学意义(F=35.15,P=0.000),电针联合导管组与对照组相比(P=0.000)、与导管组相比(P=0.007),导管组与对照组相比(P=0.000)差异均有统计学意义。结合以上各组网格行走试验的前肢失足率和除胶试验中接触时间的结果,提示在神经缺损区移植壳聚糖导管维系外周神经在结构上的连续性能有助于大鼠运动和感觉功能的恢复,而在此基础上介入电针疗法具有更显著的疗效。
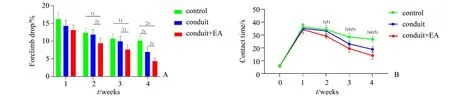
图1 大鼠正中神经运动和感觉功能恢复的情况Fig.1 Median nerve motor and sensory function recovery of rats
2.2 正中神经缺损区神经再长的情况
对照组为正中神经长节段缺损组,即在造成10 mm的缺损后并未对其移植壳聚糖神经导管桥接两侧断端,故长节段缺损区空着并无神经纤维,损伤区近端与远端断离的神经被结缔组织包裹并与周围组织粘连。因此,我们只对桥接了神经导管的两组(导管组和电针联合导管组)样本进行NF(标记神经纤维)和S100β(标记雪旺细胞)的双标免疫荧光染色,观察近侧断端神经纤维再生进入移植的神经导管内的情况(图2)。结果显示:在纵切面的正中神经缺损处桥接的神经导管内的近端和远端(图2B)皆有NF(绿色)和S100β(红色)的阳性表达,可见近端NF阳性的神经纤维沿着导管的方向再生至远端(图2A)。在电针联合导管组,可见移植的神经导管内有较多再生的NF阳性的神经纤维并且其周围有较多的S100β(红色)阳性的雪旺细胞包裹(图2A),即正中神经缺损的近端神经纤维沿着迁移入导管内形成Bungner带的雪旺细胞直行生长并穿过神经导管进入远端。在移植的神经导管近端和远端两个区域内计数NF阳性神经纤维数目和S100β阳性雪旺细胞数目,并采用独立样本t检验分析,统计分析结果显示:电针联合导管组近端NF数量(73.70±3.68)多于导管组近端NF数量(59.80±3.74),差异有统计学意义(t=14.52,P=0.000)。电针联合导管组远端NF数量(29.77±3.21)多于导管组远端NF数量(19.73±3.40),差异有统计学意义(t=11.74,P=0.000)。电针联合导管组近端S100β数量(67.60±2.76)多于导管组近端S100β数量(55.30±2.71),差异有统计学意义(t=17.43,P=0.000)。电针联合导管组远端S100β数量(43.30±3.73)多于导管组远端S100β数量(32.80±2.99),差异有统计学意义(t=12.01,P=0.000)。
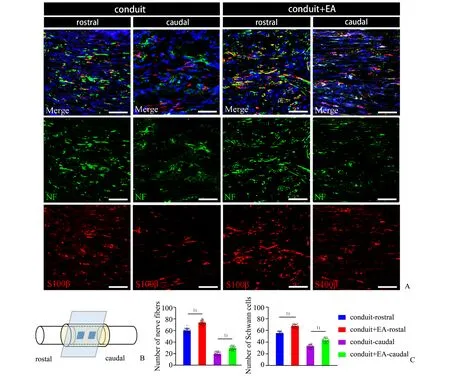
图2 正中神经缺损区神经再生的情况Fig.2 Nerve regeneration in median nerve defect
2.3 各组脊髓神经元的存活情况
采用尼氏染色检测发出正中神经的脊髓C5节段内左侧前角运动神经元的存活情况(图3)。方差分析结果显示三组之间的左侧前角运动神经元的数量差异有统计学意义(F=18.70,P=0.000),两两比较显示:电针联合导管组与对照组相比(P=0.000)、电针联合导管组与导管组相比(P=0.000)、导管组与对照组相比(P=0.023)差异均有统计学意义。表明导管组的神经元数目多于对照组,电针联合导管组的神经元数目显著多于导管组以及对照组,从而证明电针治疗能更好地促进受损正中神经对应脊髓节段组织内神经元的存活。
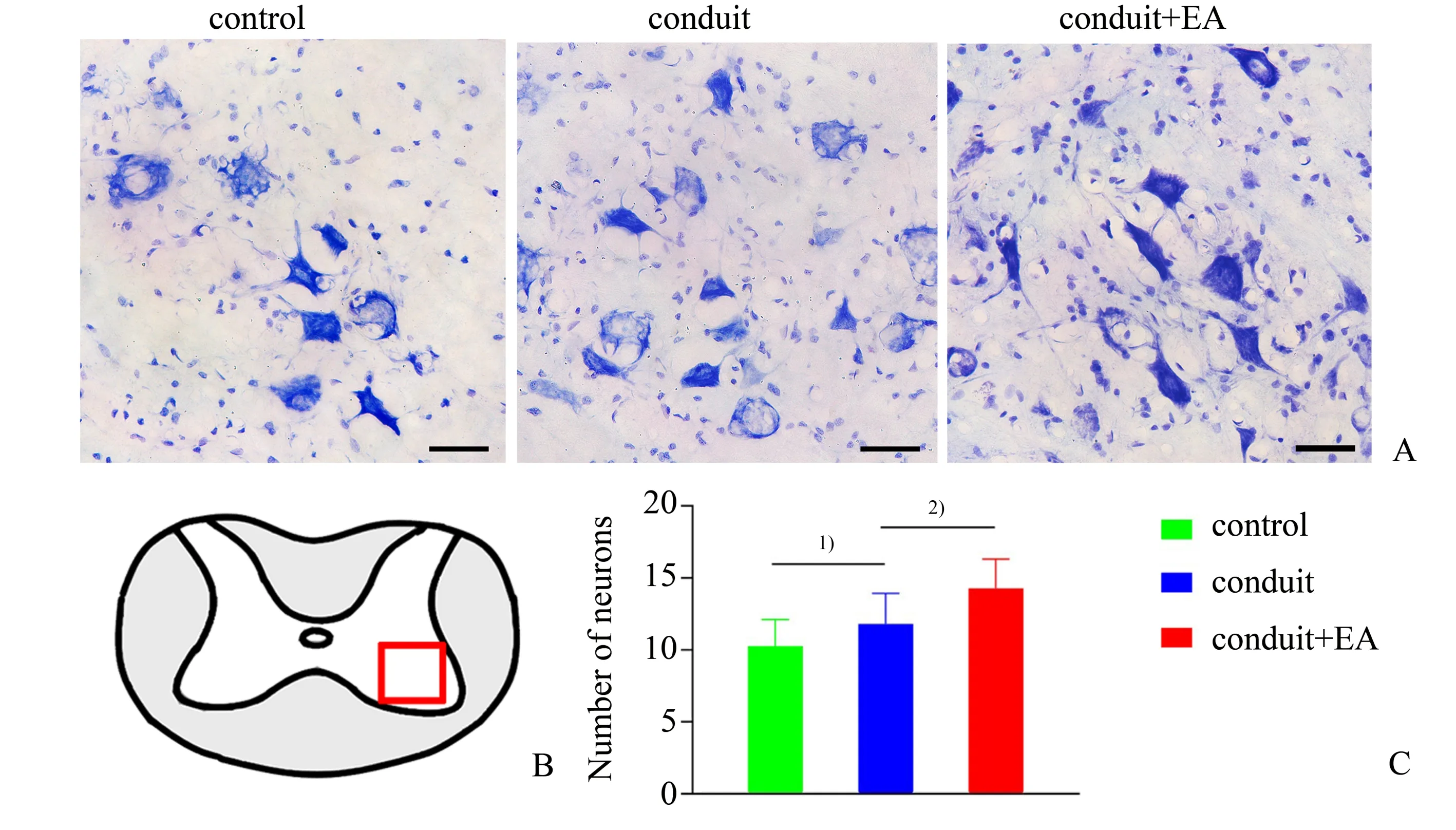
图3 C5节段脊髓组织内左侧前角运动神经元的存活情况。Fig.3 Survival of the left anterior horn motor neurons of spinal cord at C5 segment
3 讨论
神经导管的桥接能否令离断神经轴突再生并实现远近端对接,恢复神经传导功能,既是临床评判导管桥接成功与否的重要指标,也是患者运动、感觉功能恢复的必须。由于解剖结构的完整性和连续性是周围神经发挥正常神经传导性的基础,因此,导管桥接离断神经近侧和远侧断端对重建离断神经结构完整性和连续性,实现传导性具有重要的桥梁作用[18],但导管的本质仅是一段空腔管道,其本身并无神经传导功能。因此,壳聚糖导管桥接长缺损正中神经后,神经传导功能的恢复还有赖于近端新生的运动、感觉神经纤维能否趋向性长入导管并到达远端相应的功能束,最终实现传导性,完成靶组织器官的支配。
用胶原蛋白导管分别桥接10例神经瘤切除后的指神经缺损和96例创伤性指神经缺损,结果表明前者感觉功能恢复的优良恢复率为50%,后者仅为35%~45%[19-20]。由此可见,尽管导管桥接对神经轴突趋向性再生和对接起到了关键性作用,但桥接后患者神经功能的恢复率和恢复程度距离临床要求还有较大差距。这可能与桥接的空载导管内缺乏可支持轴突长距离再生的有利环境有关。近年学者研究发现,在导管内加入神经生长因子、血管内皮生长因子、药物及种子细胞等,与空载导管桥接相比,可以更好促进实验大鼠模型神经轴突延伸和髓鞘化,更利于缺损神经的再生、修复[21-22]。由于负载复合型导管的安全性和免疫反应性存在不确定性,其能否成功应用于临床尚待进一步验证。因此,导管与生化因子结合治疗长缺损神经仍需进一步深入研究。针灸作为一种纯物理性治疗,其治疗外周神经损伤的优势除疗效外,还可以完全避免负载型复合导管生化因子的不良反应。电针联合壳聚糖神经导管桥接治疗外周神经损伤具有临床安全性高优点,一旦取得成功极易实现临床转化。
除了空载壳聚糖导管内营养因子不足等因素不利神经再生外,外周神经损伤后相应阶段脊髓神经元的凋亡也是影响轴突再生质量的重要因素。正常生长的神经元必须依靠所支配的靶器官和远端胶质细胞提供的神经营养因子进行反哺,否则,神经元会因营养来源被切断导致营养不良而凋亡。如报道的面神经在断裂伤后1 d便有25.61%的运动神经元死亡,28 d便有高达51.19%的死亡率,42 d神经元死亡的数量可达33.67%[23]。神经元的凋亡预示着神经轴突纤维数量的丢失,进而影响神经感觉、运动功能的恢复。因此,维持发出外周神经的相应节段脊髓神经元数量的稳定也是长缺损外周神经功能恢复的关键。
在本研究中,电针联合导管组大鼠的长缺损正中神经在桥接壳聚糖导管4天后,即给与相应穴位电针28 d,结果显示其在正中神经缺损处近端、远端NF和S100β阳性的神经纤维和雪旺细胞表达的数目显著高于单纯导管组,在发出正中神经的脊髓C5节段内左侧前角运动神经元数量亦显著多于导管组与对照组。这表明电针联合壳聚糖神经导管桥接的综合疗法,能更好促进长缺损正中神经纤维的再生;同时,电针还能引导近端轴突趋向性长入和长距离生长、穿过导管到达远端;更重要的是介入电针治疗还能维持对应脊髓节段内神经元的存活,保证了长缺损正中神经运动、感觉纤维再生数量的需求。因此,可能正是由于电针治疗的干预,电针联合导管组大鼠自术后第2周开始,在网格行走试验中的前肢失足率便显著低于导管组,除胶试验中的接触时间亦显著短于导管组。但是,各组在撕除时间上尚未显示出统计学差异,这可能由于大鼠虽能感知到胶带的存在,但由于其撕咬胶带的动作受左侧正中神经损伤的影响,完成撕除胶带艰难所致。各组网格试验中前肢失足率和除胶试验中接触时间的研究结果间接表明电针的介入不仅能够促进神经离断近端轴突长距离生长,同时能更快地改善长缺损正中神经的运动和感觉功能。有研究显示,3个月为外周神经损伤后肌肉电生理的恢复时限,若超出3个月,即使恢复了神经功能,也无法恢复电生理功能[24]。因此,如何在有限的治疗时间窗内迅速恢复神经肌肉的功能,对患者长远功能康复具有决定性影响。本研究的结果说明电针联合导管治疗长缺损神经或是较好的选择之一。
总之,本研究结果提示电针联合壳聚糖神经导管移植能有效促进长缺损正中神经的再生和功能恢复,其可能的机制是:电针治疗可促进发出正中神经的脊髓神经元存活,并更好地促进缺损正中神经断端的雪旺细胞增殖迁移入桥接的神经导管内形成Bungner带,引导正中神经近侧断端的神经纤维沿着神经导管内的雪旺细胞再生并到达远侧断端,实现肌肉支配,进而更好促进大鼠损伤侧上肢的运动和感觉功能的恢复。因此,基于电针治疗的临床安全性,值得在临床中于神经导管桥接后联合电针尽早介入外周神经损伤的治疗。

