鱼藤酮对大鼠认知功能及其海马Warburg效应和小胶质细胞极化的影响
胡 宇,唐慧玲,田 清,张 平,邹 伟,唐小卿,
(1.南华大学附属第一医院检验科,湖南衡阳 421001;2.南华大学附属第一医院神经疾病研究所,湖南衡阳 421001;3.南华大学衡阳医学院神经科学研究所,湖南衡阳 421001;4.南华大学附属南华医院神经病学教研室,湖南 衡阳 421001)
帕金森病(Parkinson′s disease,PD)是一种仅次于阿尔兹海默症的常见神经退行性疾病。除典型的运动症状外,认知功能障碍已成为PD的一种常见非运动症状[1]。这种非运动症状随疾病的进展越发严重,并逐渐危害患者的日常生活、增加患者的经济负担。鱼藤酮(rotenone,ROT)是一种常用的杀虫剂,可有效地复制PD的病理学特征和包括认知障碍在内的行为表现[2]。但其引起PD动物模型认知障碍的机制尚不完全明确。因此,本研究采用ROT处理Sprague Dawley(SD)大鼠,观察其对大鼠认知功能的影响并探讨其潜在的机制。War⁃burg效应最初被定义为一种肿瘤细胞的能量代谢方式,即肿瘤细胞在有氧或无氧条件下均以糖酵解方式为主提供能量,并产生大量乳酸[3]。近年来Warburg效应已被证实存在于脑中并对学习记忆功能发挥着积极作用[4-5]。因此,我们观察ROT对大鼠海马Warburg效应的影响,以期探讨ROT对大鼠认知功能的影响是否涉及改变海马Warburg效应。小胶质细胞是大脑中一种重要的常驻神经免疫细胞,在受到多种因素刺激后可激活并极化为M1型小胶质细胞或M2型小胶质细胞[6]。小胶质细胞M1型极化引起多种认知障碍[7-8]。因此,我们还将观察ROT对大鼠海马小胶质细胞极化的影响,以期探讨ROT对大鼠认知功能的影响是否涉及海马小胶质细胞M1极化。
1 材料与方法
1.1 试剂及抗体
鱼藤酮、抗诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)抗体(SAB4502011)、Griess试剂盒、乳酸试剂盒均由美国sigma公司提供;抗己糖激酶2(hexokinase 2,HK2)抗体(#2867)、抗丙酮酸激酶同工酶2(pyruvate kinase iso⁃zyme M2,PKM2)抗体(#4053)、抗丙酮酸脱氢酶激酶1(pyruvate dehydrogenase kinase 1,PDK-1)抗体(#5662)、抗丙酮酸脱氢酶(pyruvate dehydroge⁃nase,PDH)抗体(#3205)、抗乳酸脱氢酶A(lactate dehydrogenase A,LDHA)抗体(#3558)、抗精氨酸酶1(arginase-1,Arg-1)抗体(#93668)均从美国CST公司获得;抗几丁质酶3样分子3(chitinase 3-like protein 3,Ym-1)抗体(ab192029)从美国Ab⁃cam公司购买;抗β-actin抗体、抗β-tubulin抗体均从武汉proteintech公司购买;IL-1β和IL-4的酶联免疫吸附试验(enzyme-linked immunosorbent as⁃say,ELISA)试剂盒由武汉ABclonal公司提供;TGF-β1的ELISA试剂盒从Biovision公司购买;BCA蛋白定量试剂盒来自北京康为公司。
1.2 实验动物及分组处理
22只SPF级雄性SD大鼠,体质量(290±10)g,购自湖南斯莱克景达实验动物有限公司,许可证号为SCXK(湘)2019-0004。大鼠适应环境1周后将其随机均分为对照组和模型组。每日于模型组大鼠的颈背部皮下注射鱼藤酮乳化液,剂量为2 mg/kg,持续5周,同时予以对照组大鼠的相同部位皮下注射同等体积生理盐水。本实验对动物的所有处理遵照中华人民共和国《实验动物管理条例》并经南华大学动物伦理委员会批准。
1.3 大鼠学习记忆能力检测
1.3.1 Y迷宫实验 本实验使用由3个互成120度夹角的臂组成的Y迷宫装置,其各臂均为50 cm×16 cm×20 cm(长×宽×高)。将大鼠放在Y迷宫3个臂的交叉处,位于装置中心上端的摄像头实时拍摄大鼠5 min内的自由活动轨迹。记录每只大鼠依次进入3个臂的正确交替次数和在3个臂间的总穿梭次数。按照“正确交替率=正确交替次数/(3臂间总穿梭次数-2)×100%”计算正确交替率。用正确交替率评估大鼠的空间识别能力;用总穿梭次数评价大鼠的活动能力以排除活动能力差异对实验结果的影响。
1.3.2 新物体识别实验 新物体识别实验装置除一个行为箱(规格:50 cm×40 cm×30 cm)外,还需要具有一定的硬度和质量的被识别物体。此实验分为3个阶段:适应期、训练期和测试期。在适应期阶段,将大鼠放入无任何物体的行为箱内,让其自由活动5 min。在训练期阶段,在行为箱的固定位置放置两个完全相同的物体,将大鼠沿一侧的箱壁背对物体放于行为箱中,记录5 min内大鼠对两相同物体的总探索时间。在测试期阶段,将其中一个已识别物体置换为一个新物体,再次将大鼠放入箱中并记录5 min内大鼠对两不同物体的探索时间。按照“识别指数(recognition index)=新物体探索时间/(新物体探索时间+旧物体探索时间)”计算识别指数来评估大鼠的学习与记忆能力;并用总探索时间排除动物运动能力和情绪对实验结果的干扰。
1.4 海马组织取材及匀浆
行为学实验结束后腹腔注射戊巴比妥麻醉大鼠,断头并分离出海马组织,随后将分离出的海马组织保存至-80℃冰箱。称取适量海马组织置于研磨管,加入生理盐水、RIPA裂解液、PMSF,经组织研磨仪裂解1 min,静置30 min,再低温离心10 min后收集上清液,上清液经BCA法蛋白定量后保存于-20℃冰箱,并用于后续实验。
1.5 乳酸含量测定
取海马组织上清液,使用乳酸试剂盒检测海马组织中乳酸含量。所有操作均按照乳酸试剂盒说明书进行。酶标仪测定450 nm处各样本OD值后计算出乳酸含量。
1.6 Griess法测一氧化氮含量
取海马组织上清液,使用Griess试剂盒测定海马组织中一氧化氮(nitric oxide,NO)含量。所有操作均按照Griess试剂盒说明书进行。酶标仪测定540 nm处各样本OD值后计算出NO含量。
1.7 酶联免疫吸附试验
取海马组织上清液,使用ELISA试剂盒测定海马组织中IL-1β、IL-4和TGF-β1含量。所有操作均按照IL-1β、IL-4和TGF-β1的ELISA试剂盒说明书进行。酶标仪测定450 nm处各样本OD值后计算出IL-1β、IL-4和TGF-β1的含量。
1.8 Western blot
BCA定量后的蛋白上清液煮沸变性,经SDSPAGE电泳后湿转至PVDF膜上,PVDF膜用5%脱脂牛奶室温封闭2 h后与一抗抗体在4℃条件下孵育过夜。第2天用TBST洗涤PVDF膜5次,每次5 min;再加入二抗抗体室温孵育2 h,TBST洗涤PVDF膜2次,每次10 min;最后用ECL化学发光液显色。用Image J软件进行图像的光密度分析。
1.9 统计分析
采用SPSS 20.0软件进行统计学分析,所有数据均采用均值±标准差()表示,两组多变量数据采用Hotelling’sT2检验(Hotelling’sT-squared generalized means test)进行多变量分析,多变量分析有统计学意义时再进行单因素分析,各指标两组比较采用t检验,双侧检验,P<0.05被认为差异有统计学意义。
2 结果
2.1 ROT损害大鼠认知功能
2.1.1 Y迷宫实验表明ROT损害大鼠认知功能为了验证ROT是否引起大鼠认知功能损伤,我们采用Y迷宫实验评估大鼠的认知功能。Y迷宫实验结果显示,与对照组相比,ROT处理组大鼠的正确交替率降低(P<0.05;图1A),两组大鼠的穿梭总次数差异无统计学意义(P>0.05;图1B),这些结果表明ROT损害大鼠认知功能。
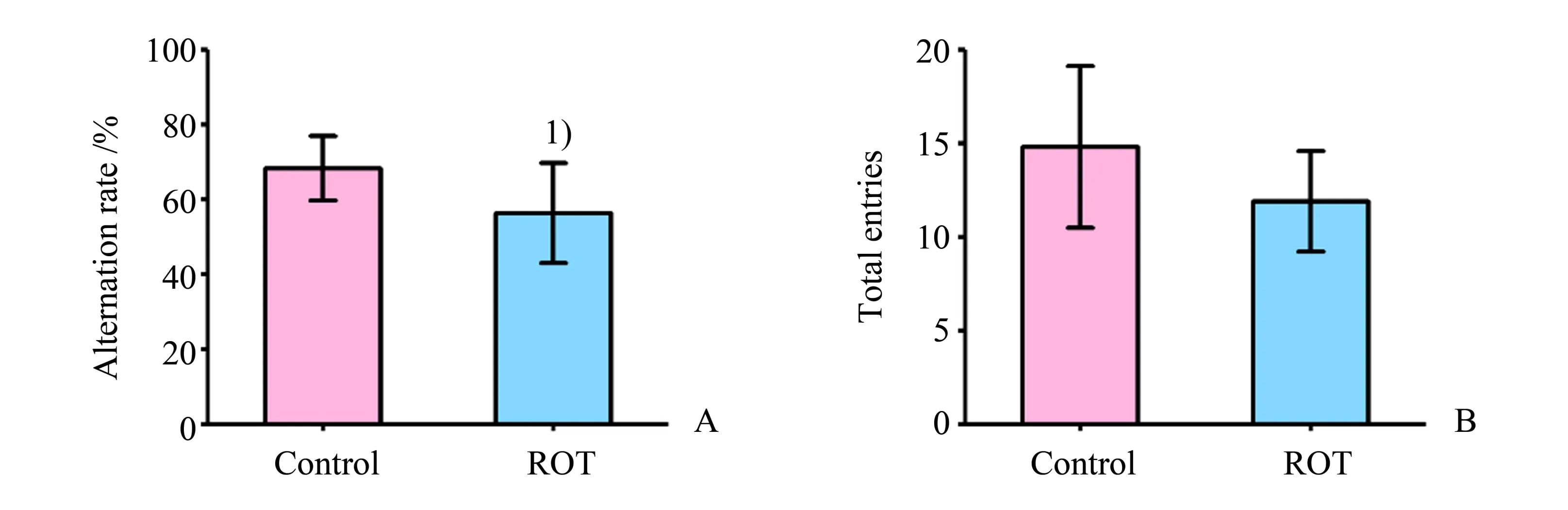
图1 Y迷宫检测ROT对大鼠认知功能的影响Fig.1 Effect of ROT on the cognitive function of rats detected by Y-maze test
2.1.2 新物体识别实验表明ROT损害大鼠认知功能 为了进一步证明ROT损害大鼠的认知功能,我们进行新物体识别实验检测大鼠的学习记忆能力。我们发现在训练期阶段,两组大鼠的总探索时间差异无统计学意义(P>0.05;图2A);在测试期阶段,与对照组相比,ROT处理组大鼠的识别指数降低(P<0.001;图1B),并且两组大鼠的总探索时间差异无统计学意义(P>0.05;图2C),进而排除了大鼠自身运动能力和情绪对实验结果的影响。这些结果表明ROT损害大鼠认知功能。
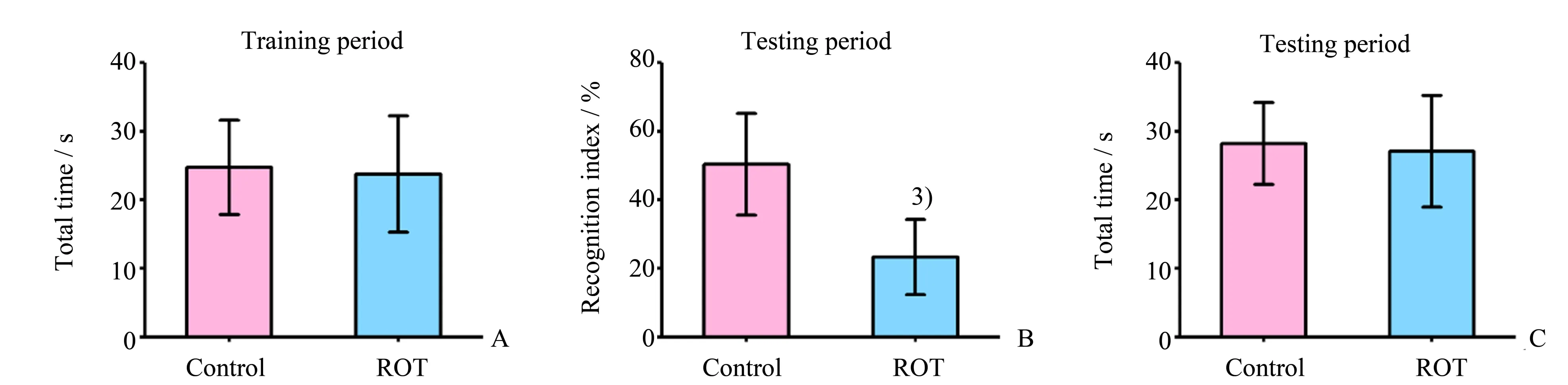
图2 新物体识别检测ROT对大鼠认知功能的影响Fig.2 Effect of ROT on the cognitive function of rats detected by NOR test
2.2 ROT抑制大鼠海马Warburg效应
我们进一步观察ROT对大鼠海马Warburg效应的影响,发现在ROT处理组的大鼠海马组织中,HK2(P<0.05;图3A)、PKM2(P<0.01;图3B)、PDK-1(P<0.05;图3C)和LDHA(P<0.05;图3E)蛋白的表达水平低于对照组,而PDH(P<0.05;图3D)蛋白的表达水平高于对照组。同时,与对照组相比,ROT处理组大鼠的海马组织中的乳酸含量降低(P<0.05;图3F)。这些结果表明ROT抑制大鼠海马Warburg效应。
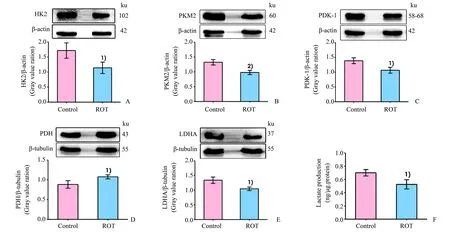
图3 ROT对大鼠海马组织Warburg效应相关蛋白和乳酸水平的影响Fig.3 Effect of ROT on the related proteins of Warburg effect and lactate level in the hippocampus of rat
2.3 ROT促进大鼠海马小胶质细胞向M1表型极化
我们进一步观察ROT对大鼠海马小胶质细胞极化的影响,发现在ROT处理组的大鼠海马组织中,M1型小胶质细胞标志性蛋白iNOS(P<0.05;图4A)的表达、NO(P<0.05;图4B)的含量和IL-1β(P<0.01;图4C)的分泌水平均高于对照组;M2型小胶质细胞标志性蛋白Arg-1(P<0.01;图4D)和Ym-1(P<0.01;图4E)的表达,IL-4(P<0.05;图4F)和TGF-β1(P<0.05;图4G)的分泌水平均低于对照组。这些结果提示ROT促进大鼠海马小胶质细胞向M1表型极化。
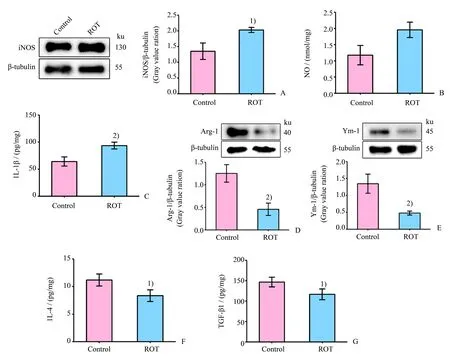
图4 ROT对大鼠海马组织小胶质细胞极化相关蛋白和炎症因子的影响Fig.4 Effect of ROT on the related proteins and inflammatory factors of microglia polarization in the hippocampus of rat
3 讨论
本研究使用ROT处理SD大鼠,并采用行为学实验评估大鼠的认知功能。ROT处理组的大鼠在Y迷宫实验中的正确交替率和在新物体识别实验中的识别指数均较对照组降低,表明ROT处理损害了大鼠的认知功能,这与以往的文献报道结果相一致[9-12]。在此基础上,本研究进一步探讨了ROT损害认知功能的潜在机制。
Warburg效应即有氧糖酵解,其参与突触形成并有助于大脑生长发育和学习记忆[5]。因此,我们进一步观察了ROT对大鼠海马Warburg效应的影响。我们的结果显示,在ROT处理的大鼠海马组织中,Warburg效应相关蛋白HK2、PKM2、PDK-1、LDHA蛋白的表达水平降低、PDH蛋白的表达增加,并且Warburg效应产物乳酸的含量降低,这些结果表明ROT抑制了海马Warburg效应。ROT是一种线粒体复合物-1的特异性抑制剂,损害细胞呼吸链进而抑制氧化磷酸化。一般情况下,氧化磷酸化的破坏会导致Warburg效应代偿增加[13]。然而冯等[14]发现ROT在损害肿瘤细胞氧化磷酸化的同时也抑制了糖酵解。在肿瘤细胞中,这种抑制作用似乎是通过抑制LDHA的表达引起的[14],在海马中我们同样观察到了LDHA的降低,这提示ROT可能抑制LDHA的表达进而抑制了海马Warburg效应。有研究指出,Warburg效应的损害导致了阿尔兹海默症认知功能障碍[15]。我们发现ROT在损害大鼠认知功能同时也抑制了大鼠海马Warburg效应,这提示海马Warburg效应的损害可能参与ROT诱导的认知功能障碍。
小胶质细胞是一种中枢神经系统的免疫细胞,不仅发挥重要的免疫功能[16],还参与突触修剪[17]和神经发生[18]等多种过程。生理情况下,小胶质细胞呈现静息表型;多种损伤因素可诱导小胶质细胞激活并极化为促炎表型(M1型)或抗炎表型(M2型)[19]。小胶质细胞M1型极化损害认知功能[8],而小胶质细胞M2型极化改善认知障碍[20-21]。因此,进一步观察ROT对大鼠海马小胶质细胞极化的影响,结果显示在ROT处理的大鼠海马组织中,M1型小胶质细胞标志物iNOS的表达增加而M2型小胶质细胞标志物Arg-1和Ym-1的表达降低。这些结果提示ROT促进小胶质细胞向M1型表型转化,这与之前的研究报道相符[22]。本研究发现ROT在损害大鼠认知功能的同时也促进了大鼠海马小胶质细胞向M1型极化,这提示小胶质细胞M1型极化可能参与ROT诱导的大鼠认知功能障碍。这一推测得到了最近一项研究的有力支持,在这项研究中,作者证实ROT诱导的PD小鼠认知功能障碍涉及小胶质细胞状态的改变[23]。M1型小胶质细胞分泌NO、IL-1β、TNF-α、IL-6等促炎因子以诱导神经炎症[19],M2型小胶质细胞释放IL-4、TGF-β、IL-10等抗炎因子以发挥保护作用[24]。在ROT处理的大鼠海马中检测到高水平的NO和IL-1β以及低水平的IL-4和TGF-β,这些结果提示了神经炎症的存在。神经炎症是导致包括PD在内的神经退行性疾病认知功能障碍的重要因素[25]。因此,小胶质细胞M1极化可能通过诱导神经炎症参与ROT引起的认知功能障碍。
总的来说,本研究工作发现ROT损害大鼠的认知功能、抑制大鼠海马Warburg效应、促进大鼠海马小胶质细胞M1型极化。基于大量的文献证实War⁃burg效应[4,26]和小胶质细胞极化[11-27]对学习记忆具有重要的调节作用,提示改善海马Warburg效应或者促进小胶质细胞向M2型极化可能是抑制ROT诱导的认知功能障碍的重要途径,这值得我们进一步研究。本研究为ROT诱导的认知功能障碍的机制及其防治研究提供了新的思路,但存在不足之处。首先,我们目前缺少小胶质细胞形态学的指标,这使得小胶质细胞极化较为抽象;其次,目前的检测时间点单一,难以证明ROT对认知功能的损害与海马Warburg效应的改变、和小胶质细胞M1极化是否呈正相关趋势。这些问题有待我们继续完善。

