钆对比剂顺磁性弛豫增强效能比较的体模研究
冯艳青,谢定祥,李周雷,孟悛非,朱洪章
(中山大学附属第一医院放射诊断科,广东广州 510080)
用于磁共振成像(magnetic resonance imaging,MRI)的钆对比剂(gadolinium-based contrast agents,GBCAs)可以明显提高大部分病变与正常组织之间的信号对比,在MRI检查中使用越来越广泛,对改善图像质量和诊断准确性有重要的作用[1]。目前临床上常用的GBCAs种类较多,从结构上主要分为线性及大环类GBCAs。无论线性还是大环类GBCAs产生增强对比的效果主要靠缩短组织或者溶液的纵向弛豫时间T1,并取决于GBCAs在组织或溶液内的浓度和弛豫率,拥有更高的弛豫率的GBCAs意味着在浓度相同时其具有更高的对比增强效能,或者在达到相同的增强效果时可以用较少的剂量[2]。然而,GBCAs的弛豫率与其所处的磁场强度和化学环境密切相关,在高场环境下不同的GBCAs本身的分子结构对其弛豫率的影响尚不明确,较少学者在相同实验条件下比较目前临床上常用的GBCAs的弛豫增强效率。为在现时主流的磁共振设备3.0 T高场强下进一步指导临床使用,本研究拟用体模实验方法定量测量5种常用的线性和大环类GBCAs在标准化的稀释比例和摩尔浓度下的T1WI信号强度值和T1值,并比较它们的顺磁性弛豫增强效能。这是我们系列研究的第一步工作,该系列研究的目的是通过研究各种GBCAs在体内外的顺磁性弛豫增强效能,为实际工作中为病人选择安全、经济、高效的GBCAs提供参考。
1 材料与方法
1.1 体模制作
收集在中山大学附属第一医院放射诊断科使用的5种GBCAs,包括2种线性GBCAs和3种大环类GBCAs。2种线性GBCAs的有效成分分别为钆塞酸二钠(Gadoxetic Acid Disodium Injection,Gd-EOB-DTPA,普美显,拜耳先灵)、钆喷酸葡胺(Gadopentetate Dimeglumine Injection,Gd-DTPA,钆喷酸注射液,康臣药业);3种大环类GBCAs的有效成分分别为钆布醇(Gadobutrol Injection,Gd-DO3A-butrol,加乐显,拜耳先灵)、钆特醇(Gadoter⁃idol Injection,Gd-HP-DO3A,普海思,博莱科信宜)及钆特酸葡胺(Gadoteric Acid Meglumine Salt Injec⁃tion,Gd-DOTA,钆特酸葡胺注射液,恒瑞药业)。按照Friedman等[3]和董帜等[4]的研究方法制作体模。据五种GBCAs药品说明书上提供的有效成分的分子量,计算得到各原液的摩尔浓度,将5种原液分别稀释成同样摩尔浓度的起始液,再用蒸馏水对每种GBCA的起始液进一步稀释成12种不同摩尔浓度的药液各10 mL,然后分别装在15 mL的硬塑料试管里,并灌装蒸馏水1管10 mL作为对比。每种GBCA的浓度系列连同起始液和蒸馏水管共14管,编号后将其放在泡沫试管架存放。每种GB⁃CA均采用统一的稀释比例及稀释液浓度,相邻的两支试管的稀释比为0.6,具体如表1所示。
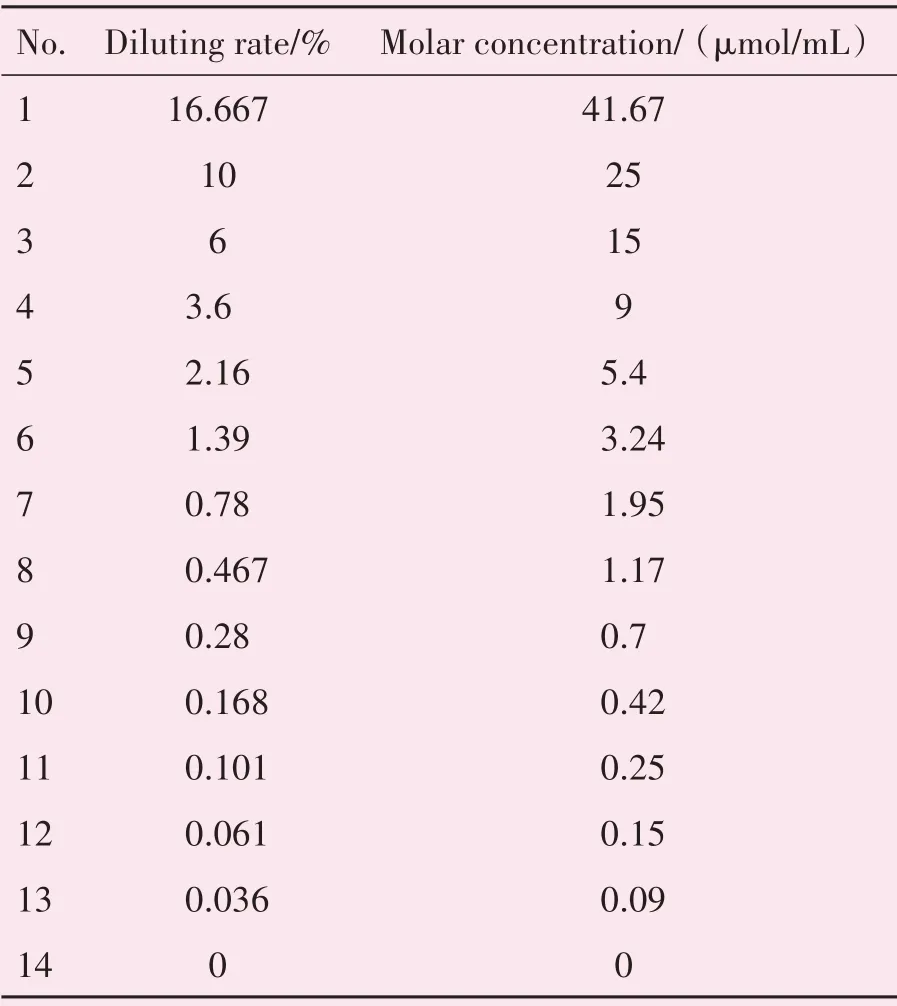
表1 体模稀释比例及浓度Table 1 Diluting rate and molar concentration of the phanton
1.2 MRI扫描方案
采用西门子3.0 T MRI(MAGNETOM Prisma,Siemens Healthcare,Erlangen,Germany)及配套的18通道相控阵腹部表面线圈进行扫描,扫描序列及参数如表2所示。本研究邀请一位健康志愿者参与MRI扫描,采用志愿者小腿的肌肉作为信号测量的参考物,实验经中山大学附属第一医院伦理委员会批准并让志愿者签署知情同意书。志愿者取左侧卧位,左下肢伸直,右下肢向前上方弯曲,将试管架平行放在左小腿旁,两者均位于扫描中线附近,并用相控阵腹部表面线圈覆盖其上,5种GB⁃CAs均采用相同参数在同一志愿者相同体位下分别扫描成像五次,每次使用一种GBCA的方法完成扫描。
1.3 图像及统计分析
MRI扫描结束后,将原始图像传输至配套的西门子图像后处理工作站(Siemens Leonardo Syngo Via VB20A HF9A)后,由一名有10年MR诊断经验的医师在工作站上进行数据测量。如图1所示,选取靠近试管液柱中段的冠状层面上连续三层画ROI(region of interest),分别测量14支试管、小腿肌肉和空气的数值,然后取各自三次测量数据的平均值。在T1WI_SE_Cor序列测量的数据包括体模溶液信号强度(Sp)、同一层面小腿肌肉信号强度(Sm);在T1_Mapping_VIBE_Cor序列生成T1-map⁃ping图上测量的数据包括体模溶液T1值(T1p)、同一层面小腿肌肉T1值(T1m)和背景噪声水平(T1n,体模四周空气噪声值的平均值)。画ROI时使其圆面积尽量接近试管的内腔截面面积,并复制相同的圆面积至其他试管内腔、小腿肌肉和四周空气。小腿肌肉ROI选择在信号较均匀的区域,并注意避免脂肪、血管、筋膜、骨骼的干扰。
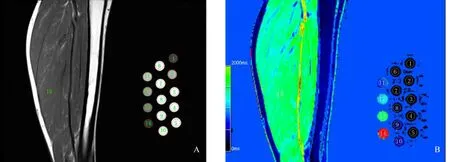
图1 T1WI信号强度和T1值的测量Fig.1 Measurement of T1WI signal intensity and T1 values
在T1WI SE序列上测得的数据用于计算相对信号强度(relative signal intensity,RSI),而T1Map⁃ping VIBE序列上测得的数据则用于计算T1弛豫速率(T1relaxation rate,R1)、计算信噪比(signal to noise ratio,SNR)和对比噪声比(contrast noise ra⁃tio,CNR)。计算算式分别如下:RSI=Sp/Sm;R1=1/T1p;SNR=T1p/T1n;CNR=|T1p-T1m|/T1n。
使用SPSS 22.0软件进行统计学分析。采用Spearman秩相关对5种GBCAs的Sp、RSI、T1p、R1、SNR、CNR与GBCAs摩尔浓度的相关性进行检验;分别对5种GBCAs的Sp、RSI、T1p、R1、SNR、CNR进行比较,先行正态性检验和方差齐性检验,符合正态分布和方差齐性的样本采用方差分析进行检验,不符合则采用Kruskal-WallisH检验;分别对线性和大环类GBCAs的Sp、RSI、T1p、R1、SNR、CNR进行比较,亦先行正态性检验和方差齐性检验,符合正态分布和方差齐性的样本采用t检验,不符合则采用Wilcoxon法进行检验。以α=0.05为检验水准,当P<0.05时则认为有统计学差异。
2 结果
2.1 GBCAs配置体膜时的使用剂量
体模制作过程中,5种GBCAs配备成相同摩尔浓度的稀释液,钆布醇原液使用容积最小(表3)。
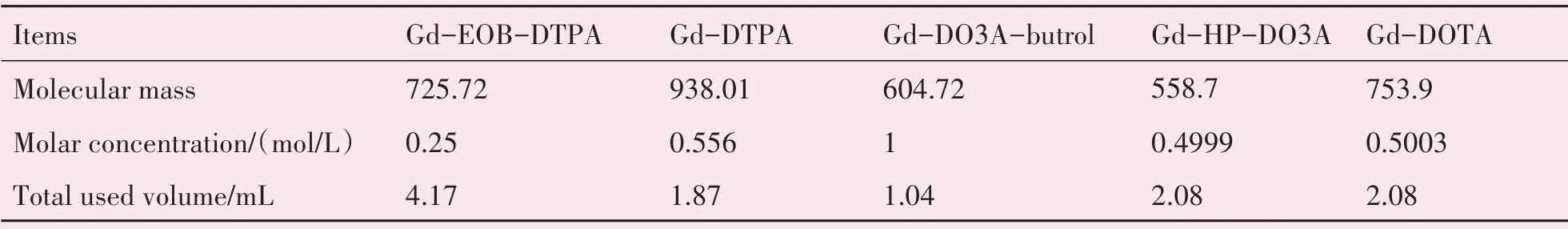
表3 5种体模的制备方法Table 3 The preparation of five phantoms
2.2 Sp、T1p、RSI、SNR、CNR与摩尔浓度的相关关系
将五种GBCAs的Sp、RSI、T1p、R1、SNR、CNR以摩尔浓度为横坐标分别作图,如图2所示,提示Sp、RSI与摩尔浓度均呈曲线相关(rs=0),而T1p、SNR与摩尔浓度呈负相关(rs<0),R1、CNR和摩尔浓度呈正相关(rs>0),进一步对后四者和摩尔浓度之间进行相关性分析,结果如表4。不同的GBCAs在本次实验中,均表现为随着摩尔浓度的增大,Sp和RSI呈增加趋势,随后在3.24~1.95μmol/mL的区间达到顶峰,随着摩尔浓度的进一步增大,则呈持续减少状态。T1p和SNR则随着摩尔浓度的增高呈逐渐降低,而R1、CNR则随着摩尔浓度的增高而逐渐增加。
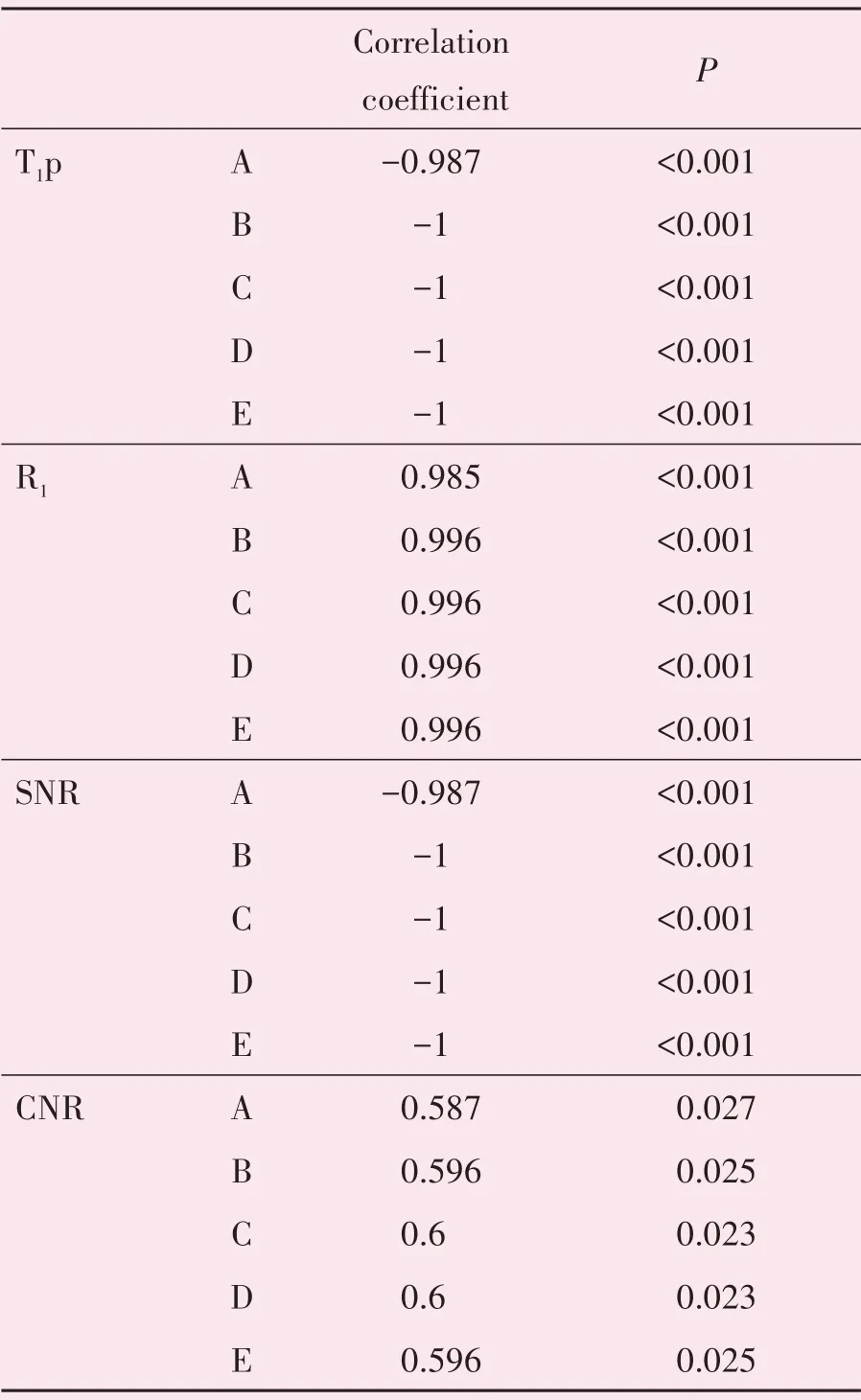
表4 Sp、RSI、T1p、R1、SNR、CNR与GBCAs摩尔浓度的相关关系Table 4 Correlation of Sp,RSI,T1p,R1,SNR,CNR and molar concentration of GBCAs(n=14)
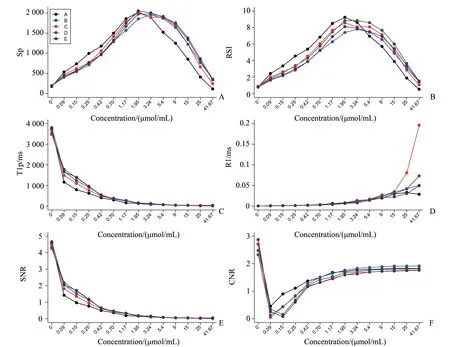
图2 Sp、RSI、T1p、R1、SNR、CNR与GBCAs摩尔浓度的曲线Fig.2 The cures of Sp,RSI,T1p,R1,SNR,CNR and molar concentration of GBCAs
2.3 五种GBCAs的Sp、RSI、T1p、R1、SNR、CNR的比较
经检验,SP和RSI符合正态分布和方差齐性,T1p、SNR、CNR不符合正态分布和方差齐性,分别采用方差分析和Kruskal-Wallis检验进行检验,结果如表5所示(Sp和RSI用均数±标准差表示,T1p、R1、SNR、CNR用中位数表示),提示了五种GBCAs的摩尔浓度相同时它们之间Sp、RSI、T1p、R1、SNR、CNR的差异无统计学意义。
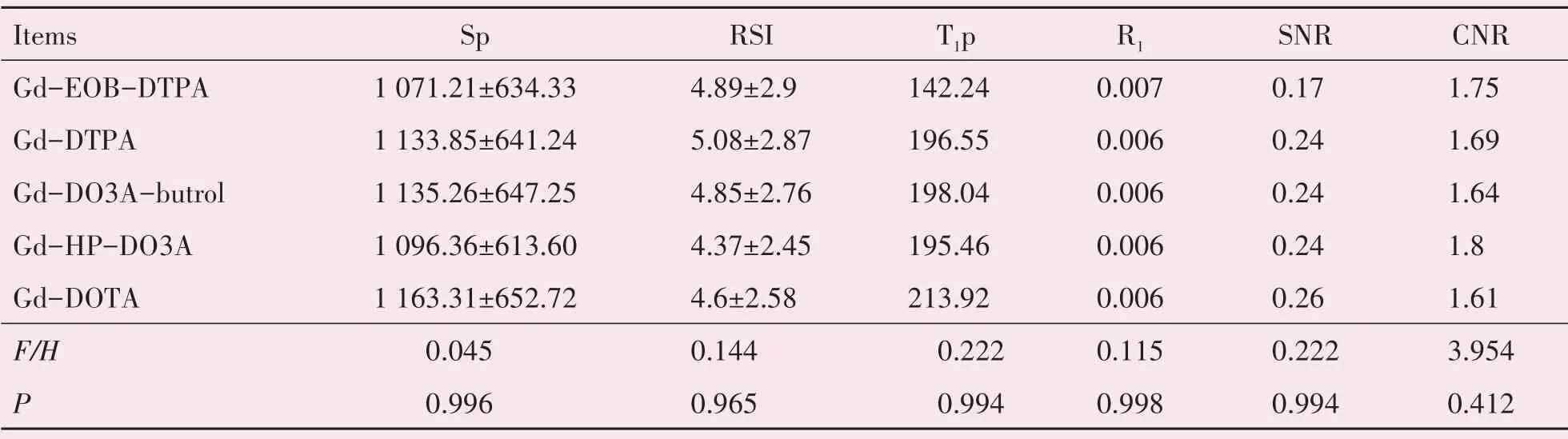
表5 不同的GBCAs的Sp、RSI、T1p、R1、SNR、CNR的比较Table 5 The comparison of Sp,RSI,T1p,R1,SNR and CNR in different gadolinium-based contrast agents
2.4 线性和大环类GBCAs的Sp、RSI、T1p、R1、SNR、CNR的比较
本研究中,所采用的Gd-EOB-DTPA是肝细胞特异性GBCA,其余均为非特异性GBCAs。分别2种线性和3种大环类GBCAs的Sp、RSI、T1p、R1、SNR、CNR进行两组定量资料的比较,其中Sp和RSI采用t检验进行统计,T1p、R1、SNR和CNR采用Wilcoxon秩和检验进行统计,结果分别如表6所示。
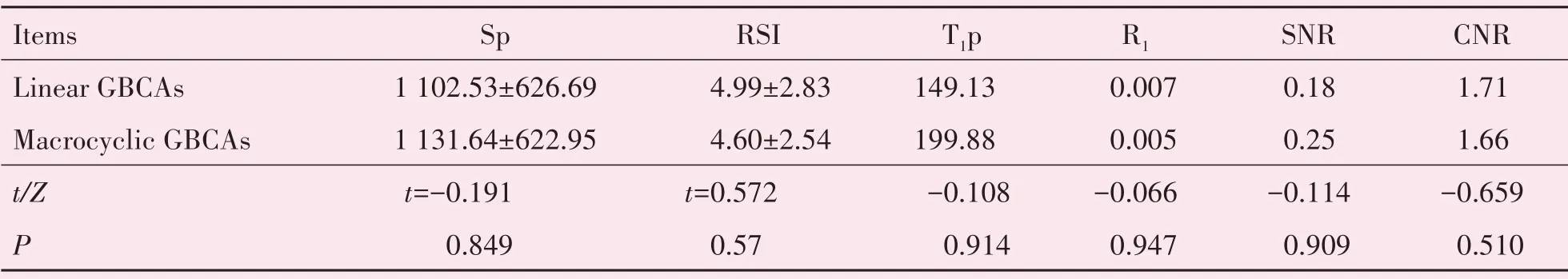
表6 线性和大环类GBCAs的Sp、RSI、T1p、R1、SNR、CNR的比较Table 6 The comparison of Sp,RSI,T1p,R1,SNR and CNR in linear and macrocyclic GBCAs
3 讨论
自从首个GBCA钆喷酸葡胺在1987年被批准用于MRI增强检查后,GBCAs以其优秀的弛豫增强效能使其在临床上得到迅速而广泛的应用。GB⁃CAs的弛豫增强效能不仅取决于它们的药代动力学特性,更取决于它们的磁性特性,即纵向和横向弛豫率(longitudinal and transverse relaxation rates,r1and r2)[5]。扫描前在靶区内引入GBCAs,顺磁性的GBCAs的存在会产生局部巨大的磁场波动,使电子的运动频率趋于Larmor频率,即形成所谓的质子偶极子-电子偶极子之间的偶极子-偶极子相互作用,引起所谓的质子弛豫增强,从而使明显缩短邻近质子的T1值和T2值[6]。GBCAs浓度较低时,由于水的T1值较长,因此,GBCAs对组织和溶液的T1缩短起主要作用,使其在T1WI图像上表现为信号增高,但如果GBCAs浓度升高至一定程度,由于T2*效应开始主导信号值,尤其当T2*远大于TE时,T2缩短更明显,便逐渐抵消了T1WI图像信号的增加。Szomolanyi等[7]将这种现象归因于高浓度的GBCAs使稀释液的T2弛豫时间缩短过快,使得溶剂的信号强度随着GBCAs浓度的增加而下降。此外,当GBCAs浓度降低时溶液的T1亦变长渐趋于水的T1,表现为较低的T1WI图像信号强度。因此,过高和过低的GBCAs浓度都将导致体模的T1WI信号强度下降。本研究的结果符合这一变化规律,表现为在5种GBCAs稀释液的T1WI-SE的图像中,它们的Sp与GBCAs浓度均呈曲线相关,表现为“两头低、中间高”,也即GBCAs稀释液的信号强度随钆浓度的升高而增强,但钆浓度超过一定值后信号强度又随浓度的增高而下降。
常规的T1WI-SE序列图像上测定的信号强度并不是真正的T1值[8],组织固有的T1值需要用特定的序列来测定,西门子MRI设备上的T1-map⁃ping-VIBE序列,其原理基于获取不同T1权重的多幅图像,并将图像的信号强度拟合到T1弛豫方程中,可以自动计算各个像素的T1值并能合成组织的T1图,使得研究者可在图像后处理工作站上直接测量T1值。在本研究中,由于不同浓度的GB⁃CAs的T1值跨度过大,因此笔者引入T1弛豫速率(T1relaxation rate,R1)这一经T1值换算而来的指标进行校正标准差以便统计分析[9],其定义为单位浓度Gd螯合物纵向弛豫时间的倒数变化,其计算算式为+r1×[CA],其中是组织固有的弛豫率,为对比剂存在时溶剂的弛豫速率,r1是对比剂自身的弛豫率,通常认为是常数,而[CA]为GBCAs的浓度。Robert等[10]的研究表明各种GBCAs在蒸馏水中的r1较小,他们认为是由于蒸馏水体模种缺乏供GBCAs结合的蛋白质所致。根据上述计算算式,当r1较小且浓度一致时,不同GB⁃CAs的T1值和R1较难以分出差别,这与本研究的结论一致。此外,本研究显示,在T1-mapping-VIBE的图像质量比较中,五种GBCAs稀释液的SNR和CNR亦差异无统计学意义,表明在相同浓度下线性和大环类GBCAs的T1图都有类似的图像质量。
本研究显示,在相同摩尔浓度下,线性和大环类GBCAs蒸馏水体模的Sp和T1值均并无差别,笔者考虑原因在于在相同摩尔浓度下,单位体积内的钆原子数相同,单纯从弛豫增强效能方面来比较无明显差异,这是符合Gd+弛豫的基本原理的。但在相同的场强中,GBCAs在血清和全血中的r1与蒸馏水体模中不同,应表现为不同的r1[5,7]。Rooney等[11]归因于纯水中氢质子的弛豫时间非常长,但在由于与大分子的相互作用、内源性顺磁性物质如铁蛋白的存在等因素作用下,组织的弛豫时间应明显缩短。因此,GBCAs在活体内的弛豫增强效率更为突出,表现出与蒸馏水体模实验结果有所不同。Liu等[12]使用了等摩尔剂量的钆布醇和钆喷酸葡胺在腹部一站式成像中的CE-MRA和CE-MRI进行定性和定量比较,表明了在腹部的增强MRI检查中钆布醇更优于钆喷酸葡胺。因此有必要对各种对比剂在体内条件下的弛豫效能做进一步的研究。
但是,临床上对GBCAs的应用与选择,除了考虑GBCAs的弛豫增强性能外,还会因特殊的检查需求而使用某些特异性GBCAs如肝细胞特异性GBCA,因其特殊的药代动力学特点,临床上其使用剂量可较其他全身性GBCAs较低。此外,GBCAs的安全性已日益受到临床专家的重视,也是临床决策重要的参考因素之一。GBCAs被批准应用于临床后的30多年以来,即使GBCAs被普遍认为是安全的,但其引起的不良反应及安全隐患也逐渐得到学界的重视,例如肾源性系统性纤维化(nephrogen⁃ic systemic fibrosis,NSF)[13]和脑部钆沉积现象[14],目前NSF和脑内钆沉积的产生机制尚未完全阐明,并且至今临床尚未无足够的直接证据证实脑部钆沉积会对患者造成伤害,但是学界普遍认为大环类GBCAs比线性GBCAs具有更高的生物安全性,可能的原因之一是线性GBCAs中的钆从配体分子游离的倾向远远大于大环状GBCAs[15]。Kanda等[16]发现在平扫的T1WI图像上,矢状核的高信号与线性GBCAs用药史密切相关,而大环类GBCAs则未显示出这种相关性。基于近期新观点和新证据的出现,欧洲药品管理局(European Medicines Agency,EMA)、美国食品和药物管理局(Food and Drug Administration,FDA)等机构相继出台了具有法律效力的GBCAs相关指导文件,中华医学会放射学分会磁共振学组及中华医学会放射学分会质量控制与安全工作委员会亦在2019年制定了《钆对比剂临床安全性应用中国专家建议》,上述指导文件和使用指南均认为大环状GBCAs相比,线性GBCAs会导致更多、持续时间更长的钆沉积,并提出限制线性GBCAs的使用,尤其对中重度肾功能不全、儿童患者,推荐使用大环类GBCAs[17-19]。大环类GBCAs和线性GBCAs在体内条件下的弛豫效能也有必要进行研究。
本研究的不足之处:本研究的体模制作仅采用蒸馏水进行调配,尚没有考虑血液中和组织液中的某些成份(如蛋白质)对钆弛豫率的影响。GBCAs在人体中药代动力学及与白蛋白螯合等反应机制非常复杂[20],今后需进一步在血清、全血、动物模型仍至人体上验证。
本研究表明不同的线性和大环类GBCAs在相同摩尔浓度和3.0 T场强下具有相似的T1WI信号强度和T1值变化。过高和过低的GBCAs摩尔浓度都将使体模的T1WI信号强度下降,不同的GBCAs蒸馏水体模的Sp和RSI的峰值约出现在摩尔浓度1.95~3.24μmol/mL间,但T1值会随摩尔浓度的增加而持续下降。

