癫痫患者血清高迁移率族蛋白1与TOLL样受体4的表达及影响因素
叶嘉颖,杨炼红
(中山大学孙逸仙纪念医院神经科,广东广州 510120)
目前,癫痫(epilepsy)的病因和病理生理机制尚不明确,越来越多的学者提出癫痫与免疫应答、炎症反应相关[1],近期有研究发现动物癫痫模型和体外模型中TOLL样受体4(Toll-like receptor 4,TLR4)与高迁移率族蛋白1(high-mobility group box 1,HMGB1)等免疫炎症标志物异常表达[2-4],但临床癫痫患者中是否存在类似的免疫学改变,少有报道。因此,本研究采用前瞻性观察性临床研究方法,检测癫痫患者血清中HMGB1与TLR4的水平并对其进行影响因素分析,探究HMGB1、TLR4在癫痫中的作用和意义,以及影响HMGB1、TLR4表达的因素,增加对癫痫及难治性癫痫(intractable epilepsy,IE)分子机制的了解。
1 材料与方法
1.1 一般资料
选取2016年9月-2017年9月期间于我院确诊的原发性癫痫患者74例作为实验组。依据实验组患者对AEDs治疗的反应性,将实验组分为药物难治组(19例)、药物有效组(31例)、分类不明组(24例)三个亚组。记录实验组患者年龄、性别、临床表现(起病年龄、发作类型、发作频率、末次发作时间、用药情况)、脑电图、头颅MRI等临床资料。选取同时期来我院体检的健康者43例作为对照组。2组在性别、年龄方面无明显差异,P>0.05,具有可比性。
1.2 实验组入排标准
实验组入组标准:①参考国际抗癫痫联盟(ILAE)及国际癫痫局(IBE)制定指南[5-6],结合临床表现、脑电图、头颅影像学检查、家族史诊断为原发性癫痫。②病史资料完整,已获家属知情同意,经过伦理委员会的批准。
实验组排除标准:①颅内肿瘤、颅脑感染、头颅外伤或手术后、缺血缺氧性脑病、神经系统发育异常、神经系统退行性疾病等神经系统疾病。②急慢性感染、肿瘤、风湿免疫性疾病等全身系统疾病;近1月内重大创伤或手术治疗。③过去6个月糖皮质激素、免疫抑制剂使用史。④病史资料不全,或无家属知情同意,或违反伦理学标准。
1.3 实验组亚组分组标准
药物难治组:参考ILAE对耐药性癫痫的定义[7],达到以下条件后1年内仍有大于1次以上的癫痫发作的患者:①至少经2种抗癫痫药物单药或联合治疗,且每种药物达有效治疗剂量后至少使用1年(具体用药情况详见表1)。②药物使用需达到有效治疗剂量:达到有效血药浓度或说明书最大可耐受剂量。③依据患者癫痫发作类型选用正确的抗癫痫药物。
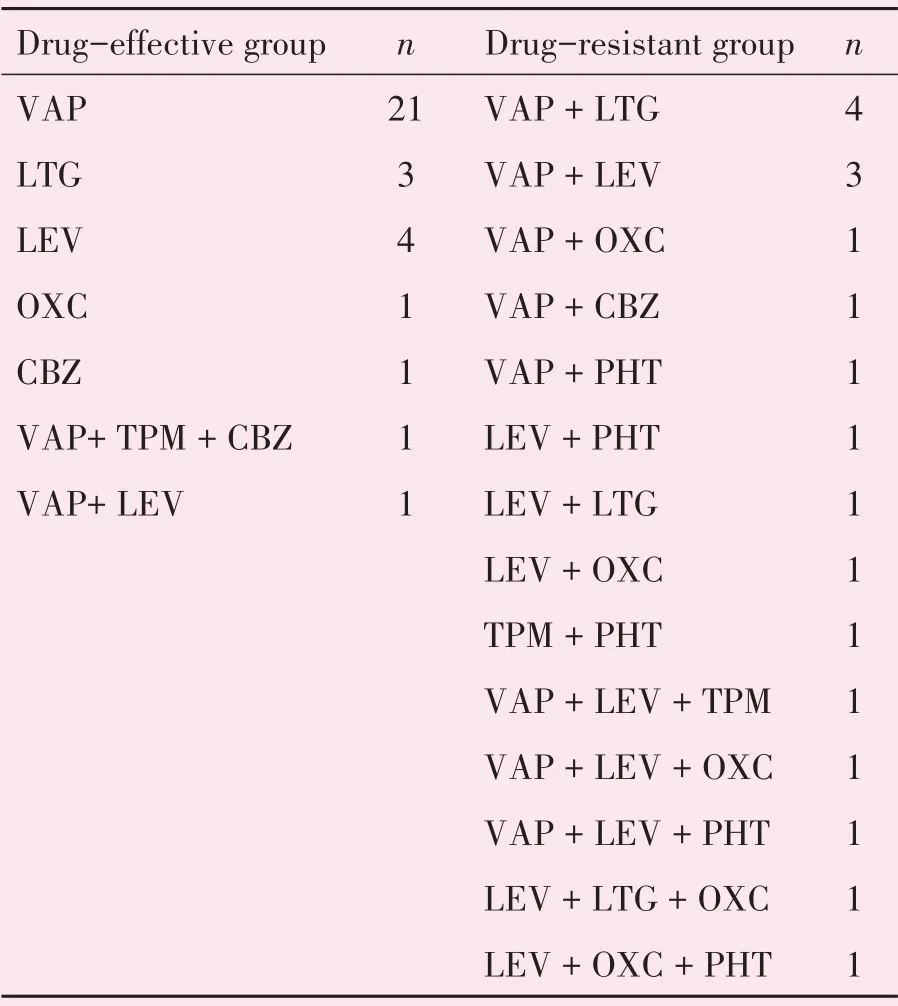
表1 药物有效组及药物难治组的用药情况Table 1 Medication of drug-resistant group and drug-effective group
药物有效组:使用抗癫痫药物治疗后至少1年内癫痫发作次数小于等于1次者。
分类不明组:对于不符合药物难治组纳入标准及药物有效组纳入标准的患者,归入分类不明组,其中主要包括:经抗癫痫药物治疗无发作但未满1年者;因抗癫痫治疗药物选用错误、用药未达有效治疗剂量等原因癫痫发作仍未控制者等。
1.4 血清高迁移率族蛋白1与TOLL样受体4的检测
实验组及对照组研究对象各抽取2 mL外周血,室温条件下静置30 min后,持续离心10 min,分离并留取血清,保存至-80℃冰箱内,用于血清HMGB1、TLR4的检测。
利用流式荧光检测技术检测血清中HMGB1水平。实验步骤:准备试剂、样品、标准品,样品用稀释液1:4稀释,微孔板上加入样本、质控品或标准品,依次加入微球液、检测抗体(Millipore品牌生产的抗HMGB1抗体试剂盒)、藻红蛋白标记的链霉亲和素,置入Luminex X-200仪器检测,记录数据,分析MFI结果,计算样品中HMGB1浓度。
采用酶联免疫吸附测定法(ELISA法)检测血清中TLR4水平。实验步骤:准备试剂、样品、标准品,样品用稀释液1:20稀释,96孔板上包被捕获抗体,加入样品或标准品,依次每孔加入酶标抗体(Biomatik品牌生产的TLR4配体试剂盒)、辣根过氧化物酶(HRP)、显色液,避光室温下静置20 min,每孔加入终止液终止反应,放入分光光度计(Ther⁃mo品牌的MULTISKAN FC型酶标仪),450 nm波长下检测,560 nm波长下校正,记录数据,绘制Logis⁃tic曲线,计算样品中TLR4浓度。
1.5 统计学方法
采用SPSS 25统计学软件对数据进行处理。计量资料以均数±标准差(Xˉ±s)表示。实验组、对照组TLR4、HMGB1水平的比较采用t检验;实验组亚组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;实验组、对照组TLR4与HMGB1的相关性分析采用pearson相关系数分析;TLR4、HMGB1的影响因素的研究采用相关性分析和多因素方差分析。本研究采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 实验组、对照组比较
实验组血清TLR4、HMGB1的水平高于对照组,tHMGB1=2.66,tTLR4=2.26,P<0.05,差异有统计学意义(表2)。
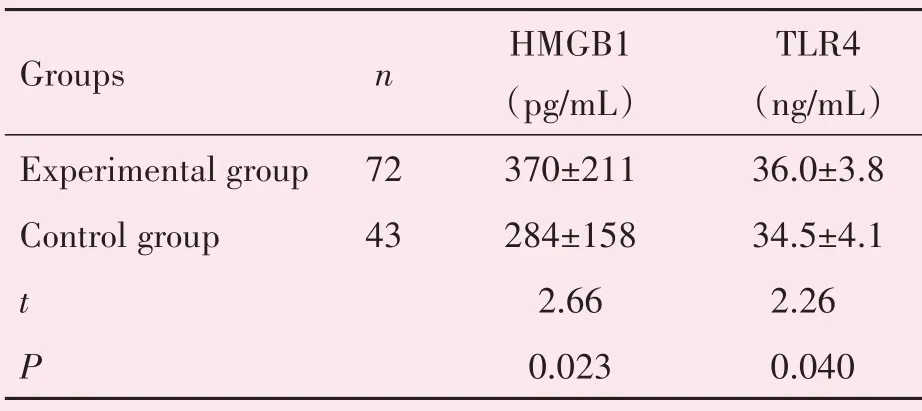
表2 实验组、对照组血清TLR4、HMGB1水平的比较Table 2 Comparison of the levels of serum TLR4 and HMGB1 between experimental group and control group
2.2 实验组亚组间比较
药物难治组、药物有效组、分类不明组三个实验组亚组间的血清TLR4、HMGB1水平有差异,FHMGB1=6.01,FTLR4=7.50,P<0.05,差异有统计学意义。亚组间两两比较发现,药物难治组血清TLR4、HMGB1水平高于药物有效组,PHMGB1=0.001<0.05,PTLR4=0.010<0.05,差异有统计学意义;药物难治组与分类不明组、药物有效组与分类不明组的组间差异无统计学意义(表3)。
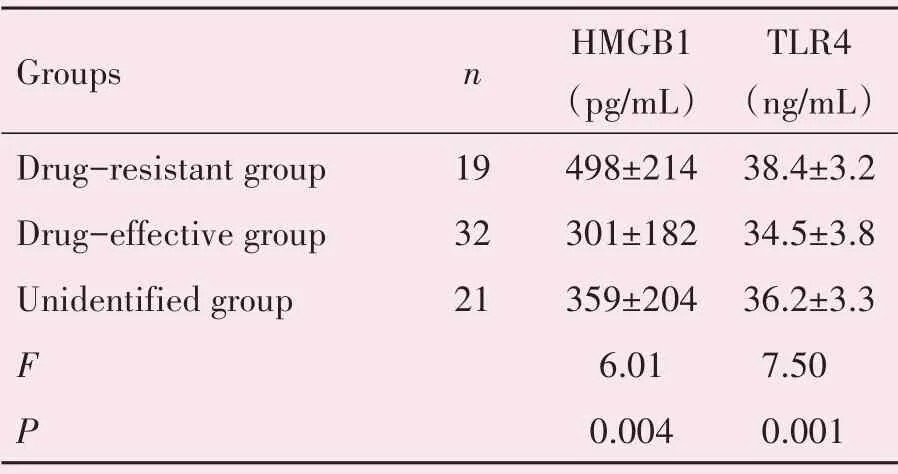
表3 实验组亚组间血清TLR4、HMGB1水平比较Table 3 Comparison of the levels of serum TLR4 and HMGB1 between experimental subgroups
2.3 高迁移率族蛋白1与TOLL样受体4之间的相关性分析
实验组血清TLR4与HMGB1水平呈正相关线性关系,决定系数R2=0.479,P<0.05(图1)。
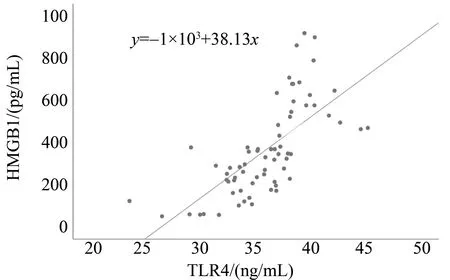
图1 实验组血清TLR4、HMGB1分布散点图Fig.1 Scatter map of the levels of serum TLR4 and HMGB1 of experimental group
2.4 高迁移率族蛋白1与TOLL样受体4的相关因素分析
2.4.1 临床因素的单因素方差分析 实验组血清TLR4、HMGB1水平与性别、年龄、起病年龄、癫痫发作类型、癫痫发作持续时间、脑电图表现等因素无关,与病程时长、癫痫发作频率、药物反应性相关。其中病程时长≥10年的癫痫患者的血清TLR4、HMGB1水平高于病程时长<10年的患者,FHMGB1=10.30,FTLR4=4.06,P<0.05,差异有统计学意义;癫痫发作频率≥2次/月的癫痫患者的血清TLR4、HMGB1水平高于发作频率<2次/月的患者,FHMGB1=7.65,FTLR4=10.18,P<0.05,差异有统计学意义;药物难治组血清TLR4、HMGB1水平高于药物有效组,P<0.05,差异有统计学意义(表4)。
表4 影响实验组血清TLR4、HMGB1水平的单因素方差分析Table 4 Univariate analysis of the levels of serum TLR4 and HMGB1 in experimental group ()
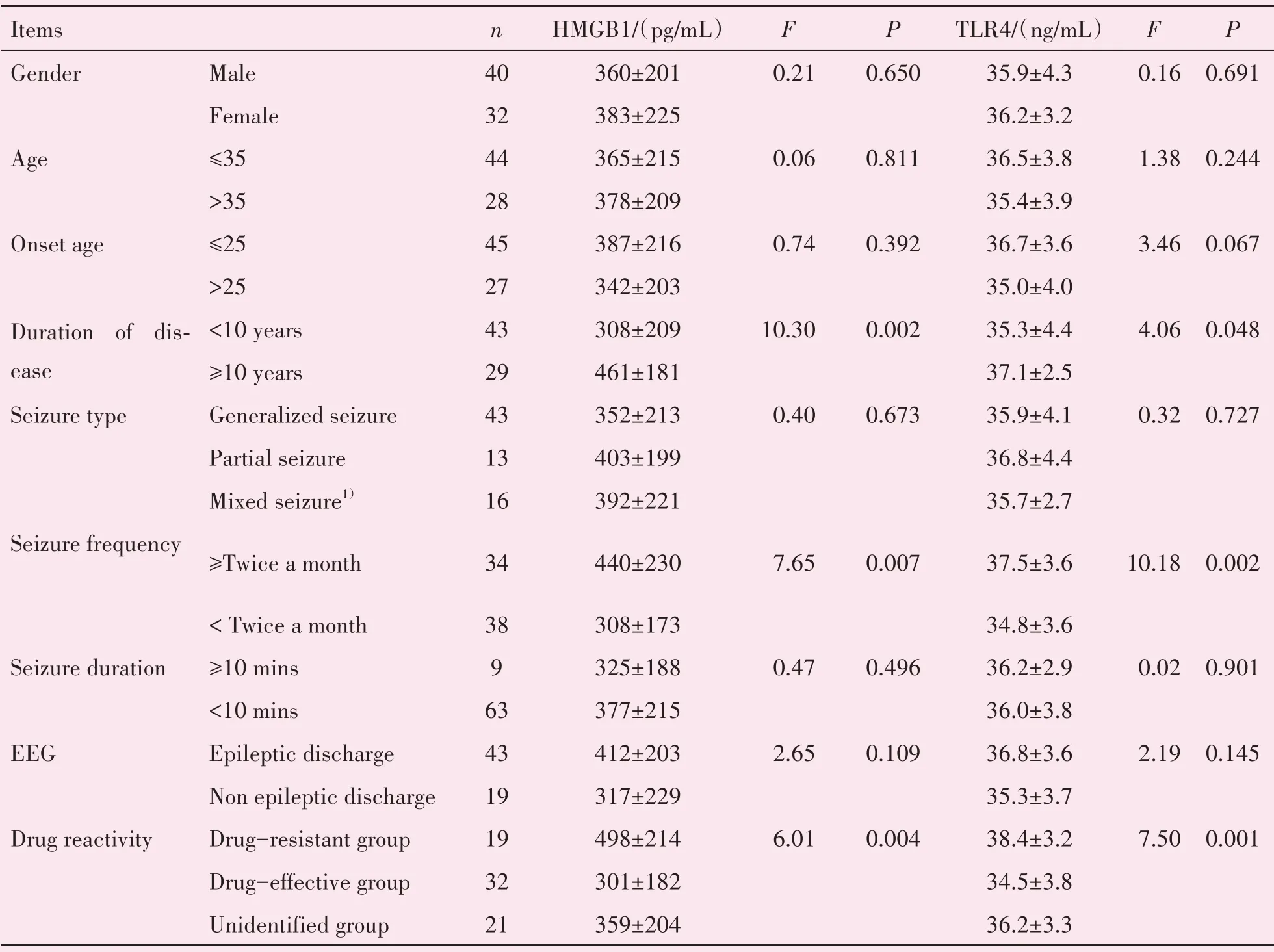
表4 影响实验组血清TLR4、HMGB1水平的单因素方差分析Table 4 Univariate analysis of the levels of serum TLR4 and HMGB1 in experimental group ()
1)Mixed seizure:secondarily generalized seizure or several seizure types in one person.
2.4.2 临床因素的多因素方差分析 在实验组血清HMGB1、TLR4水平与癫痫发作频率、病程时长、药物反应性三个因素的多因素方差分析中,癫痫发作频率、药物反应性与血清TLR4水平相关,FSeizurefrequency=4.68,FDrugreactivity=3.80,P<0.05,差异有统计学意义;癫痫发作频率、病程时长、药物反应性与血清HMGB1水平相关,FSeizurefrequency=6.71,FDurationofdisease=6.55,FDrugreactivity=3.96,P<0.05,差异有统计学意义(表5-6)。
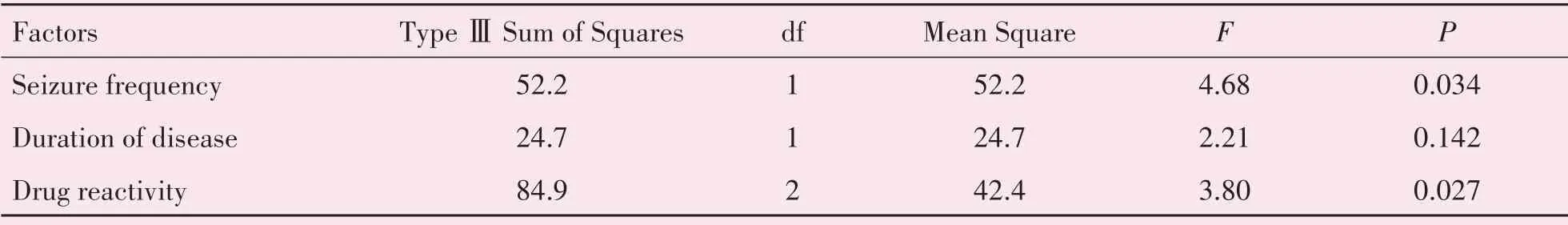
表5 影响实验组血清TLR4水平的多因素方差分析Table 5 Multivariate analysis of the levels of serum TLR4 in experimental group
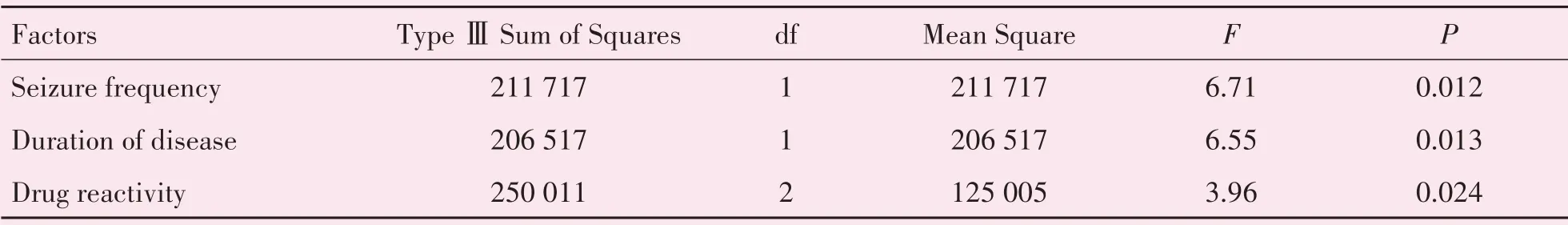
表6 影响实验组血清HMGB1水平的多因素方差分析Table 6 Multivariate analysis of the levels of serum HMGB1 in experimental group
3 讨论
TOLL样受体(Toll-like receptors,TLRs)是一类表达于免疫细胞及部分非免疫细胞膜上的天然免疫受体,TLR4是Toll样受体家族的其中一员,在神经系统中主要表达于小胶质细胞、星形胶质细胞等。HMGB1是TLR4的内源性配体之一,其在正常情况下,广泛存在于神经系统、心、肝、脾、肺、肾等组织细胞核中,参与DNA转录、翻译和修复。
动物癫痫模型中发现,HMGB1在癫痫发作时,从细胞核释放到细胞外,胞外游离的HMGB1经氧化成为具有活性的二硫键HMGB1,可特异性结合膜受体TLR4或晚期糖基化终产物受体(receptor for advanced glycation end-product,RAGE),启动炎症级联反应,促进癫痫发生发展[2]。癫痫患者血清中的HMGB1、TLR4水平显著高于非癫痫患者,提示HMGB1、TLR4在人体中同样与癫痫密切相关。
本研究对癫痫患者血清TLR4、HMGB1水平进行相关因素分析,在单因素分析中,我们发现癫痫患者血清TLR4、HMGB1水平与性别、年龄、起病年龄、癫痫发作类型、癫痫发作持续时间、脑电图表现等因素无关,与癫痫发作频率、病程时长、药物反应性相关,癫痫发作频率≥2次/月的患者血清TLR4与HMGB1水平显著高于发作频率<2次/月的患者,病程时长≥10年的患者血清TLR4与HMGB1水平显著高于病程时长<10年的患者,IE患者中的血清TLR4与HMGB1水平显著高于非IE患者。在多因素分析中,癫痫发作频率、药物反应性与血清TLR4、HMGB1水平均显著相关,但病程时长与血清HMGB1水平显著相关、与TLR4无相关性。
癫痫患者血清TLR4、HMGB1高于非癫痫患者,且癫痫发作频率≥2次/月的患者血清TLR4、HMGB1水平高于发作频率<2次/月的患者,提示癫痫发作频率与血清TLR4、HMGB1水平可能呈正相关关系。一方面,HMGB1、TLR4水平升高可诱导癫痫发作,Maroso等[8]发现,向小鼠癫痫模型的侧脑室注射HMBG1,可加速急性癫痫的发作、增加癫痫发作的数量和严重程度,而使用HMGB1、TLR4拮抗剂可抑制小鼠癫痫模型的癫痫发作。另一方面,癫痫发作本身可诱导HMGB1、TLR4水平的升高,有研究者发现使用海人酸(KA)诱导小鼠癫痫发作,1-3 h后海马区HMGB1、TLR4表达增多[8],运用免疫组化技术对HMGB1进行细胞内定位,可观察到癫痫发作后HMGB1从细胞核移位到细胞质、释放到细胞外的过程[9]。因此,HMGB1、TLR4水平升高可促进癫痫发作,而反复的癫痫发作又促使HMGB1、TLR4水平升高,HMGB1、TLR4水平升高与癫痫发作增加之间可能存在相互促进的关系,形成癫痫发展的恶性循环。
HMGB1、TLR4促癫痫作用的具体病理机制尚未完全明确,本研究中癫痫患者血清HMGB1、TLR4水平升高,且二者之间具有正相关线性关系,提示HMGB1、TLR4在促癫痫过程中可能具有协同作用。研究发现[8,10],向小鼠癫痫模型的侧脑室注射HMBG1可出现促癫痫作用,而向C3H/HeJ小鼠癫痫模型(T L R4基因变异失活的小鼠)注射HMGB1,未出现HMGB1的促癫痫作用。结合以上研究结果分析,癫痫患者中的HMGB1可能通过激活TLR4发挥促癫痫作用。HMGB1-TLR4通路激活、启动炎症级联反应后主要通过以下途径介导癫痫发生发展:①调节离子通道,改变神经元兴奋性,HMGB1-TLR4通路激活可促进N-甲基-d-天冬氨酸受体(NMDAR)的NR2B亚基的磷酸化,增强了NMDA诱导的神经元细胞Ca2+内流,提高神经细胞的兴奋毒性[11];②促进炎症因子的分泌,如白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)等,而IL-1β、TNF-α等已有研究证明其具有促癫痫作用[1];③调控相关基因的转录及蛋白的表达,比如HMGB1的增加可下调谷氨酸脱羧酶67(GAD67)和谷氨酸脱氢酶(GLUD1/2)的表达,增加细胞内谷氨酸浓度和主要组织相容性复合体Ⅱ(MHCⅡ)的水平,从而改变神经细胞兴奋性[9];上调脑内P-糖蛋白(P-glycoprotein,P-gp)的表达[12-13],增加对AEDs的抵抗性、参与IE的形成;④损伤血脑屏障(Blood Brain Barrier,BBB),受损的BBB无法拦截外周血中活化的淋巴细胞、抗体、炎症因子、白蛋白、免疫球蛋白等物质进入中枢,加重脑内炎症反应,促进癫痫发作[14-16]。
病程时长≥10年的癫痫患者的血清HMGB1水平高于病程时长<10年的患者,提示HMGB1水平可能与癫痫慢性病程相关。癫痫患者脑内持续存在的慢性炎症环境可能是癫痫的病理生理基础,HMGB1可能作为重要炎症介质促进癫痫慢性病理损伤,据研究,HMGB1与神经元程序性死亡、认知功能障碍相关,HMGB1可诱导大鼠海马CA1区神经元线粒体发生变构、并启动细胞凋亡,影响大鼠的学习能力、记忆能力[17-18]。本研究发现病程时长与血清HMGB1显著相关,但与TLR4水平不相关,这可能提示HMGB1并不完全依赖TLR4起促癫痫作用,HMGB1除激活TLR4启动炎症反应,也可激活RAGE/NF-κB通路[10,13,19],HMGB1-TLR4通路并非HMGB1发挥促癫痫作用的唯一途径。另外,研究纳入样本量不足、存在影响血清HMGB1、TLR4水平的未知且未控制的混杂因素,也同样可能导致以上实验结果的产生。
本研究发现IE患者血清HMGB1、TLR4水平显著高于非IE患者,提示HMGB1、TLR4可能增加癫痫患者对AEDs的抵抗性。HMGB1-TLR4通路可能通过调节脑内P-gp的表达参与IE的形成[12]:大鼠癫痫模型中的HMGB1及P-gp水平显著增加,而额外地注射HMGB1可使P-gp表达进一步上调,使用HMGB1拮抗剂预处理后P-gp的表达则取消了上调。依据IE发生机制的转运体假说,AEDs耐药性产生是因为大脑中的AEDs外排转运体异常过量表达,使AEDs在BBB渗透不足或过量外排,中枢神经系统AEDs有效血药浓度不足,癫痫发作难以控制。P-gp是大脑中一种常见的外排转运蛋白,P-gp表达增加被认为与IE密切相关[20]。
综上,HMGB1、TLR4作为免疫应答和炎症反应中的重要炎症标记物与癫痫密切相关,HMGB1、TLR4可能增加癫痫患者对AEDs的抵抗性;癫痫发作频率、病程时长可影响HMGB1的表达,癫痫发作频率可影响TLR4的表达。但本研究样本量较小,未检测IL-1β、TNF-α等下游炎症因子,未排除不同药物类型对HMGB1、TLR4的影响,HMGB1、TLR4在癫痫中的作用仍需要进一步的探究。

