miR-519d-3p通过调控TLR4/NF-κB通路促进脂多糖诱导的肺上皮细胞凋亡
周垂杨 柯乐斌 高仁贤
急性肺损伤(acute lung injury,ALI)是临床上常见的急危重症,由多种炎性细胞因子和免疫细胞共同参与,以弥漫性肺泡损害导致严重低氧血症为特征,ALI及其严重阶段急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是胸外伤、大面积烧伤和严重感染性疾病的主要致死原因[1, 2]。目前,临床上对ALI/ARDS的治疗以对症支持治疗为主,尚缺乏有效的治疗手段和特效药,患者病死率仍高达30%~50%[3]。因此,探讨ALI的发病机制,寻找一种新的治疗策略是极其重要和紧迫的。急性肺损伤的发病机制是复杂的,包括中性粒细胞的募集、炎性细胞因子的释放和上皮细胞的凋亡,这些因素导致了肺泡上皮屏障的破坏、肺水肿和气体交换的异常[4]。在 ALI 的各种致病因素当中,以内毒素(主要成分是脂多糖 LPS)最为常见。
研究表明microRNA在调控ALI发生、发展方面具有重要意义[5]。已有研究发现,miR-146a高表达可明显抑制 LPS 诱导的小鼠肺组织中诱导型一氧化氮合酶 (iNOS)、炎性细胞因子TNF-α、白介素-6(IL-6)和IL-1β释放[6]。microRNA-181b能够调节NF-κB介导的血管炎症,并且降低内毒血症性小鼠的肺损伤[7]。而miR-127则可下调FcγRI/CD64的表达,减少IgG IC诱导的小鼠过度肺部炎性反应[8]。靶向特异性的miRNA可作为一种新型的分子标志物,用于评估及监测ALI的发生、发展,对改善ALI患者肺部功能和预后具有重要意义。
本研究通过细胞实验研究了miR-519d-3p对脂多糖LPS诱导的肺上皮细胞A549细胞凋亡的影响及其具体作用机制,对探索新的ALI诊疗手段具有重要意义,一定程度上为ALI的分子治疗靶点提供了新的研究策略。
材料与方法
1.细胞培养及其分组:人肺上皮细胞A549购自美国模式培养物保藏所。A549培养在含胎牛血清的DMEM培养基中,并在37℃,5%CO2的细胞培养箱中培养。利用脂多糖LPS处理A549模拟急性肺损伤体外细胞模型[9]。LPS溶解在二甲基亚砜(浓度<0.1%)中。分别用0、100、1000、104ng/ml的LPS处理A549细胞24h,摸索LPS后续处理浓度。NF-κB抑制剂 Bay 11-7082预处理浓度为5μmol/L,预处理时长为1h,之后撤掉抑制剂进行后续处理。细胞分组按相应实验要求分为:对照组(不做任何处理)、LPS处理组、LPS+miR-519d-3p激动剂组、LPS+miR-519d-3p拮抗剂组、LPS+Bay 11-7082组、LPS+Bay 11-7082+miR-519d-3p激动剂组。
2.细胞转染:A549细胞于转染前一天接种于6孔板中,细胞培养箱内培养过夜后,用lipofectamineTM2000(美国Invitrogen公司)转染细胞。将miR-519d-3p拮抗剂或激动剂用opti-MEM(美国Gibco公司)稀释,lipofectamineTM2000在另外离心管中稀释后,两者混合室温静止20min,缓慢滴加至铺好细胞的培养板中继续培养。于4h换液后继续后续处理。
3.qRT-PCR检测miR-519d-3p水平:使用TRIzol试剂盒(美国Thermo Scientific公司)提取A549细胞总的miRNA。然后使用Taqman MicroRNA反转录试剂盒(美国Invitrogen公司)合成cDNA。运用7900HT快速实时PCR系统(美国Applied Biosystems公司)进行定量PCR检测。使用2-△△CT法测定相对miRNA水平。内参为U6。miR-519d-3p引物序列如下:正向引物5′-TGCGGCAAAGTGCCTCCCTTTAG-3′;反向引物5′-CCAGTGCAGGGTCCGAGGT-3′。
4.流式细胞仪检测细胞凋亡:使用 Annexin V-FITC/PI 染色试剂盒(美国BD Biosciences公司)检测A549细胞的凋亡率。不同分组的A549细胞经过相应的处理后,将细胞浓度调整为1×106个/毫升。使用结合缓冲液悬浮,10μl Annexin V-FITC和碘化丙啶(PI)添加到100μl细胞悬浮液中,室温遮光孵育15min。使用流式细胞仪(美国BD Biosciences公司)检测凋亡细胞。
5.Western blot法检测蛋白表达:使用RIPA裂解缓冲液(美国Thermo Scientific公司)裂解各处理组A549细胞。再使用BCA蛋白定量试剂盒(美国Thermo Scientific公司)测定了蛋白质的浓度。用10%的SDS-PAGE分离蛋白质,并转移到硝化纤维素膜(NC膜)上。然后,使用5%脱脂奶粉封闭NC膜。紧接着,一抗Bax(#33-6400)、caspase-3(#PA5-114687)、Bcl-2(#13-8800)、TLR4(#48-2300)、p-IκBα(#2859)、IκBα(#4814)、p-p65(#MA5-15160)和p65(#51-0500)过夜孵育。次日,二抗孵育。化学发光法检测蛋白条带。p-IκBα和IκBα抗体购自美国Cell Signaling Technology公司,其余抗体均购自美国Invitrogen公司。β-actin作为内参。
6.细胞免疫荧光检测 NF-κB p65蛋白细胞核移位:细胞按相应实验条件处理后,4%多聚甲醛室温固定A549细胞,然后0.2% Triton X-100打孔,3% BSA封闭1h。加入一抗 (抗NF-κB,1∶100稀释) 孵育2h。紧接着,二抗避光孵育1h。洗涤后加入DAPI染核,避光孵育30min。最后,使用荧光显微镜观察拍照。
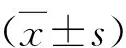
结 果
1.LPS上调A549的miR-519d-3p水平:LPS处理后的A549细胞内miR-519d-3p水平上调,并呈浓度依赖性(图1)。由于LPS浓度为104ng/ml时,miR-519d-3p水平与1000ng/ml比较,未显著上调,因此本研究选择LPS浓度为1000ng/ml,处理时间为24h构建急性肺损伤体外细胞模型。
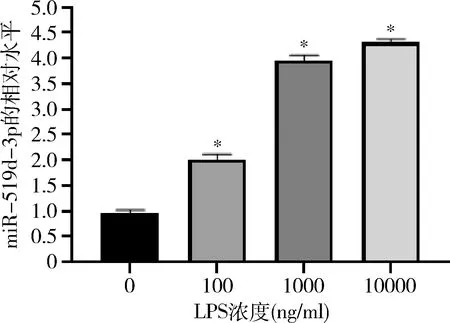
图1 LPS处理A549细胞内miR-519d-3p水平与0ng/ml比较,*P=0.000
2.miR-519d-3p促进A549细胞凋亡:转染miR-519d-3p激动剂,发现miR-519d-3p水平显著上升;转染miR-519d-3p拮抗剂,发现miR-519d-3p水平显著下调(图2A)。流式细胞仪检测细胞凋亡结果发现,LPS诱导细胞凋亡,过表达miR-519d-3p使得细胞凋亡进一步被促进;下调miR-519d-3p表达,细胞凋亡被一定程度抑制(图2B)。同时,Western blot法检测凋亡相关蛋白表达。LPS诱导后,Bax和cleaved caspase-3表达上调,Bcl-2表达下调;过表达miR-519d-3p使得Bax和cleaved caspase-3表达进一步上调,Bcl-2表达下调;下调miR-519d-3p表达,Bax和cleaved caspase-3表达下调,Bcl-2表达上调(图2C)。
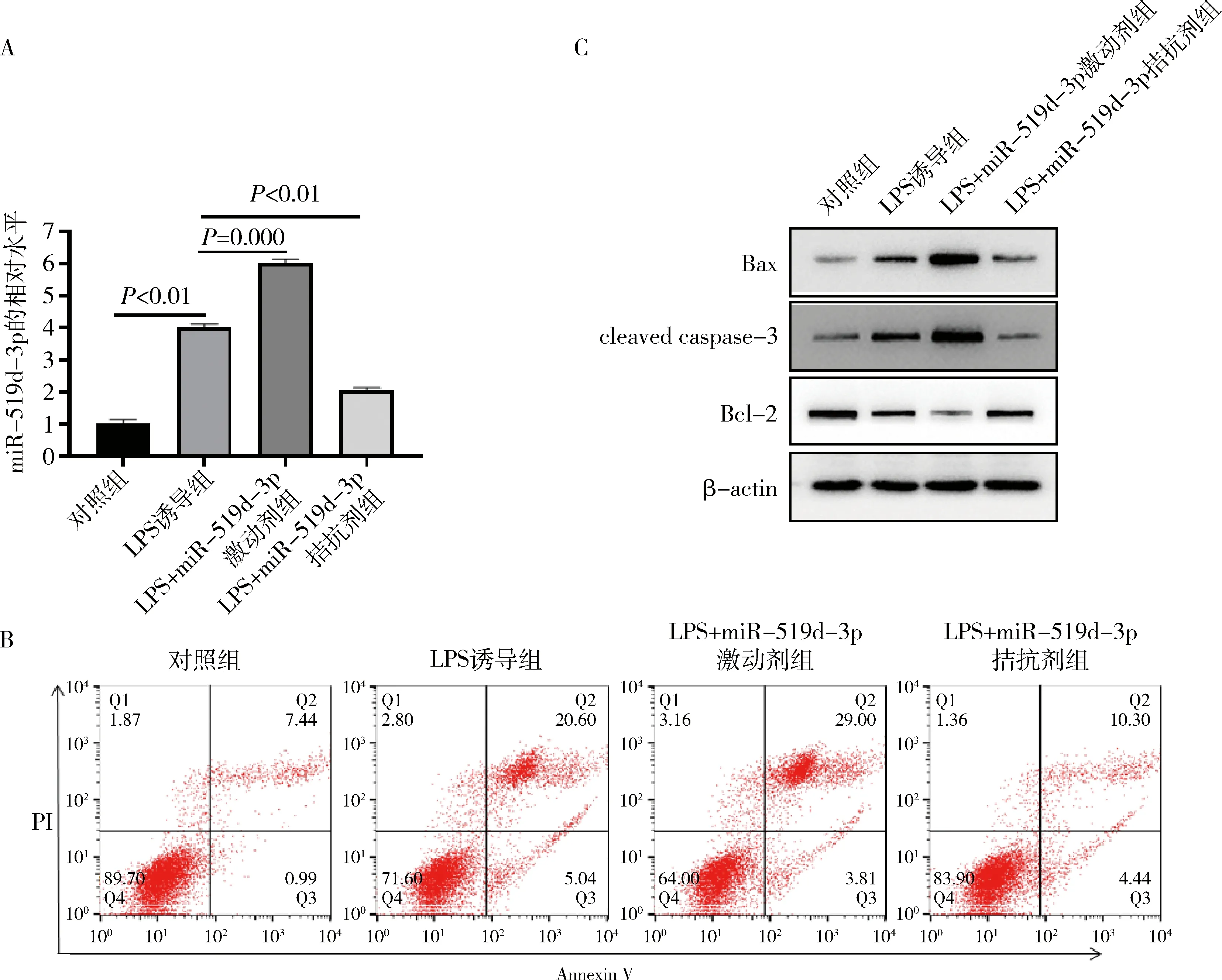
图2 miR-519d-3p对A549细胞凋亡的影响A.qRT-PCR检测miR-519d-3p水平;B.流式细胞仪检测细胞凋亡;C.Western blot法检测Bax、cleaved caspase-3和Bcl-2蛋白表达水平
3.miR-519d-3p影响TLR4/NF-κB通路:LPS处理使得TLR4、p-IκBα和p-p65蛋白水平显著上调。同时,上调miR-519d-3p水平,TLR4、p-IκBα和p-p65蛋白水平进一步上调;下调miR-519d-3p水平,TLR4、p-IκBα和p-p65蛋白水平随之下调(图3A)。利用细胞免疫荧光实验检测NF-κB蛋白细胞核移位,结果发现,上调miR-519d-3p水平能够明显诱导NF-κB蛋白的细胞核移位,使得细胞核内NF-κB蛋白水平显著上升;下调miR-519d-3p水平,细胞核内NF-κB蛋白水平下调(图3B)。
图3 miR-519d-3p对TLR4/NF-κB通路的影响(×200)A.Western blot法检测TLR4、p-IκBα、IκBα、p-p65、p65蛋白表达水平;B.细胞免疫荧光检测NF-κB蛋白细胞核移位
4.NF-κB抑制剂可缓解LPS导致的miR-519d-3p上调引起的A549细胞凋亡:NF-κB特异性抑制剂 Bay 11-7082处理后,miR-519d-3p水平(图4A)和TLR4蛋白表达没有显著的改变,但p-IκBα和p-p65表达显著下调(图4B),细胞凋亡水平显著下降(图4中C~D);然后转染miR-519d-3p激动剂后,miR-519d-3p水平和TLR4/NF-κB通路相关蛋白表达显著上调,细胞凋亡水平也随之升高。
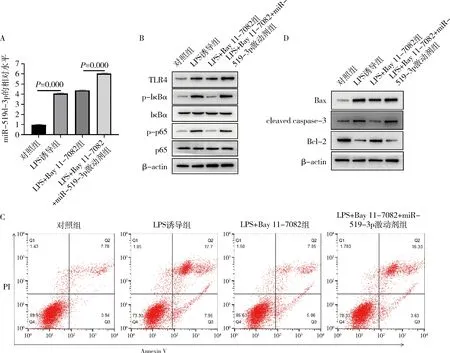
图4 NF-κB抑制剂Bay 11-7082对A549细胞凋亡的影响A.qRT-PCR检测miR-519d-3p水平;B.Western blot法检测TLR4/NF-κB通路相关蛋白表达水平;C.流式细胞仪检测细胞凋亡;D.Western blot法检测细胞凋亡相关蛋白表达水平
讨 论
ALI主要以肺部炎症和细胞凋亡为特征,是一种人类常见的临床疾病,在ALI的发展中,细胞凋亡被认为与ALI的严重程度密切相关[10]。肺泡Ⅱ型上皮细胞的凋亡已被证明是导致ALI中上皮屏障功能损伤和某些间充质细胞重塑的原因[11]。细胞凋亡途径的失控激活会导致炎症和肺组织的破坏,抑制细胞凋亡能够治疗ALI。同时,大量的研究已经明确了miRNAs在ALI 的发生和发展中的重要作用。Fu等[12]研究发现,下调miR-181a能够通过靶向Bcl-2减轻LPS诱导的小鼠急性肺损伤。Tang等[13]研究报道,miR-126-5p在LPS诱导的ALI小鼠中也起了类似的作用靠下调血管内皮生长因子A(VEGFA)。Wu等[14]研究发现,miR-326 靶向BCL2A1基因激活NF-κB信号通路,加重了ALI小鼠感染性休克的炎性反应和肺损伤。
脂多糖(LPS)是革兰阴性细菌细胞壁的主要生物活性成分,已被广泛用于诱导ALI模型[15]。本研究利用LPS处理人肺上皮细胞A549模拟ALI细胞模型。LPS能够上调A549细胞中的miR-519d-3p水平,并呈浓度依赖性。同时发现miR-519d-3p能够促进A549细胞的细胞凋亡。已有研究表明,miR-519d-3p 通过靶向HIF-2α能够促进缺氧条件下HeLa细胞凋亡,抑制增殖[16]。miR-519d-3p在喉部鳞状细胞癌中也有同样的作用[17]。但miR-519d-3p促进LPS诱导的A549细胞凋亡具体作用机制还需进行进一步的研究。
综上所述,本研究发现,LPS处理能够改变miR-519d-3p水平,进而影响TLR4/NF-κB通路相关蛋白表达。上调miR-519d-3p水平能够激活TLR4/NF-κB通路。有研究表明,TLR4/NF-κB通路与细胞凋亡相关[18]。miR-519d-3p水平上调能够促进TLR4蛋白表达。TLR4是LPS最主要的受体[19]。LPS与TLR4蛋白结合,启动信号转导,然后导致NF-κB激活,引起核内细胞凋亡相关基因广泛转录,诱导大量凋亡相关蛋白生成,诱导细胞凋亡发生[20]。本研究应用NF-κB特异性抑制剂 Bay 11-7082预处理A549细胞,发现细胞凋亡水平显著下降,再转染miR-519d-3p激动剂,LR4/NF-κB通路相关蛋白表达显著上调,细胞凋亡水平也随之升高。进一步验证了miR-519d-3p通过调控TLR4/NF-κB通路影响细胞凋亡。
综上所述,本研究探讨了miR-519d-3p/TLR4/NF-κB通路对LPS诱导的肺上皮细胞凋亡的调控机制,为miR-519d-3p/TLR4/NF-κB通路作为ALI药物靶点开发提供了理论基础,具有一定的转化价值。但miR-519d-3p对于TLR4蛋白表达的具体调控作用机制需在后续进行深入研究。

