CT-707对缺氧微环境下肝癌细胞能量代谢和细胞周期的影响及作用机制
姚红兵 吴嘉兴 郭 威 文雪霖 蒋建晖 刘翔峰
肝细胞癌(肝癌)是常见的恶性肿瘤,缺氧是恶性肿瘤微环境的主要特征之一,肝癌细胞在缺氧环境下可通过增强糖酵解代谢方式,维持细胞增殖的能量需求,从而促进肝癌进程[1,2]。糖原合成激酶(glycogen synthase kinase-3β, GSK-3β)介导的信号通路对细胞的增殖、分化及能量代谢具有重要作用,其活性受到Akt的调控。黏着斑激酶(focal adhesion kinase, FAK)是一种胞质非受体蛋白酪氨酸激酶,与肿瘤的多种生物学行为密切相关,磷酸化的FAK可通过结合PI3K/Akt促进癌细胞的增殖[3]。研究发现,FAK在肝癌组织中异常表达及活化,并与肝癌进展有显著相关性,可作为肝癌药物开发的新靶标[4]。多激酶抑制剂CT-707是一种新型FAK抑制剂,可通过抑制FAK的磷酸化发挥良好的抗肿瘤活性[5]。笔者前期研究已证实CT-707在肝癌动物模型中可抑制肝癌细胞的增殖以及肿瘤形成,促进癌细胞的凋亡[6]。故本研究结合肝癌细胞在缺氧微环境中的代谢特点,基于PI3K/Akt/GSK-3β信号通路,旨在进一步探讨新型FAK抑制剂CT-707的抗肝癌作用及机制。
材料与方法
1.试验材料:人肝癌HepG2细胞株购自中国科学院上海细胞库,使用含10%胎牛血清及1%双抗的改良Eagle培养基(DMEM)培养基,于5%CO2、37℃培养箱中常规培养。6周龄BALB/c裸鼠购自广西医科大学实验动物中心,在SPF级条件下饲养。CT-707购自美国MCE公司;DMEM、胎牛血清购自美国Gibco公司;cyclin D1、cyclin E、p-FAK、FAK、PI3K、Akt、p-GSK-3β、GSK-3β、PCNA、β-actin抗体购自英国Abcam公司;p-PI3K、p-Akt抗体购自美国CST公司;羊抗鼠二抗、羊抗兔二抗购自美国Sigma公司;HE染色试剂盒、己糖激酶(HK)试剂盒、BCA蛋白定量试剂盒购自北京Solarbio公司;乳酸脱氢酶(LDH)试剂盒购自南京建成生物;CCK-8试剂盒购自上海碧云天生物公司。
2.HepG2缺氧培养及分组:将HepG2细胞接种于6孔板中,每孔细胞数2×105,参照文献[5,7]按CT-707剂量范围(0~6μmol/L)分为control(对照)组以及处理组[CT-707高(6μmol/L)、中(3μmol/L)、低(1.5μmol/L)剂量组]。根据实验分组,处理组分别加入相应剂量的含药DMEM,对照组则加入无药DMEM,各组均于37℃缺氧培养箱(2%O2、5%CO2、93%N2)中培养48h。
3.CCK8:将对数生长期的HepG2接种于96孔板中,根据分组进行相应处理,并设置空白对照(空白组),培养48h后,每孔加入10μl CCK8工作液,37℃培养2h,酶标仪检测450nm波长处的吸光度(A)值,计算细胞存活率:细胞活性(%)=(A处理组-A空白组) /(A对照组-A空白组)×100%。
4.HK酶活性检测:收集各组细胞,培养基稀释为5×106/ml,加入1ml提取液,冰浴超声提取,重复操作多次使细胞充分破碎,8000×g4℃离心10min,取上清待测。取50μl待测液于EP管中,加入950μl工作液,混匀后快速移至微量石英比色皿中,紫外分光光度仪测定340nm波长下吸光度A1。将反应液置于37℃中水浴2min,立即测定吸光度A2。计算HK酶活[U/(gpro)]=(A2-A1)/毫摩尔消光系数/反应时间/比色光径×(反应液总体积/取样量)×1000。
5.LDH含量检测:胰酶消化收集各组HepG2,进行计数,离心弃上清,按5×106个细胞加入1ml提取液的比例加入提取液,冰浴超声波提取2min,8000×g4℃离心10min,根据LDH试剂盒试剂盒说明书配置标准品和样品,按步骤加入样本和基质缓冲液、辅酶Ⅰ,37℃反应15min,加入2,4-二硝基苯肼,漩涡混匀,37℃孵育15min,加入NaOH溶液室温放置3min,440nm波长,1cm光径比色,按标准曲线计算LDH含量。
6.Western blot法检测:各组HepG2用预冷的PBS洗涤2次,RIPA裂解液冰上裂解30min,低温离心取上清,行BCA蛋白定量。每孔蛋白上样量为20μg,SDS-PAGE电泳,湿法转膜。5%脱脂牛奶室温封闭1h,一抗4 ℃孵育过夜,TBST洗膜3次。二抗室温孵育1h,洗膜3次,用ECL检测液发光显影定影后,Image J分析灰度值。
7.裸鼠皮下成瘤及药物治疗:将对数生长期的HepG2胰酶消化收集,1000×g离心5min,取细胞沉淀重悬,制成细胞浓度为2.5×107/ml悬液。于无菌环境下,采用1ml注射器抽取0.2ml细胞悬液,在常规消毒的裸鼠腋部皮肤进行细胞悬液接种。根据实验动物3R原则,将接种HepG2细胞悬液的裸鼠随机分为4组,分为模型组和CT-707高(100mg/kg)、中(50mg/kg)、低(25mg/kg)剂量组,每组8只,CT-707按照剂量腹腔注射给药,每天两次,模型组则注射等量0.9%氯化钠溶液[7]。给药14天后处死动物,取肿瘤组织进行称重及体积测量。
8.HE染色:肿瘤组织于4%多聚甲醛中固定,行石蜡切片,根据HE试剂盒说明进行染色,封片,镜检,观察组织病理结构。
9.免疫组化:取各组肿瘤组织切片进行免疫组化染色。采用微波抗原修复后,滴加3% H2O2以去除内源性过氧化物酶活性,蒸馏水洗净。滴加封闭液室温孵育,一抗4℃过夜孵育。弃去一抗,PBS冲洗,滴加二抗,室温孵育20min,弃去二抗。滴加辣根酶标记链霉卵白素工作液,室温孵育20min,PBS洗净后滴加DAB显色。着色后浸入水中终止反应,自来水反复冲洗后,苏木精复染;梯度乙醇脱水,二甲苯透明,中性树胶封片,光镜下观察并拍照。Image J软件分析PCNA的阳性表达。

结 果
1.缺氧环境下CT-707对肝癌细胞活性、能量代谢及细胞周期的影响:与对照组比较,CT-707高、中、低剂量组HepG2细胞活性下降,HK活性及LDH含量显著下调,细胞周期蛋白cyclin D1、cyclin E显著下调(P<0.05),中、高剂量组的效应明显优于低剂量组(P<0.05),中、高剂量组间结果比较,差异无统计学意义(P<0.05,图1、图2)。

图1 各组细胞活性、HK活性及LDH含量检测结果A.细胞活性;B.HK活性;C.LDH含量。与对照组比较,*P<0.05;与CT-707(1.5μmol/L) 组比较,#P<0.05

图2 各组细胞中cyclin D1和cyclin E的蛋白表达与对照组比较,*P<0.05;与CT-707(1.5μmol/L) 组比较,#P<0.05
2.缺氧环境下CT-707对FAK/PI3K信号通路的影响:与对照组比较,CT-707高、中、低剂量组HepG2中FAK、PI3K、GSK-3β、p-FAK/FAK、p-PI3K/PI3K、p-Akt/Akt、p-GSK-3β/GSK-3β水平均明显下调,中、高剂量组的效应明显优于低剂量组(P<0.05),中、高剂量组间结果比较,差异无统计学意义(P>0.05),各组Akt蛋白表达比较,差异无统计学意义(P>0.05,图3)。
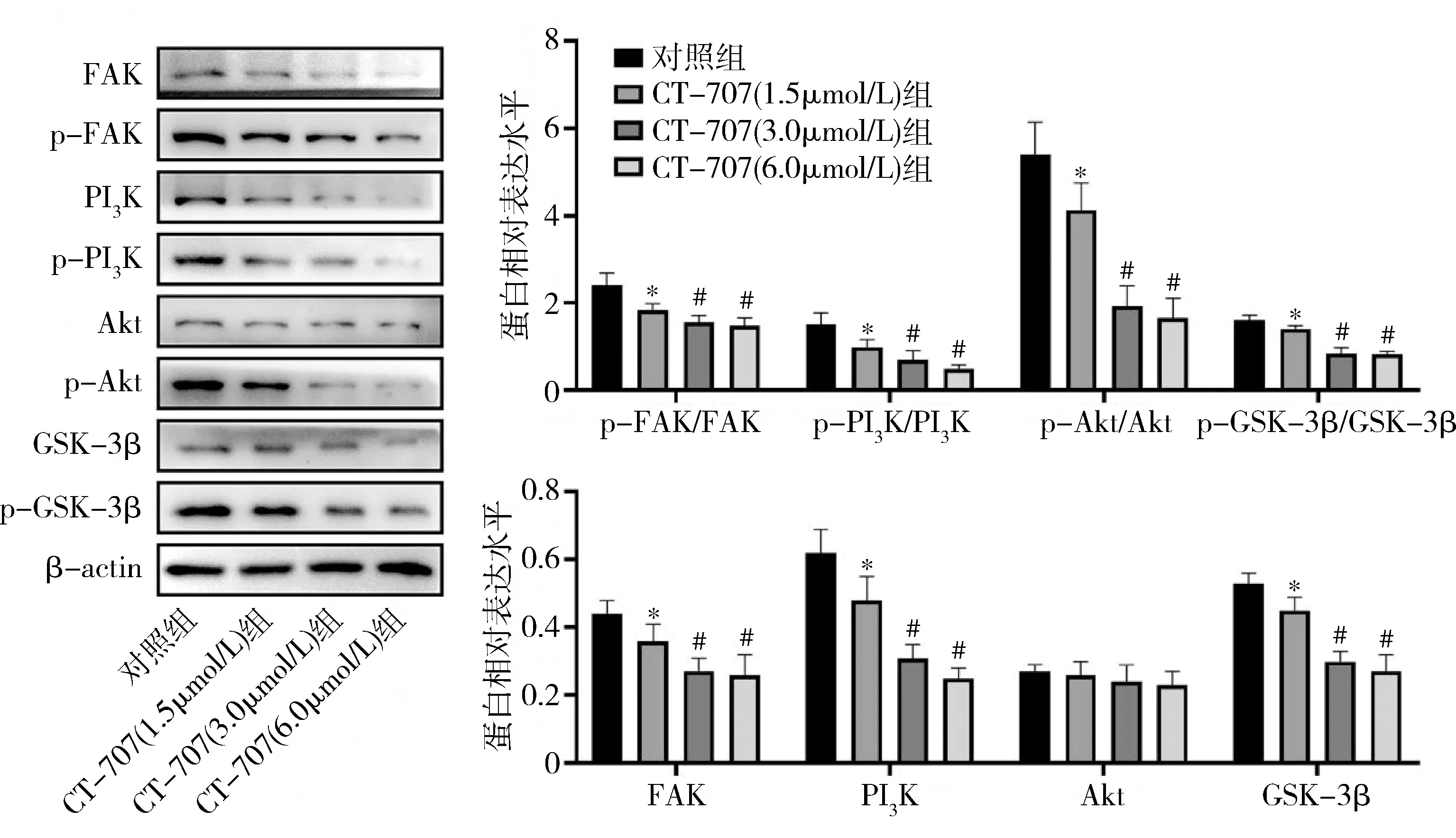
图3 FAK/PI3K信号通路关键因子的Western blot法检测结果
3.CT-707对HepG2裸鼠移植瘤的抑制作用:与模型组比较,CT-707高(100mg/kg)、中(50mg/kg)、低(25mg/kg)剂量组瘤质量、瘤体积明显下降(P<0.05),其中中、高剂量组的效应明显优于低剂量组(P<0.05),中、高剂量组间结果比较,差异无统计学意义(P>0.05,图4)。

图4 裸鼠移植瘤质量和体积A.移植瘤质量;B.移植瘤体积;与模型组比较, *P<0.05; 与CT-707(25 mg/kg) 组比较, #P<0.05
4.CT-707对HepG2裸鼠移植瘤细胞增殖及坏死的影响:采用HE染色检测HepG2裸鼠移植瘤细胞坏死情况。镜下观察模型组细胞核清晰可见,细胞排列整齐致密;CT-707高(100mg/kg)、中(50mg/kg)、低(25mg/kg)剂量组细胞排列松散,部分细胞核消失,出现坏死区域,且随着CT-707剂量增加,坏死区域增加,细胞核消失增加。采用免疫组化检测HepG2裸鼠移植瘤中PCNA的表达情况,结果表明,与模型组比较,CT-707高(100mg/kg)、中(50mg/kg)、低(25mg/kg)剂量组PCNA阳性细胞表达率均显著降低(P<0.05),中、高剂量组的效应明显优于低剂量组(P<0.05),中、高剂量组间结果比较,差异无统计学意义(P>0.05,图5、图6)。
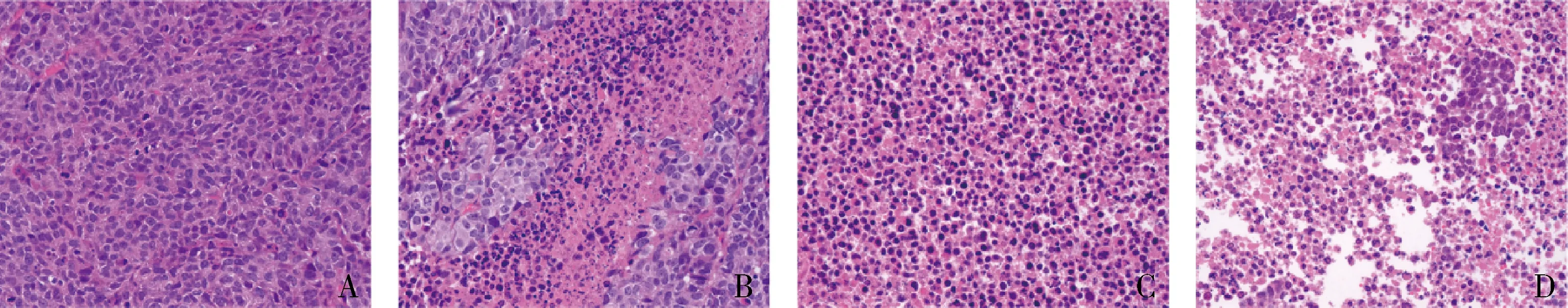
图5 各组移植瘤的HE染色比较(×400)A.模型组;B.CT707(25mg/kg)组;C.CT707(50mg/kg)组;D.CT707(100mg/kg)组

图6 各组移植瘤中PCNA的阳性表达比较(×400)与模型组比较, *P<0.05; 与CT-707(25mg/kg) 组比较, #P<0.05
讨 论
肝癌发病隐匿且病情进展迅速,患者确诊时大多已在进展期或晚期。肝癌细胞的快速增殖,是导致肝癌病情进展迅速的重要原因[8]。恶性肿瘤增殖过程伴随高速代谢,在快速生长的同时,氧耗剧增,且肿瘤内新生血管滞后引起血氧供应不足,从而造成肿瘤组织局部缺氧,此时癌细胞可通过增强糖酵解,并转而依赖糖酵解途径作为主要能量供给来源,适应缺氧微环境。肿瘤在缺氧微环境中的持续增殖,是多种蛋白作用的结果,其中缺氧可诱导FAK激活,FAK可通过PI3K/Akt等多条信号通路参与增殖和肿瘤的形成[9]。CT-707是一种新型多激酶抑制剂,可抑制FAK、ALK和Ply2蛋白的活性,研究表明,CT-707在缺氧环境下对HepG2具有更强的增殖抑制效果,但其作用机制尚未完全阐明[7]。因此,本研究通过建立HepG2缺氧模型及皮下成瘤动物模型,进一步观察CT-707对HepG2糖酵解途径及细胞周期的影响,探讨其抗肝癌细胞增殖的作用机制。
糖酵解代谢模式为癌细胞的增殖提供了物质基础,使得癌细胞在缺氧等环境中存活和增殖[10]。HK是糖酵解途径的关键酶,可将葡萄糖转化为6-磷酸葡萄糖,在缺氧条件下为癌细胞提供碳源,HK在包括肝癌在内的癌组织中大量表达,可促进癌细胞的增殖及糖酵解[11]。LDH是催化糖酵解的限速酶之一,可将丙酮酸转化为乳酸排至胞外。LDH在多种肿瘤组织中表达升高,其表达与肿瘤组织的大小显著相关,可作为肿瘤诊断的标志物[12]。此外,癌细胞通过调控细胞周期的时相分布从而实现快速增殖。细胞周期蛋白的表达和调控,是控制细胞周期转换,影响增殖的关键因素。
细胞周期蛋白cyclin D1、cyclin E可引起DNA复制,推动细胞周期由G1期进入S期,从而促进癌细胞的增殖[13]。本研究发现,CT-707在缺氧培养条件下抑制HepG2细胞增殖的同时,可降低HK和LDH的含量,抑制cyclin D1、cyclin E的表达,表明CT-707可阻断缺氧环境下肝癌细胞糖酵解代谢途径,并诱导细胞周期阻滞,具有显著的抗肝癌细胞增殖的效应。
cyclin D1、cyclin E及HK、LDH的表达受GSK-3β的调控[14, 15]。GSK-3β通过介导细胞内多种信号转导通路,磷酸化使底物蛋白失活发挥负性调节作用,是细胞内糖代谢、细胞增殖、分化及凋亡调控的关键因子[16]。研究发现,GSK-3β在肝癌组织中的表达水平低于正常肝组织及癌旁组织,其表达与组织病理学评分、肿瘤分级相关[17]。PI3K/Akt是GSK-3β上游信号通路,Akt可磷酸化GSK-3β Ser9位点,抑制GSK-3β的活性,促进糖酵解及细胞周期蛋白的表达,进而促进癌细胞的增殖[18]。抑制PI3K/Akt/GSK-3β信号通路是多种药物的抗肿瘤作用机制,而FAK可参与调控PI3K/Akt信号通路,因此推测FAK抑制剂CT-707可通过抑制PI3K/Akt/GSK-3β发挥抗肝癌作用。本研究发现CT-707可显著下调缺氧培养下HepG2中p-PI3K/PI3K、p-Akt/Akt和p-GSK-3β/ GSK-3β表达水平,且CT-707中、高浓度时作用更明显,表明CT-707抑制PI3K/Akt/GSK-3β信号通路可能是其抑制肝癌细胞增殖的关键机制。
为进一步研究CT-707对肝癌细胞增殖的影响及机制,本研究对皮下种植HepG2的裸鼠给予CT-707治疗,发现CT-707可显著减小移植瘤的体积和质量,破坏癌组织结构,表明CT-707具有显著的抗肝癌作用。PCNA是DNA复制的必须物质,与细胞中DNA合成及细胞周期密切相关。PCNA的表达从G1期开始升高,S期表达达到高峰,到G2期逐渐下降,是反映细胞增殖的主要生物学指标[19]。本研究发现,CT-707可显著下调PCNA阳性细胞比例,进一步从体内研究证实CT-707可引起肝癌细胞周期阻滞,抑制细胞增殖活性,从而发挥抗肝癌作用。
综上所述,本研究发现FAK抑制剂CT-707在缺氧环境下可通过抑制PI3K/Akt/GSK-3β信号通路,阻断肝癌细胞糖酵解代谢途径,并诱导细胞周期阻滞,抑制肝癌细胞增殖及肿瘤生长,表明CT-707作为一种FAK靶向抑制剂具有良好的抑癌作用,可能是潜在的肿瘤靶向药物,值得深入研究。

