miR-3614-5p在卵巢癌细胞中的表达及对卵巢癌细胞增殖和迁移的影响
巫梦雪 杜薇娜 王 曼 熊国平
卵巢癌是最常见的女性癌症类型之一,治疗手段主要包括手术治疗、放疗、免疫治疗、化疗[1]。尽管近年来卵巢癌的诊断和治疗得到了较大的发展,由于其淋巴结转移率很高,多数患者疗效不佳,5年生存率很低[2]。筛选合适的分子标志物和治疗靶点是监测和干预卵巢癌发生、进展的关键。微小RNA(miRNA)由18~25个核苷酸构成的内源性小分子RNA,在基因的转录过程发挥重要调控作用[3,4]。多项研究显示,恶性肿瘤组织和细胞中均存在miRNA差异表达,miRNA通过抑制抑癌基因或癌基因的翻译过程,影响肿瘤细胞的凋亡、迁移、耐药性、增殖等生物学行为[5,6]。miR-3614-5p属于miR-3614家族,是定性明确的抑癌基因[7,8]。Li等[7]研究发现,非小细胞肺癌组织中miR-3614-5p的表达水平降低,miR-3614-5p能够抑制非小细胞肺癌细胞的增殖和转移。目前,有关miR-3614-5p在卵巢癌中的研究很少。本研究旨在探讨miR-3614-5p在卵巢癌细胞系中的表达,观察miR-3614-5p对卵巢癌细胞增殖和迁移能力的影响,明确miR-3614-5p参与卵巢癌发生、发展的机制。
材料与方法
1.细胞与试剂:人卵巢癌细胞系(SKOV-3、OVCAR-3、A2780、HO-8910、OC3)和人正常卵巢上皮细胞IOSE80购自美国标准培养物保藏中心(American Type Culture Collection,ATCC)。miR-3614-5p模拟物、miR-NC模拟物、双荧光素酶报告基因载体psiCHECK2(GNAI2-m、GNAI2-w)、PCR引物购自上海吉玛生物制药有限公司。一抗GNAI2、β-tubulin、p-AKT、RHEB、p-mTOR和辣根过氧化物酶标记的二抗均购自美国CST公司。CCK-8试剂盒购自美国Sigma公司。RPMI 1640培养基、DMEM/F12培养基、胎牛血清和BCA蛋白浓度检测试剂盒购自美国Amresco公司。实时荧光定量聚合酶链式反应(qRT-PCR)相关试剂盒购自日本TaKaRa公司。Transwell小室购自美国Corning公司。Lipofectamine 2000购自美国Invitrogen公司。
2.细胞培养和细胞转染:SKOV-3、A2780、HO-8910和IOSE80细胞置于含10%胎牛血清的DMEM/F12培养基中,OVCAR-3、OC3细胞置于含10%胎牛血清的RPMI 1640培养基中,在体积分数5%CO2、37℃孵箱中培养。取对数生长期的OVCAR-3细胞,严格按照Lipofectamine 2000转染试剂盒说明书进行转染,分别将miR-3614-5p模拟物(miR-3614-5p组)、miR-NC模拟物(对照组)转染至OVCAR-3细胞,培养48h后,收集细胞采用qRT-PCR检测转染效率。
3.qRT-PCR检测miR-3614-5p和GNAI2信使RNA(mRNA)相对表达量:TRIzol法提取收集卵巢癌细胞系和正常卵巢上皮细胞总RNA,每个样本选择2μg总RNA进行反转录,以U6作为对照,qRT-PCR检测miR-3614-5p相对表达量;以GAPDH作为对照,qRT-PCR检测GNAI2 mRNA相对表达量。qRT-PCR引物序列如下,U6上游引物为5′- CTCGCTTCGGCAGCACA-3′,下游引物为5′-AACGCTTCACGAATTTGCGT-3′。miR-3614-5p上游引物为5′- AACAAGCCACTTGGATCTGAAGG -3′,下游引物为5′- CAGTGCAGGGTCCGAGGT -3′;GNAI2上游引物为5′- TACCGGGCGGTTGTCTACA-3′,下游引物为5′- GGGTCGGCAAAGTCGATCTG-3′;GAPDH上游引物为 5′- ACAACTTTGGTATCGTGGAAGG-3′,下游引物为5′- GCCATCACGCCACAGTTTC-3′。采用2-ΔΔCt方法计算miR-3614-5p和GNAI2 mRNA相对表达量。
4.生物信息学预测结合双荧光素酶报告基因法验证miR-3614-5p的靶基因:利用miRecords和DIANA-microT在线预测软件预测miR-3614-5p可能的靶基因。将对数生长期的OVCAR-3细胞接种于24孔板,通过Lipofectamine 2000分别将GNAI2-m和miR-NC、GNAI2-w和miR-NC、GNAI2-m和miR-3614-5p、GNAI2-w和miR-3614-5p瞬时转染OVCAR-3细胞,转染48h。根据双荧光素酶报告基因检测试剂盒操作,通过多功能酶标仪读取各组的荧光值,计算各组的相对荧光素酶活性。
5.Western blot法检测GNAI2蛋白和和AKT/mTOR信号通路蛋白表达变化:取各组转染48h的OVCAR-3细胞,提取总蛋白并测定蛋白浓度。每组上样35μg蛋白于SDS-PAGE凝胶进行电泳分离,采用半湿法将蛋白转到聚偏氟乙烯膜,在2%脱脂牛奶中室温封闭4h。稀释一抗GNAI2(1∶3000稀释)、β-tubulin(1∶3000稀释)、p-AKT(1∶2000稀释)、RHEB(1∶2000)及p-mTOR(1∶2000),添加一抗并在4℃孵育15h。稀释辣根过氧化物酶标记的二抗(1∶5000),添加二抗并在室温孵育1.5h。配制化学发光试剂,在化学发光成像系统中曝光、采集图像。
6.CCK-8检测OVCAR-3细胞增殖能力:取各组转染48h的OVCAR-3细胞,以每孔2×103个细胞(150μl)接种到96孔板,每组5个复孔。加入15微升/孔CCK-8溶液,培养箱内孵育3h,通过多功能酶标仪读取每孔在450nm波长处的吸光度(A)值。按照CCK-8试剂盒说明书连续5天进行检测,绘制OVCAR-3细胞生长曲线。
7.Transwell迁移实验检测OVCAR-3细胞迁移能力:取各组转染48h的OVCAR-3细胞,取4×105个/毫升的OVCAR-3细胞以150μl接种于Transwell小室上室,在下室添加含10%胎牛血清的培养基750μl,培养箱内孵育24h。采用棉棒擦去上室上表面的细胞,使用甲醇溶液固定20min,使用0.1%的结晶紫溶液染色15min,于倒置显微镜下计数4个单独视野下的染色细胞数,其均值代表OVCAR-3细胞的迁移能力。

结 果
1.miR-3074-5p表达水平与卵巢癌患者生存期的关系:与miR-3074-5p表达较低的卵巢癌患者比较,miR-3074-5p表达较高的患者生存期较长(P<0.05,图1)。
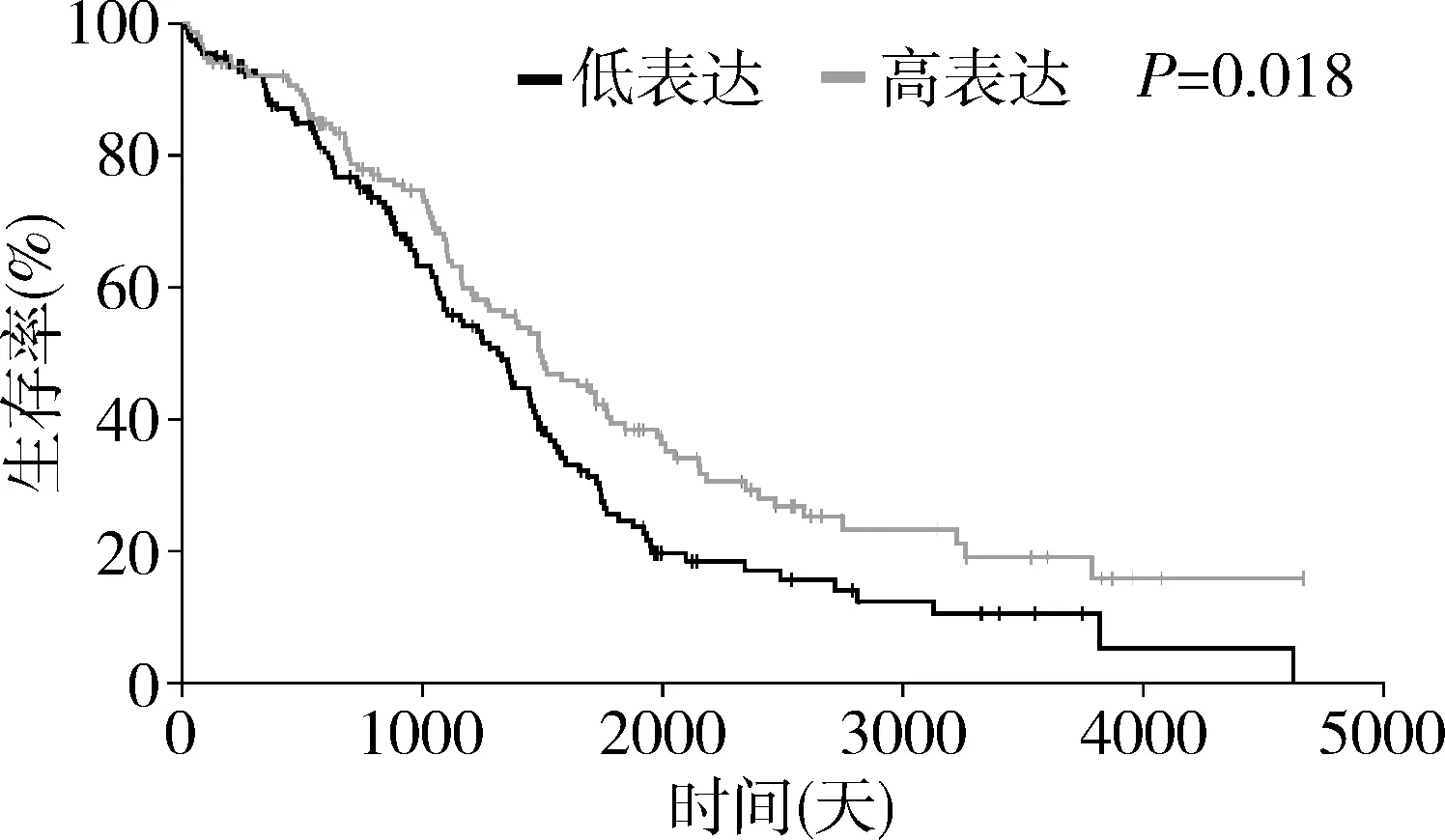
图1 miR-3074-5p表达水平与卵巢癌患者生存期的关系
2.miR-3614-5p在卵巢癌细胞系和正常卵巢上皮细胞中的表达:qRT-PCR检测结果显示,卵巢癌细胞(SKOV-3、OVCAR-3、A2780、HO-8910、OC3)及正常卵巢上皮细胞IOSE80中miR-3614-5p的表达分别为0.58±0.02、0.22±0.03、0.40±0.06、0.69±0.05、0.59±0.09和1.01±0.09。与IOSE80细胞比较,miR-3614-5p在卵巢癌细胞系表达水平显著降低(P<0.01),miR-3614-5p表达最低的细胞是OVCAR-3细胞(P<0.01,图2)。
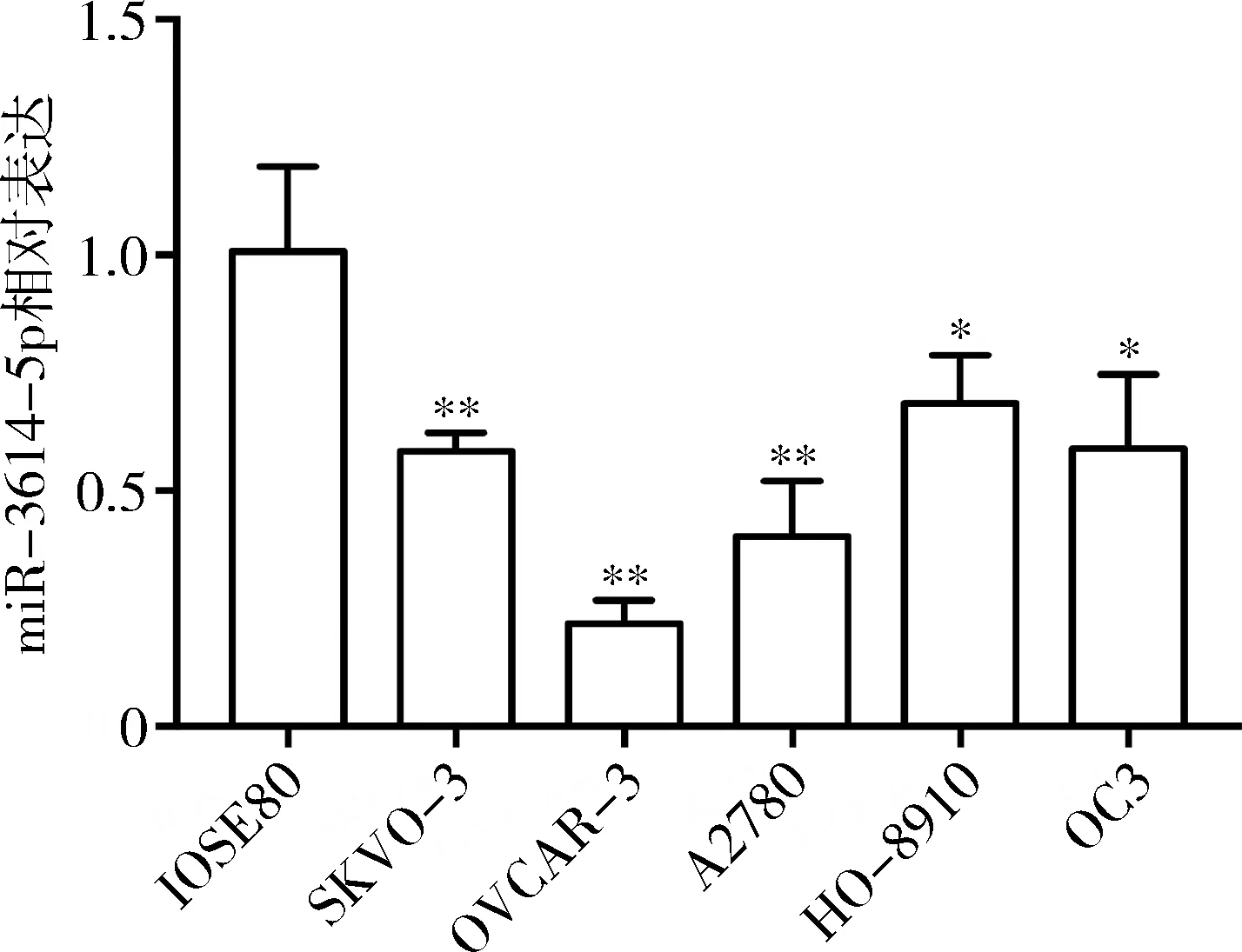
图2 miR-3614-5p在卵巢癌细胞系和正常卵巢上皮细胞中的表达与IOSE80细胞比较,*P<0.05,**P<0.01
3.转染后OVCAR-3细胞中miR-3614-5p表达:miR-3614-5p组和对照组OVCAR-3细胞中miR-3614-5p表达分别为9.96±1.04和0.98±0.16,miR-3614-5p组是对照组的10.16倍(P<0.01)。
4.miR-3614-5p对OVCAR-3细胞增殖能力的影响:CCK-8法检测结果显示,与对照组比较,miR-3614-5p组OVCAR-3细胞在第2、3、4、5天的吸光度值明显降低(P<0.05,图3)。

图3 miR-3614-5p对OVCAR-3细胞增殖能力的影响与对照组比较,*P<0.05
5.miR-3614-5p对OVCAR-3细胞迁移能力的影响:Transwell迁移实验显示,miR-3614-5p组和对照组穿膜细胞数分别为30.53±9.03个和102.70±12.87个,miR-3614-5p组显著少于对照组(P<0.01,图4)。
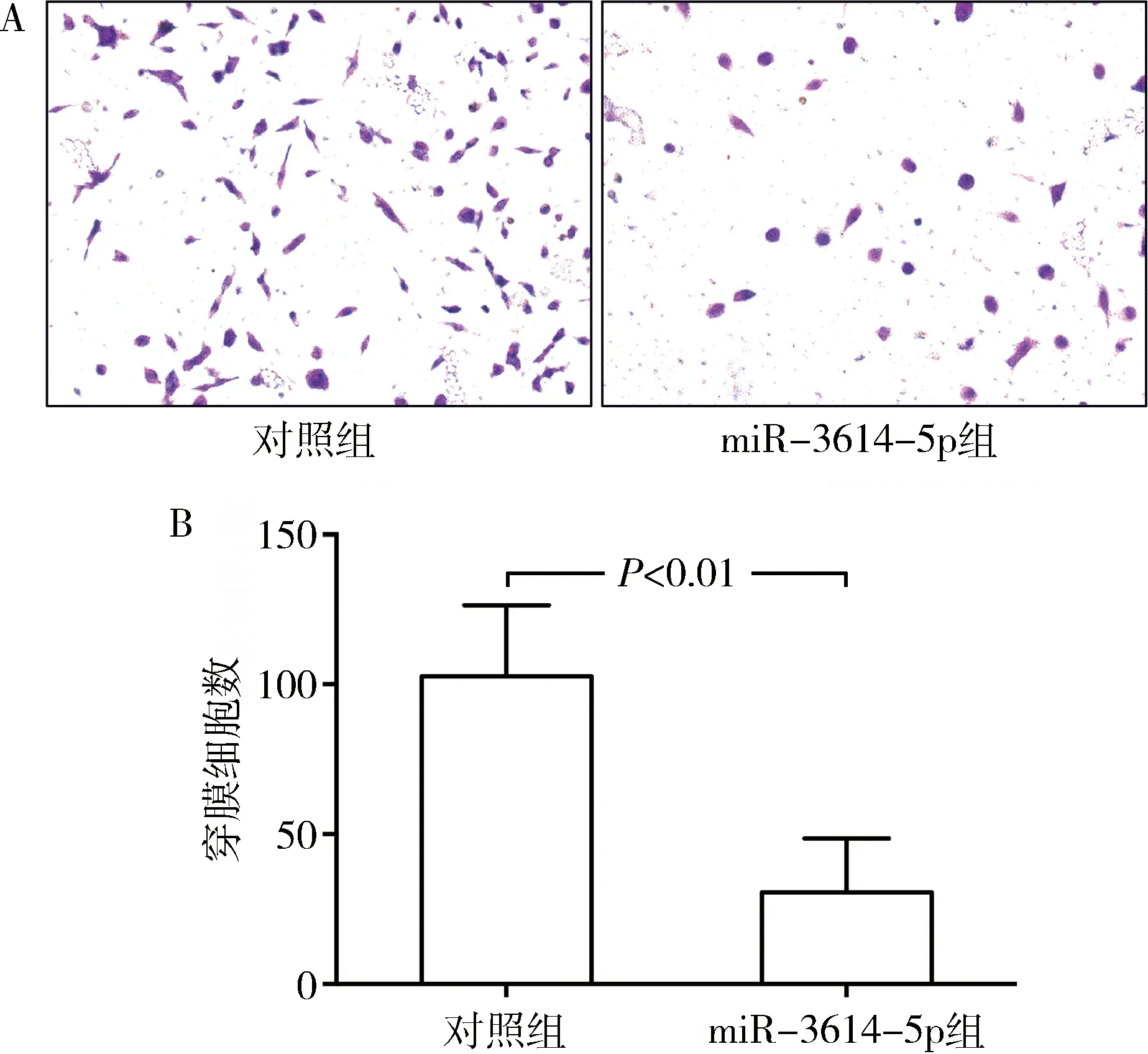
图4 miR-3614-5p对OVCAR-3细胞迁移能力的影响A.Transwell实验镜下图(结晶紫染色,×100);B.Transwell实验定量结果
6.生物信息学软件预测miR-3614-5p的靶基因:利用miRecords和DIANA-microT在线预测软件对miR-3614-5p的靶基因进行预测,发现miR-3614-5p可能与GNAI2 mRNA的3′非翻译区存在潜在结合位点(图5)。

图5 miR-3614-5p与GNAI2 mRNA3′非翻译区的序列配对分析
7. 双荧光素酶报告基因法验证miR-3614-5p的靶基因:双荧光素酶报告基因法显示,GNAI2-w+miR-NC组和GNAI2-w+miR-3614-5p组相对荧光酶活性分别是1.01±0.12和0.23±0.07,转染miR-3614-5p能明显降低转染GNAI2-w的OVCAR-3细胞的相对荧光素酶活性(P<0.01,图6)。

图6 双荧光素酶报告基因法验证miR-3614-5p的靶基因
8.miR-3614-5p对OVCAR-3细胞中GNAI2 mRNA表达的影响:qRT-PCR法检测结果显示,miR-3614-5p组和对照组OVCAR-3细胞中GNAI2 mRNA表达分别为0.24±0.06和1.03±0.09,高表达miR-3614-5p显著抑制GNAI2 mRNA的表达(P<0.01)。
9.高表达miR-3614-5p对GNAI2蛋白和AKT/mTOR信号通路蛋白表达的影响:Western blot法检测结果显示,高表达miR-3614-5p后,GNAI2蛋白表达下调,AKT/mTOR信号通路蛋白如p-AKT、RHEB、p-mTOR的表达明显降低,AKT/mTOR信号通路转导被抑制(图7)。
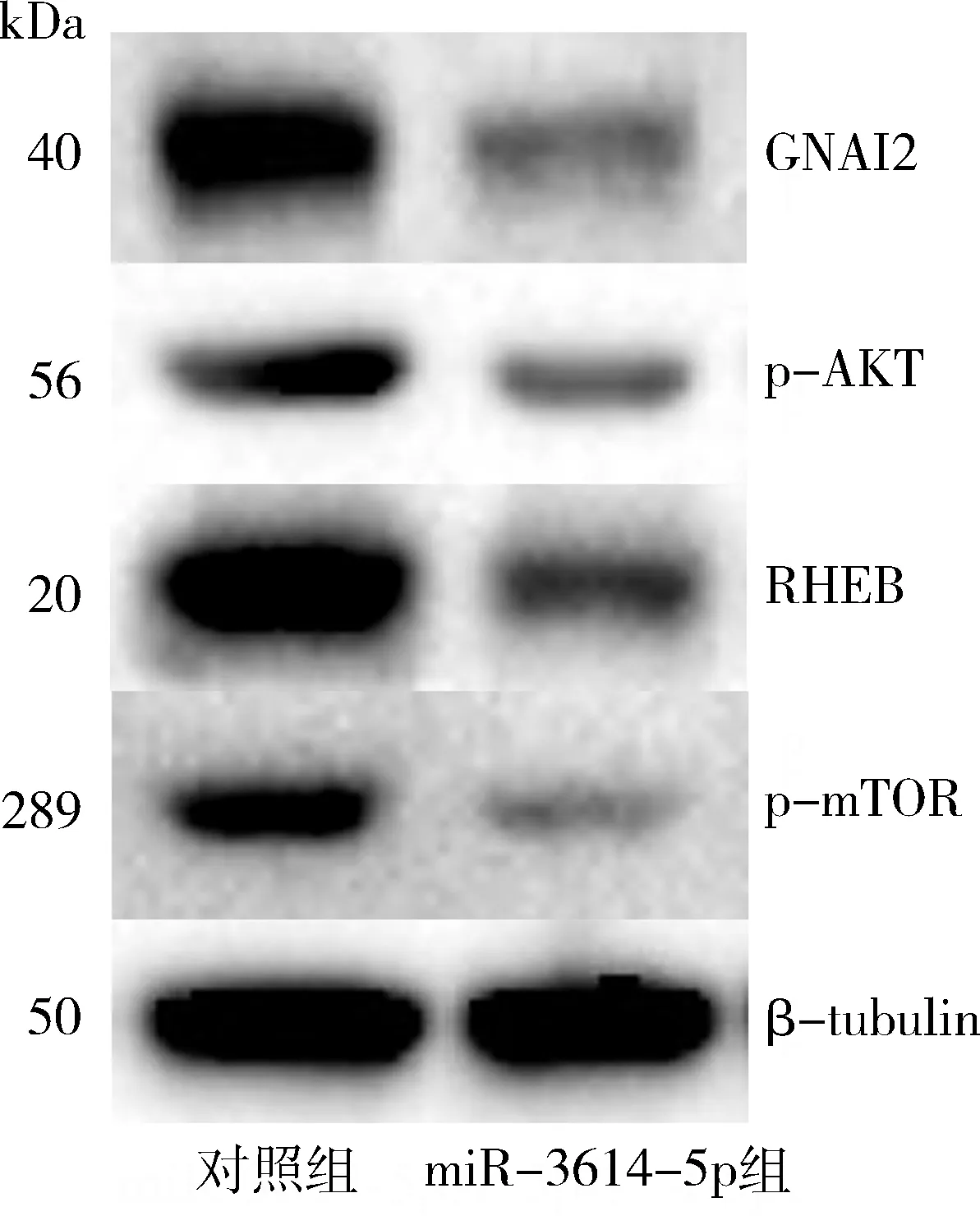
图7 高表达miR-3614-5p对OVCAR-3细胞GNAI2蛋白和AKT/mTOR信号通路蛋白表达的影响
讨 论
miRNA在真核细胞生物体内高度保守,其在细胞分化、发育及生长过程起到关键调节作用[9]。近年来研究显示,miRNA在卵巢癌组织和细胞中表达异常,与卵巢癌的形成密切相关[10~12]。Zeng等[13]研究发现,丙泊酚可以上调卵巢癌细胞系中miR-125a-5p的表达,miR-125a-5p高表达可显著抑制卵巢癌细胞的增殖、迁移和侵袭。Xiao等[14]研究发现,let-7e是卵巢癌患者无进展生存期和总生存期的独立预后因素,let-7e表达失调可通过影响DNA双链断裂修复促进顺铂的耐药,恢复let-7e表达可增强卵巢癌细胞对顺铂的敏感度。Han等[8]研究发现,miR-3614-5p在结直肠癌组织中表达降低,其低表达与结直肠癌患者TNM分期、肿瘤类型、淋巴浸润显著相关,miR-3614-5p低表达的患者总生存率较低。
本研究比较了卵巢癌细胞系和正常卵巢上皮细胞miR-3614-5p的表达,结果显示,卵巢癌细胞系中miR-3614-5p的表达明显低于正常卵巢上皮细胞,说明miR-3614-5p可能参与了卵巢癌的发生和发展。本研究进一步观察了miR-3614-5p在卵巢癌中的生物学功能,结果显示,miR-3614-5p组卵巢癌细胞的增殖水平和迁移能力降低,提示miR-3614-5p在卵巢癌细胞中表现为抑癌作用。miRNA主要以碱基互补配对的方式结合靶基因mRNA,并且依据互补配对的程度,抑制mRNA的翻译或者直接降解mRNA[15,16]。
本研究应用miRecords和DIANA-microT在线预测软件预测发现,miR-3614-5p与G蛋白α抑制剂2(G protein alpha inhibiting activity polypeptide 2,GNAI2)mRNA3′非翻译区存在潜在结合位点。GNAI2蛋白是一种G蛋白家族抑制型蛋白,通过降低腺苷酸环化酶活性,影响多种信号通路的转导[17]。GNAI2蛋白已被公认为促癌蛋白,结肠癌、前列腺癌、食管鳞癌等多种恶性肿瘤中均存在GNAI2蛋白的阳性表达,且GNAI2蛋白在低分化肿瘤组织中的表达高于中高分化组织,GNAI2蛋白表达阳性的患者临床分期较晚、淋巴结转移率较高、生存率较低[18,19]。Fu等[20]研究发现,GNAI2蛋白在卵巢癌细胞系中表达明显增加,GNAI2蛋白能够通过促进AKT/mTOR信号通路转导,促进卵巢癌细胞的增殖,沉默GNAI2表达,抑制卵巢癌细胞的增殖。双荧光素酶报告基因实验证明miR-3614-5p可互补结合GNAI2 mRNA。本研究中,对OVCAR-3细胞转染miR-3614-5p模拟物,miR-3614-5p能够在mRNA和蛋白水平抑制GNAI2的表达。miR-3614-5p负性调控GNAI2蛋白活性后,AKT/mTOR信号通路蛋白如p-AKT、RHEB、p-mTOR的表达明显降低,AKT/mTOR信号通路转导被抑制。
综上所述,miR-3614-5p在卵巢癌细胞系中表达降低,miR-3614-5p通过作用于GNAI2基因mRNA对该基因进行靶向负调控,阻滞AKT/mTOR信号通路转导,抑制卵巢癌OVCAR-3细胞的增殖和迁移过程。miR-3614-5p可能为卵巢癌的miRNA靶向治疗提供新的靶点。

