EB1在小鼠神经系统中表达和功能
宋彬彬 甄 然 彭 宇 丁思妍 杨 璇 于 佳
微管是真核细胞中重要的骨架结构和胞内运输轨道,其散布于胞质中,对于维持细胞结构、形态和功能具有重要作用[1]。微管正端示踪蛋白可特异定位于微管正端,具有保守的特定序列和复杂的相互作用网络,参与调控微管的动态变化,影响细胞内微管依赖的各种生物学过程。微管末端结合蛋白1(end-binding protein 1,EB1)可自发的定位于微管正端,呈彗星状分布,能招募含特定序列的多种蛋白在微管正端的聚集,是形成微管正端示踪蛋白网络的中心分子[2,3]。近年来有报道显示口腔鳞状细胞癌患者中EB1过表达[4]。佩里综合征患者致病基因DCTN1的突变位点位于其与EB1相互作用结构域[5]。以上提示EB1含量和功能异常与多种疾病发生相关。本研究通过生化方法以1.5月龄野生型小鼠、成纤维细胞和HEK293细胞为材料,检测EB1在小鼠神经系统和细胞中表达和分布,以及EB1在细胞自噬通路中的作用。
材料与方法
1.主要仪器和试剂:siRNA转染试剂购自德国QIAGEN公司;10% SDS溶液、蛋白酶抑制剂、蛋白定量试剂盒、蛋白电泳预制胶、超声波细胞破碎仪、荧光标记二抗以及封片液购自美国Thermo Fisher Scientific公司;Turbo转印包、Trans-Blot Turbo转印系统购自美国Bio-Rad公司;鸡抗神经丝重链(neurofilament heavy chian,NFH)单克隆抗体、山羊抗p150glued多克隆抗体购自英国Abcam公司;鼠抗EB1单克隆抗体购自美国BD公司;兔抗EB1多克隆抗体、鼠抗β-actin单克隆抗体、兔抗GAPDH多克隆抗体购自美国Sigma-Aldrich公司;豚鼠抗p62多克隆抗体购自日本MBL Life Science公司;兔抗LC3B多克隆抗体购自美国Novus Biologicals公司;荧光标记二抗、Odyssey红外激光成像系统购自美国LI-COR公司。
2.实验动物:野生型C57BL/6J小鼠购自北京维通利华实验动物技术有限公司,根据实验动物相关规定进行管理和操作。迅速取材小鼠眼(eye)、嗅球(olfactory bulb,OB)、皮质(cortex,CX)、海马(hippocampus,HC)、纹状体(striatum,Str)、中脑(midbrain,Mid)、小脑(cerebellum,CB)、脑干(brainstem,BS)、脊髓(spinal cord,SC)、坐骨神经(sciatic nerve,SN)和腓肠肌(gastrocnemius muscle),冻存于-80℃冰箱。
3.细胞培养与传代:小鼠原代成纤维细胞培养于含有10%胎牛血清和100U/ml青霉素、100μg/ml链霉素的DMEM培养基中,培养于含5% CO2的37℃恒温培养箱。HEK293细胞培养于含有10%胎牛血清和100U/ml青霉素、100μg/ml链霉素的DMEM培养基中,培养于含5% CO2的37℃恒温培养箱中。显微镜下观察细胞生长至80%~90%时用1×TrypLETMExpress Enzyme消化、传代,待细胞增殖旺盛、状态良好时进行实验。
4.siRNA转染:细胞消化后,按照每孔5×105个细胞传代到6孔板中,按照QIAGEN公司HiPerFect Transfection Reagent转染试剂说明书进行EB1 siRNA和scrambled siRNA转染。
5.蛋白免疫印迹法检测蛋白表达水平:1% SDS裂解液裂解HEK293细胞或小鼠组织样品,超声破碎(25% amplitude, 10s on,10s off,3个循环),室温离心16800×g,10min,收集上清为总蛋白提取液。采用BCA试剂盒测定蛋白浓度,取各组等量蛋白提取液经10% SDS-PAGE和NuPAGE预制凝胶电泳,再将预制凝胶中蛋白质电转至硝酸纤维素(nitrocellulose,NC)膜上。将NC膜放入封闭液中封闭30min,加入一抗兔抗EB1、豚鼠抗p62、兔抗LC3B、鼠抗β-actin、兔抗GAPDH、鸡抗NFH,4℃孵育过夜。PBST漂洗5min×3次,将NC膜放入荧光素IRDye®标记的山羊抗兔或山羊抗鸡或山羊抗鼠或山羊抗豚鼠二抗中,孵育1h,PBST漂洗5min×3次,采用Odyssey凝胶成像仪检测蛋白质显色,Image J软件定量蛋白条带的相对灰度。
6.免疫荧光和激光共聚焦显微镜技术:小鼠原代成纤维细胞接种于铺有玻片的24孔板中,贴壁后用-20℃预冷甲醇固定10min后,PBS缓冲液洗5min×3次。封闭液室温封闭30min后,使用一抗鼠抗EB1、山羊抗p150glued室温孵育2h,PBS缓冲液洗5min×3次,使用Alexa Fluor 488/546/647标记的二抗进行免疫染色,室温孵育1h,PBS缓冲液洗5min×3次,封片晾干。使用Zeiss共聚焦激光扫描显微镜(LSM880)拍照,使用Image J软件进行图像分析。

结 果
1.微管正端示踪蛋白EB1在小鼠成纤维细胞中位于微管正端:免疫荧光和激光共聚焦显微镜技术检测结果显示,小鼠成纤维细胞中EB1(绿色荧光)主要聚集于p150glued蛋白标记的微管(紫色荧光)的正端,且呈彗星状分布(图1)。
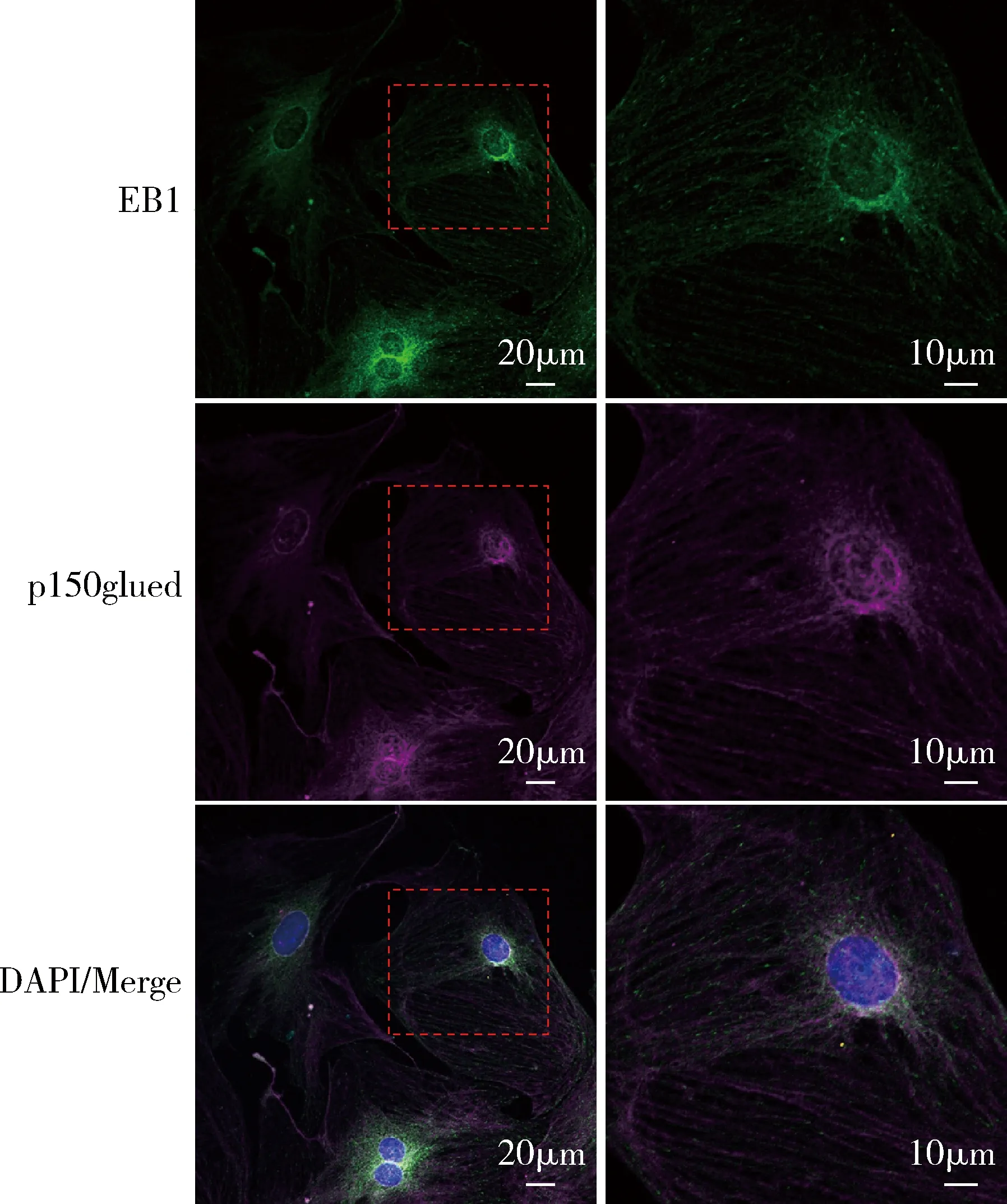
图1 成纤维细胞中EB1蛋白表达与分布成纤维细胞中EB1(绿色荧光)、p150glued(紫色荧光)和DAPI(蓝色荧光)三重免疫荧光染色
2.微管正端示踪蛋白EB1在小鼠神经系统中表达和分布:蛋白印迹法检测结果显示,微管正端示踪蛋白EB1在小鼠眼、嗅球、皮质、海马、纹状体、中脑、小脑、脑干、脊髓、坐骨神经和肌肉中都有一定表达,但其含量具有组织部位差异性(图2中A、B)。β-actin为非肌肉型actin,在肌肉组织中不表达。与脊髓比较,小鼠坐骨神经中EB1蛋白含量均显著下降(图2中C、D)。
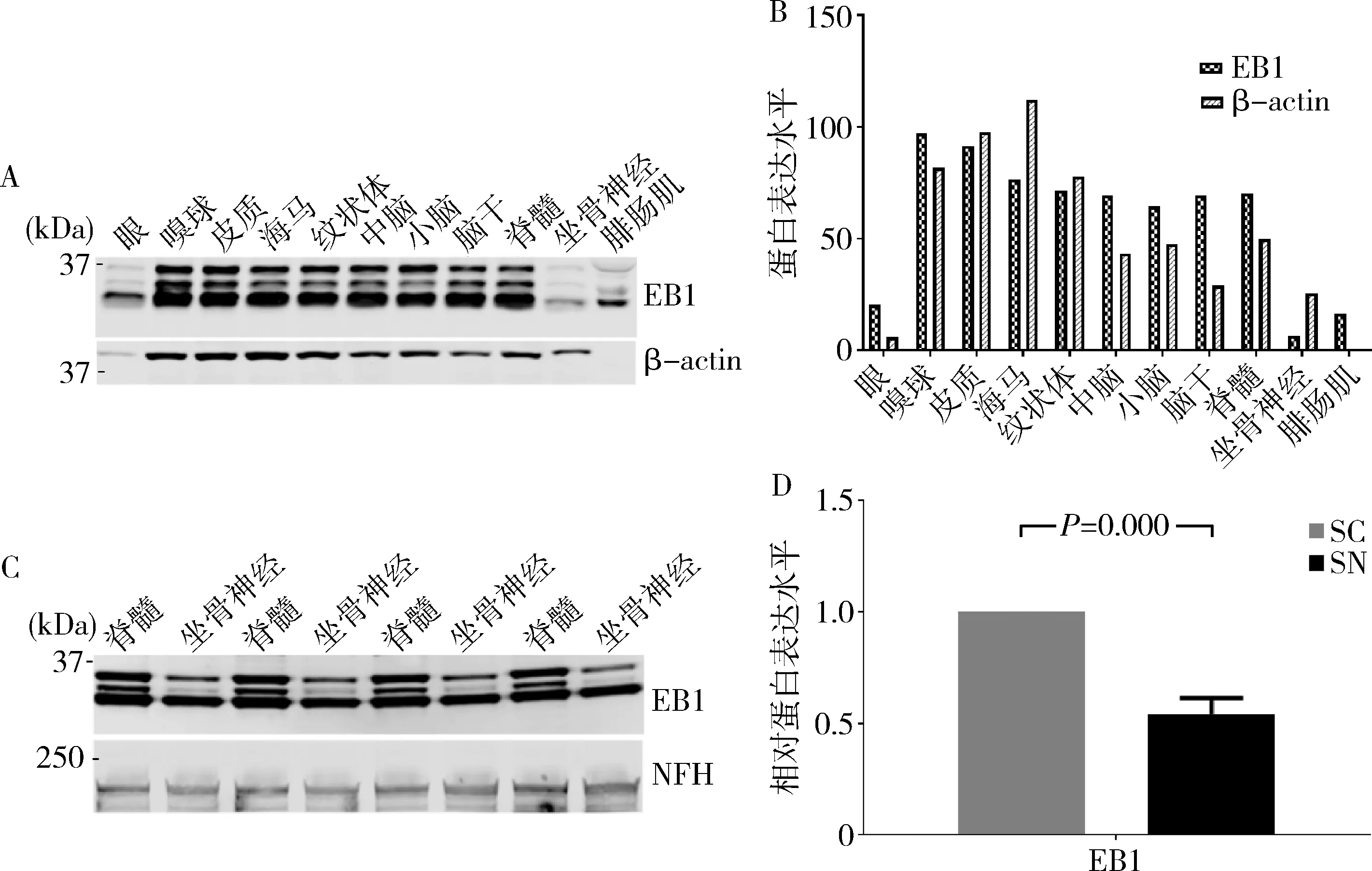
图2 小鼠组织中EB1蛋白表达和分布A.EB1在小鼠眼、脑、脊髓、坐骨神经和腓肠肌中蛋白表达水平;B. EB1在小鼠眼、脑、脊髓、坐骨神经和腓肠肌中蛋白表达水平的定量分析;C.EB1在小鼠脊髓和坐骨神经中蛋白含量;D. EB1在小鼠脊髓和坐骨神经中蛋白含量的定量分析
3.EB1 siRNA在HEK293细胞的自噬溶酶体通路中作用:蛋白印迹法检测结果显示,HEK293细胞中转染EB1 siRNA可显著下调EB1蛋白水平(P<0.01)。且HEK293细胞中敲减EB1可引起自噬通路中关键分子p62和LC3B-Ⅱ蛋白含量显著上调(P<0.05),而LC3B-Ⅰ蛋白水平未发生明显变化(P>0.05,图3)。
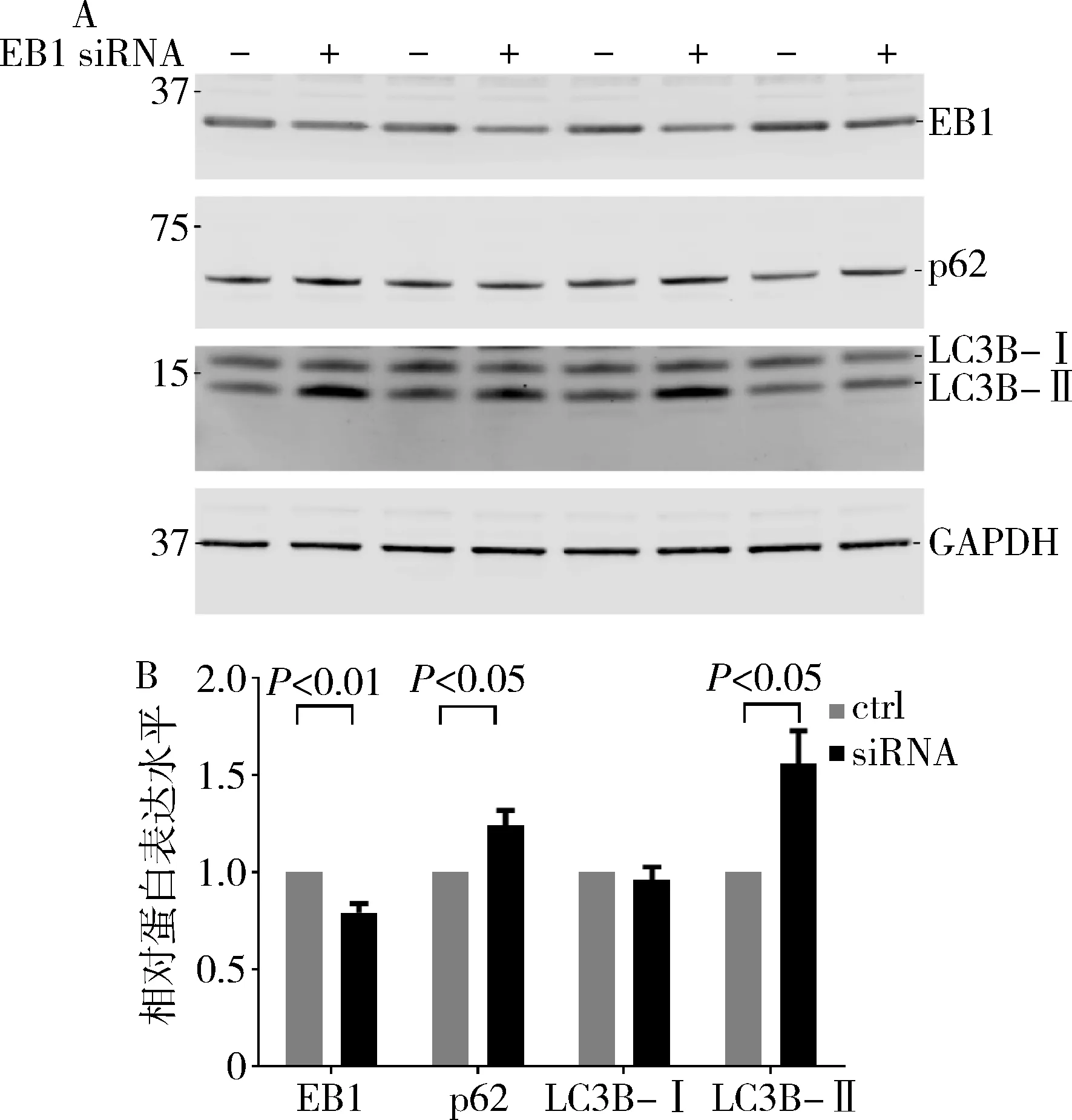
图3 HEK293细胞中敲减EB1对自噬通路关键蛋白含量影响A.HEK293细胞中EB1含量下降引起自噬通路关键蛋白含量变化;B. HEK293细胞中EB1含量下降引起自噬通路关键蛋白含量变化的定量分析。ctrl.hek293细胞中转染scramble siRNA;siRNA.hek293细胞中转染EB1 siRNA
讨 论
微管是真核细胞中广泛存在的纤维管状结构,其两端具有极性,负端位于近核区,聚合速度慢,较稳定;正端指向胞质,处于动态的聚合解聚的快速转换状态,即动态不稳定性(dynamic instability)[6]。微管正端示踪蛋白EB1通过其N端的CH结构域(calponin homology domain, CHD)直接与微管蛋白结合,特异性聚集于微管正端。C端具有卷曲螺旋结构域负责介导EB1二聚体的形成,且C端也可介导其与具有CAP-Gly和SxIP等特定修饰的微管正端示踪蛋白相互作用[7,8]。本研究检测了体外培养的野生型小鼠成纤维细胞中EB1的定位和分布,确认了EB1随微管分散于胞质,且在微管正端高度聚集,呈彗星状分布。
EB1广泛表达于机体各组织部位,参与调控微管动力学和稳定性[9]。研究发现,EB1定位于生长的微管末端,可促进微管持续增长[10]。EB1功能缺失时彗星状结构缩短,生长的微管末端数量减少且生长速率下降,提示微管可能处于崩解状态[11]。HeLa细胞中EBs功能缺失使Clip170和Clasp1在微管正端聚集减少,微管生长和缩短速率均显著下降,崩解和重建频率均显著提高。微管负端在高尔基体聚集减少,而随机分布于胞质中[12]。破骨细胞中微管调控足体的形成,过表达EB1可促进破骨细胞成熟,而EB1功能缺失可通过破坏微管动态不稳定性而抑制足体形成带状结构[13]。本研究结果进一步证实,EB1在小鼠眼、嗅球、皮质、海马、纹状体、中脑、小脑、脑干、脊髓、坐骨神经以及肌肉中均有表达,且表达水平具有组织部位差异性。与脊髓比较,坐骨神经中EB1蛋白含量均显著下降(P<0.05),这提示神经元亚细胞结构轴突束(坐骨神经)中EB1水平较低于胞体(脊髓)。而EB1对于微管具有重要调节作用,因此轴突束中EB1蛋白含量或功能的细微变化即有可能对神经元产生重要影响。
自噬是一种重要的胞内稳态调控机制,是自噬小体包裹待降解货物后通过溶酶体实现降解功能的细胞代谢过程。LC3B是广泛用于检测自噬小体形成、成熟和自噬活性的重要标志蛋白[14]。p62可选择性募集泛素化蛋白质,并与LC3结合,参与自噬小体的形成[15]。研究发现,微管及微管相关蛋白可调控自噬小体的形成、运输及其与溶酶体的融合过程[16]。Huh-7细胞中药物破坏微管可明显促进自噬小体的生成[17]。Wei等[18]研究发现,EB1可与CAMSAP2蛋白相互作用,调节非中心体微管的动力学特性。破坏EB1与CAMSAP2的结合可影响EB1在微管末端分布,改变微管生长方向,使自噬小体逆向运输障碍,导致LC3-Ⅱ蛋白水平提高,自噬小体积累。本研究发现,HEK293细胞中敲减EB1可引起p62和LC3A/B-Ⅱ蛋白含量显著上调(P<0.05),这提示EB1缺失可能通过引起微管正端结构和功能障碍而引起自噬小体积累,导致自噬异常。
综上所述,微管正端示踪蛋白EB1可招募蛋白质在微管正端的定位,是连接微管正端示踪蛋白网络的关键分子,对于调控微管稳定性和动力学具有重要作用[19]。本研究检测了EB1在小鼠经系统中的表达,发现其广泛存在且具有组织部位特异性。与胞体比较,轴突束中EB1蛋白含量显著下降。EB1特异性聚集于微管正端,在HEK293细胞中敲减EB1可能通过破坏微管正端结构和功能,减少自噬小体的形成和运输,从而引起自噬异常。自噬异常与神经元损伤和死亡密切相关[20]。本研究可为揭示微管正端示踪蛋白EB1如何参与神经系统疾病提供科学依据。

