颅内感染患者胰岛素抵抗与血清IL-1β和TLR-4表达的临床意义
樊玉香, 郭电渠, 王满利, 刘文斌, 娄 萍
(郑州市第一人民医院神经重症监护室,郑州 450000)
颅内感染多继发于颅脑外伤以及术后,是导致患者死亡的主要并发症之一。颅内感染的发生机制目前尚不十分清楚,可能是血脑屏障被破坏、腹腔内脏病原菌移位至颅内引发感染,或者外伤本身损伤了颅骨、颅脑组织,引起颅内压明显升高,脑组织水肿严重,脑内循环紊乱,增加了机体感染、炎症反应和应激反应风险[1]。有研究[2]发现,颅内感染患者发生胰岛素抵抗的现象较普遍,胰岛素抵抗不仅是血糖代谢能力下降,同时也是机体对外界创伤或应激的防御,通过调节胰岛素释放和机体对胰岛素的敏感程度引起免疫功能变化和伤口愈合。白细胞介素-1β(IL-1β)被认为是炎症反应以及瀑布样放大的前沿强效促炎因子和核心枢纽因子,能够进一步诱导机体释放IL-6、IL-8、肿瘤坏死因子-α(TNF-α)、INF-γ等炎症因子,从而形成炎症反应网络[3]。Toll样受体-4(TLR-4)被认为机体识别病原微生物和异源分子的重要桥梁,通过其表面的模式受体信号介导抗原提呈细胞获取靶分子并转移至效应靶细胞,如细胞毒性T细胞,从而杀伤病原微生物和异源分子[4]。目前,关于颅内感染的发生是否与机体胰岛素抵抗以及血清IL-1β、TLR-4表达有关的研究较少。本研究探讨胰岛素抵抗与血清IL-1β、TLR-4表达在颅内感染发生中的临床意义,为疾病的发生机制和早期临床诊断提供重要生化指标。
1 对象与方法
1.1 对象 选取2018年6月—2020年6月郑州市第一人民医院诊治的急性颅脑外伤术后患者74例,依据是否发生颅内感染分为观察组(继发颅内感染13例)和对照组(未继发颅内感染61例)。纳入标准:①年龄18~75岁,平素体健。②单纯颅脑外伤,无其他部位复合伤,手术顺利完成,术后意识恢复,所有患者均康复出院,无明显神经功能障碍后遗症。③感染诊断依据临床体征+血清生化指标+病原微生物检测。④临床资料完整。排除标准:①既往患糖尿病、严重肝肾功能障碍、自身免疫性疾病。②入院后较快进展至器官衰竭,术前已存在明显的感染征象。③对抗感染反应不敏感或耐药。2组性别、年龄、体质量指数等比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组患者一般资料比较
1.2 方法
1.2.1 检测方法 颅脑感染通常发生在术后3~7 d,选择术后2 d检测各项指标。比较2组患者术前1 d和术后2 d血清空腹血糖(FBG)和空腹胰岛素(FINS)水平,计算胰岛素抵抗指数(HOMA-IR),比较血清IL-1β和TLR-4水平。最后采用受试者操作特征曲线(ROC曲线)分析评估HOMA-IR、IL-1β和TLR-4预测术后发生颅内感染的准确性。HOMA-IR=FBG(mmol·L-1)×FINS(mIU·L-1)/22.5,通常无胰岛素抵抗者HOMA-IR为1,大于1提示存在胰岛素抵抗,水平越高表示胰岛素抵抗程度越严重。FBG采用葡萄糖氧化酶法,试剂购自江苏碧云天科技有限公司;血浆FINS采用放射免疫法,试剂购自北京中杉金桥生物有限公司;酶联免疫吸附法(ELISA)检测IL-1β和TLR-4,试剂购自美国R&D公司;均严格按照说明书步骤进行,IL-1β检测范围7.5~240.0 ng·L-1,TLR-4检测范围<15 ng·L-1。患者均分别检测3次取平均值。
1.2.2 观察指标 ① FBG、FINS以及HOMA-IR水平。②血清IL-1β和TLR-4水平。③ROC曲线分析结果。
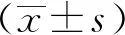
2 结果
2.1 2组患者胰岛素抵抗比较 术前2组FBG和FINS水平以及HOMA-IR比较,差异无统计学意义(P>0.05);术后2组上述指标均较术前升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表2。
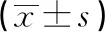
表2 2组患者胰岛素抵抗比较
2.2 2组患者血清IL-1β和TLR-4水平比较 2组术前血清IL-1β和TLR-4水平比较,差异无统计学意义(P>0.05);术后2组IL-1β和TLR-4水平均较术前升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表3。

表3 2组患者血清IL-1β和TLR-4水平比较
2.3 ROC曲线分析结果 将2组患者术后血清HOMA-IR、IL-1β和TLR-4水平作为自变量,是否发生颅内感染作为因变量,纳入ROC模型结果发现,HOMA-IR、IL-1β和TLR-4预测颅内感染的准确性分别为0.721、0.769和0.782(P<0.05)。见表4。

表4 ROC曲线分析结果
3 讨论
徐廷伟等[5]对344例神经外科手术患者的研究发现,颅内感染发生率为9.30%,其中脑室外引流、麻醉风险美国麻醉师协会(ASA)评分、脑脊液漏和手术时间是术后发生颅内感染的独立危险因素。颅内感染是术后严重并发症,是导致手术失败,延长住院时间,增加神经损伤后遗症的重要原因。预防性应用抗生素并不能明显降低术后感染的发生风险,随着耐药菌的出现,如何预防或降低术后颅内感染的发生是神经外科研究的难点[6]。
颅内感染通常发生在术后3~7 d,与血脑屏障破坏或重新建立、炎症和应激反应程度最严重、手术增加二次创伤以及脑水肿严重等因素有关[7]。本研究结果发现,观察组术后FBG和FINS水平以及HOMA-IR明显高于对照组,提示颅内感染患者同时伴随较高的胰岛素抵抗。应激性高血糖通常发生在手术、感染、麻醉等过程中,是机体应对外界不良环境的一种自我防御,通过提高血糖浓度增加供能来源,降低外周肌肉细胞对胰岛素的敏感性,也可以反过来提高血糖浓度,同时,胰岛素也能影响术后伤口的愈合[8]。动物模型研究[9]认为,对创口局部应用一定浓度的胰岛素可以促进多种细胞活性因子,如血管内皮生长因子、成纤维生长因子等释放和表达,促进胶原蛋白沉积,从而有利于伤口愈合。本研究结果发现,观察组术后血清IL-1β和TLR-4水平高于对照组,提示颅内感染的发生与机体释放过量的促炎因子和模式识别受体有关。孙桂好等[10]探讨了血清和脑脊液中炎症因子CRP、TNF-α和IL-6的检测对诊断颅内感染和鉴别感染病原菌类型(化脓性、病毒性、结核性)有重要的应用价值。宋钦等[11]研究指出,联合检测血清降钙素原(PCT)、IL-6、IL-8和IL-10水平,对高血压脑出血患者开颅术后颅内感染的早期诊断具有重要意义。尽管已有较多研究探讨了多种生化指标对早期诊断颅内感染的重要价值,但是缺乏统一标准,在临床中仅作为辅助参考。筛选后IL-1β可能更适合作为临床诊断指标,因为IL-1β是其他所有白细胞介素类炎症因子以及非白细胞介素类炎症因子如CRP、TNF-α、PCT以及INF-γ释放和表达的前沿诱导因子,IL-1β对病原微生物进入机体后十分敏感,对自身构象的剪切改变促其成熟,并迅速聚集于病原微生物处,招募更多的炎症细胞如白细胞、淋巴细胞、肥大细胞以及单核-巨噬细胞等,吞噬病原菌并释放更多种类和更大量的炎症介质,发挥消灭病原菌的目的[12];在炎症后期也就是病原菌消灭、伤口愈合时期,通过恢复IL-1β稳定态阻断炎症级联放大效应的发生,从而降低机体炎症反应强度[13]。TLR-4属于模式识别受体,主要对病原相关分子和机体危险相关分子配体进行主动识别,活化后通过其胞浆区Toll/IL-1受体结构域与衔接蛋白髓样分化因子(MyD88)形成复合物,进而活化核因子κB,介导IL-1β等炎症因子的转录和表达[14-15]。
本研究通过ROC分析证实,术后HOMA-IR、IL-1β和TLR-4预测颅内感染均有较好的准确性,为今后建立更大样本更加准确的参考区间提供了重要依据。颅脑外伤术后继发颅内感染患者可能伴随胰岛素抵抗与血清IL-1β和TIL-4表达水平的升高,有望作为早期预测颅内感染发生的敏感性生化指标。本研究不足之处为颅内感染阳性患者数量较少,可能影响数据的准确性,因此,还需要更大样本量的临床随机对照试验进行验证。

