过表达miR-30b-3p靶向CXCL16对H2O2诱导的血管内皮细胞氧化应激和凋亡的影响
景增秀 康桂兰 魏秀邦 刘彦武
(1西宁市第二人民医院心血管内科,青海 西宁 810003;2吴忠市人民医院心血管内科)
血管内皮细胞损伤导致的血栓形成是高血压、冠心病等多种心血管疾病发生的病理基础〔1,2〕。研究显示,氧化应激可通过促进细胞产生过量的炎症因子,降解细胞外基质,促使细胞凋亡等方式损伤血管内皮细胞〔3,4〕。氧化应激造成的血管内皮细胞损伤主要是由于活性氧介导的,过氧化氢(H2O2)是活性氧类物质之一,常用于体外氧化应激模型的建立〔5〕。微小RNA(miRNA)是一类小分子单链非编码RNA,长度为18~25个核苷酸,可在转录后抑制或降解mRNA的翻译调控细胞增殖、凋亡、分化等生物学过程,参与疾病的发生和发展〔6〕。研究表明,miR-30b-3p在肝脏缺血再灌注损伤小鼠的肝组织中低表达,过表达miR-30b-3p可减轻小鼠肝脏缺血再灌注损伤〔7〕。miR-30b的过表达对糖氧剥夺诱导的视网膜神经节细胞发挥保护损伤〔8〕。目前,miR-30b-3p是否影响H2O2诱导的人脐静脉内皮细胞氧化应激和凋亡还未知。本研究主要探讨了miR-30b-3p对H2O2诱导的人脐静脉血管内皮细胞EVC-304氧化应激和凋亡的影响及其可能的调控机制。
1 材料与方法
1.1材料和试剂 EVC-304细胞,武汉大学细胞典藏中心;胎牛血清和RPMI1640培养基,美国Hyclone公司;血清CXC趋化因子配体(CXCL)16抗体,美国Novus公司;GAPDH、B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)和酶切含半胱氨酸的天冬氨酸蛋白水解酶(caspase)3抗体,美国Santa Cruz公司;miR-30b-3p模拟物(mimics)阴性对照、CXCL16的siRNA及阴性对照,上海Gnen Pharma公司;Lipofectamine2000转染试剂,美国Invitrogen公司;Annexin V-FITC/PI凋亡试剂盒,南京森贝伽生物公司;丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物还原酶(GSH-Px)检测试剂盒,南京建成生物工程研究所;双荧光素酶报告基因检测试剂盒,威格拉斯生物技术(北京)有限公司。
1.2方法
1.2.1细胞培养和分组 复苏EVC-304细胞,用含10%胎牛血清的RPMI1640培养基置于37℃、5%CO2、97%湿度的培养箱中培养。待细胞融合至80%~90%后,0.25%胰蛋白酶溶液消化,更换新鲜培养基进行培养。取对数生长期EVC-304细胞分组处理。对照组(Con组):正常培养EVC-304细胞,不做任何处理;H2O2组:100 μmol/L的H2O2作用EVC-304细胞12 h〔9〕;H2O2+miR-30b-3p 组:EVC-304细胞转染miR-30b-3p mimics 24 h后再加入终浓度为100 μmol/L的H2O2作用12 h;H2O2+miR-NC组:EVC-304细胞转染miR-30b-3p mimics阴性对照24 h后,再加入终浓度为100 μmol/L的H2O2作用12 h;H2O2+si-CXCL16组:EVC-304细胞转染CXCL16的siRNA干扰24 h后,再加入终浓度为100 μmol/L的H2O2作用12 h;H2O2+si-NC组:EVC-304细胞转染CXCL16的siRNA阴性对照24 h后,再加入终浓度为100 μmol/L的H2O2作用12 h;H2O2+miR-30b-3p+pcDNA-CXCL16组:共转染miR-30b-3p mimics和CXCL16过表达质粒24 h后,再加入终浓度为100 μmol/L的H2O2作用12 h;H2O2+miR-30b-3p+pcDNA组:共转染miR-30b-3p mimics和空质粒24 h后,再加入终浓度为100 μmol/L的H2O2作用12 h。转染具体步骤按照 Lipofectamine2000转染试剂说明书进行操作。
1.2.2qRT-PCR检测miR-30b-3p和CXCL16 mRNA Trizol试剂提取细胞中总RNA,微量核酸仪检测RNA纯度和浓度。RNA逆转录为cDNA,以cDNA为模板进行PCR扩增。扩增条件为95℃预变性10 min,95℃变性5 s,60℃退火30 s,共40个循环。miR-30b-3p以U6为内参,CXCL16以GAPDH为内参,2-△△Ct法计算miR-30b-3p和CXCL16 mRNA的相对表达水平。
1.2.3Western印迹检测蛋白表达 处理后的各组细胞,预冷的磷酸盐缓冲液(PBS)清洗后,加入RIPA裂解液提取细胞中的总蛋白,二喹啉甲酸(BCA)法测定蛋白含量。取适量蛋白,加入上样缓冲液,100℃煮沸5 min使其变性后,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白。电泳后转移至聚偏氟乙烯(PVEF)膜,5%脱脂牛奶封闭2 h。加入一抗,4℃孵育过夜。TBST洗膜后,加入辣根据过氧化物酶(HRP)标记的二抗,室温孵育1 h。TBST洗膜后,加入电化学发光(ECL)避光显影,凝胶成像系统曝光拍照。以GAPDH为内参,Image J软件对蛋白含量进行半定量分析。
1.2.4酶联免疫吸附试验检测MDA、SOD和GSH-Px 处理后的各组细胞,预冷的PBS清洗后,加入细胞裂解液进行裂解。3 500 r/min离心10 min,收集上清液。酶联免疫吸附试验分别检测MDA、SOD和GSH-Px水平,具体操作步骤参照试剂盒说明书。
1.2.5流式细胞仪检测细胞凋亡 处理后的各组细胞,预冷的PBS清洗后弃上清液,加入400 μl结合缓冲液制成单细胞悬液,然后依次加入5 μl Annexin V和5 μl的PI,室温避光染色15 min,上流式细胞仪检测细胞凋亡。
1.2.6双荧光素酶报告基因实验 生物信息预测网站预测miR-30b-3p与CXCL16的3′UTR存在结合序列,使用PCR技术扩增结合序列。将miR-30b-3p与CXCL16基因的结合片段插入到荧光素酶载体中,构建CXCL16野生型质粒(WT-CXCL16)。并利用基因突变技术将个别核苷酸结合位点序列突变,构建CXCL16突变型质粒(MUT-CXCL16)。使用LipofectamineTM2000将WT-CXCL16、MUT-CXCL16质粒分别与miR-30b-3p mimics及阴性对照共转染至EVC-304细胞,参照双荧光素酶报告基因检测试剂盒说明书,检测各组细胞的荧光素酶活性。
1.3统计学分析 采用SPSS22.0软件进行t检验、单因素方差分析。
2 结 果
2.1H2O2处理对EVC-304细胞miR-30b-3p和CXCL16表达的影响 与Con组比较,H2O2组EVC-304细胞中miR-30b-3p表达水平显著降低(P<0.05),CXCL16 mRNA和蛋白水平显著升高(P<0.05)。见图1、表1。

图1 Western印迹检测CXCL16蛋白表达

表1 H2O2处理对EVC-304细胞miR-30b-3p和CXCL16表达的影响
2.2miR-30b-3p过表达对H2O2诱导的EVC-304细胞氧化应激的影响 H2O2+miR-30b-3p组miR-30b-3p水平显著高于H2O2+miR-NC组(P<0.05),表明miR-30b-3p mimics转染成功。与Con组比较,H2O2组MDA水平显著升高(P<0.05),SOD和GSH-Px水平显著降低(P<0.05)。与H2O2+miR-NC组比较,H2O2+miR-30b-3p组MDA水平显著降低(P<0.05),SOD和GSH-Px水平显著升高(P<0.05)。见表2。

表2 miR-30b-3p过表达对H2O2诱导的EVC-304细胞氧化应激的影响
2.3miR-30b-3p过表达对H2O2诱导的EVC-304细胞凋亡的影响 与Con组比较,H2O2组凋亡率显著升高(P<0.05),Bcl-2水平显著降低(P<0.05),Bax和酶切caspase3水平显著升高(P<0.05)。与H2O2+miR-NC组比较,H2O2+miR-30b-3p组凋亡率显著降低(P<0.05),Bcl-2水平显著升高(P<0.05),Bax和酶切caspase3水平显著降低(P<0.05)。见图2、表3、图3。

1~4:con组,H2O2组,H2O2 miR-NC组,H2O2+miR-30b-3p组图2 Western印迹检测凋亡相关蛋白表达

图3 miR-30b-3p过表达对H2O2诱导的EVC-304细胞凋亡的影响

表3 miR-30b-3p过表达对H2O2诱导的EVC-304细胞凋亡的影响
2.4抑制CXCL16表达对H2O2诱导的EVC-304细胞氧化应激和凋亡的影响 H2O2+si-CXCL16组CXCL16蛋白水平显著低于H2O2+siNC组(P<0.05),表明EVC-304细胞中CXCL16蛋白表达被抑制。与H2O2+si-NC组比,H2O2+si-CXCL16组MDA水平显著降低(P<0.05),SOD和GSH-Px水平显著升高(P<0.05),凋亡率显著降低(P<0.05),Bcl-2水平显著升高(P<0.05),CXCL16、Bax和酶切caspase3蛋白水平显著降低(P<0.05);见图4、表4。

1,2:H2O2+si-NC组,H2O2+si-CXCL16组图4 Western印迹检测CXCL16及凋亡相关蛋白表达

表4 抑制CXCL16表达对H2O2诱导的EVC-304细胞氧化应激和凋亡的影响
2.5miR-30b-3p靶向调控CXCL16的表达 生物信息学软件预测显示,CXCL16的3′UTR中含有与miR-30b-3p互补的核苷酸序列,提示miR-30b-3p可能调控CXCL16表达。见图5。双荧光素酶报告实验结果显示,miR-30b-3p mimics可显著降低WT-CXCL16的荧光素酶活性(P<0.05),而对MUT-CXCL16的荧光素酶活性无显著影响(P>0.05),见表5。表明miR-30b-3p可与CXCL16的3′UTR结合。miR-30b-3p组CXCL16蛋白水平(0.21±0.02)显著低于miR-NC组(0.45±0.05,P<0.05),anti-miR-30b-3p组CXCL16蛋白水平(0.87±0.08)显著高于anti-miR-NC组(0.43±0.04,P<0.05),表明miR-30b-3p负调控CXCL16表达,见图6。

表5 双荧光素酶报告实验

图5 CXCL16的3′UTR中含有与miR-30b-3p互补的核苷酸序列
2.6CXCL16过表达逆转了miR-30b-3p过表达对H2O2诱导的EVC-304细胞氧化应激和凋亡的作用 与H2O2+miR-30b-3p+pcDNA组比较,H2O2+miR-30b-3p+pcDNA-CXCL16组MDA水平显著升高(P<0.05),SOD和GSH-Px水平显著降低(P<0.05),凋亡率显著升高(P<0.05),Bcl-2蛋白水平显著降低(P<0.05),CXCL16、Bax和酶切caspase3蛋白水平显著升高(P<0.05)。见图7和表6。

1~4:miR-NC组,miR-30b-3p组,anti-miR-NC组,anti-miR-30b-3p组图6 Western印迹检测CXCL16表达
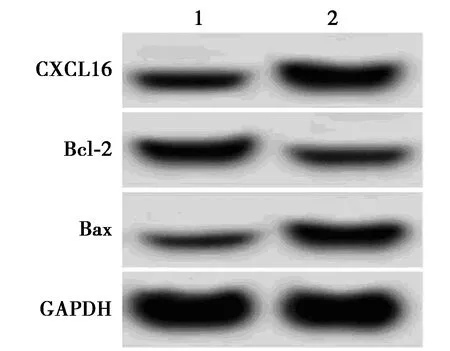
1,2:H2O2+miR-30b-3p+pcDNA组,miR-30b-3p+pcDNA-CXCL16组图7 Western印迹检测

表6 CXCL16过表达逆转了miR-30b-3p过表达对H2O2诱导的EVC-304细胞氧化应激和凋亡的作用
3 讨 论
血管内皮细胞具有多种生理功能,参与维持血管张力、调节血压及凝血与抗凝平衡等生命活动〔10〕。血管内皮细胞受损是多种心血管疾病的病理基础,而氧化应激可导致血管内皮细胞受损〔11〕。SOD和GSH-Px是生物体内重要的抗氧化酶,可缓解细胞的氧化损伤,并修复受损的细胞,其活性高低是反映机体抗氧化损伤程度的直观指标〔12〕。MDA是脂质过氧化产物之一,其水平升高可加剧细胞损伤,可反映细胞受损的程度〔13〕。本研究结果表明H2O2诱导EVC-304细胞产生了氧化应激反应,并促进了EVC-304细胞凋亡。
miRNA参与调控细胞的生长、增殖、凋亡等多种生物学行为,与疾病的发生和发展密切相关。有报道称,miR-126、miR-181a、miR-217等多个miRNA参与氧化应激诱导的人脐静脉内皮细胞凋亡,并且一些miRNA在氧化应激的人脐静脉内皮细胞中表达上调,一些miRNA表达下调〔14〕。上调miR-23b表达可能通过抑制丝裂原活化蛋白激酶(MAPK)信号通路的激活减少H2O2诱导的人脐静脉内皮细胞凋亡,对H2O2诱导的人脐静脉内皮细胞发挥保护作用〔15〕。过表达miR-138能够抑制H2O2诱导的小鼠小胶质细胞BV-2的凋亡〔16〕。本研究结果提示miR-30b-3p参与EVC-304细胞氧化应激反应。过表达miR-30b-3p可提高H2O2诱导的EVC-304细胞中SOD和GSH-Px水平,降低MDA水平,表明过表达miR-30b-3p可降低H2O2诱导的EVC-304细胞氧化应激反应;表明过表达miR-30b-3p可降低H2O2诱导的EVC-304细胞凋亡。
CXCL16是新近发现的CXC(α亚族)趋化因子家族新成员,参与心力衰竭、脑梗死等心血管疾病的发展过程〔17,18〕。研究显示,脂多糖诱导的人脐静脉血管内皮细胞中CXCL16表达上调〔19〕。抑制CXCL16表达可降低低密度脂蛋白诱导的小鼠足细胞活性氧表达,发挥足细胞保护作用〔20〕。本研究结果提示CXCL16也参与H2O2诱导的EVC-304细胞氧化应激反应和凋亡,miR-30b-3p可能通过调控CXCL16表达发挥作用;miR-30b-3p在EVC-304细胞中负调控CXCL16表达。

