视黄醇脱氢酶5在豚鼠形觉剥夺性近视眼中的表达变化△
毛玉梅 兰长骏 杨 琴 钟维琪 谷志明 周桂梅 廖 萱
近视是全球性视力下降的主要原因。我国的近视患病率持续上升并呈现低龄化趋势,同时近视会增加患青光眼、视网膜脱离、黄斑萎缩和脉络膜新生血管等严重并发症的可能性,已成为重大的公共卫生事件[1-2]。近年来,视黄醇脱氢酶5(RDH5)基因在全基因组关联研究中被鉴定出与近视相关[3-5]。RDH5基因位于12q13.2[6],编码RDH5或称11-顺式视黄醇脱氢酶,既往研究发现其代谢产物参与调控近视的形成和发展[7-11]。基于DNA元件百科全书和全基因组关联研究信息,本团队前期筛选出近视易感基因RDH5及潜在功能位点(RDH5/rs3138142和rs3138144)[12],并证实rs3138144能影响 RDH5基因启动子转录活性[13]。但RDH5基因参与近视发生发展的机制尚未完全明了。本研究通过检测豚鼠形觉剥夺性近视(FDM)模型中RDH5的表达差异,探索RDH5在近视发生发展中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组选择3周龄左右清洁级的三色豚鼠共30只,体重150~180 g(购自重庆腾鑫生物技术有限公司)。所有豚鼠均饲养于SPF级实验室,恒温22 ℃,湿度60%,给予充足的饲料和自来水,保证12 h光照和12 h 黑暗,定期补充蔬菜、水果。动物的使用和饲养遵守美国视觉与眼科学研究协会发布的《视觉和眼科动物研究声明》(ARVO),并经川北医学院实验动物伦理委员会审核批准(伦理号NSMC202107)。
采用随机数字表法将豚鼠分为实验组(15只)和空白对照组(15只)。按照Lu等[14]和姜波等[15]的方法,根据每只豚鼠的大小制作乳胶面罩头套,实验组豚鼠的右眼(FDM组15眼)遮盖,而鼻、嘴和耳暴露;左眼正常视物(自身对照组15眼),保证觅食和生存。空白对照组豚鼠的双眼均不做任何处理。
1.1.2 主要试剂及仪器复方托吡卡胺滴眼液及盐酸奥布卡因滴眼液(中国参天制药公司);40 g·L-1多聚甲醛、牛血清白蛋白及抗荧光淬灭封片剂(中国索莱宝公司);Trizol试剂、反转录试剂盒及荧光定量试剂盒(日本Takara公司);RDH5抗体和HRP标记的山羊抗兔二抗(英国Abcam公司);β-actin(中国Bioworld公司);ECL显影液(中国葆光生物公司);RIPA裂解液(中国博士德公司);荧光标记的山羊抗兔二抗(上海Jackson公司);Cinescan A/B(法国Quantel Medical公司);分光光度计和酶标仪(美国Thermo Scientific公司);实时荧光定量PCR仪和化学发光凝胶成像分析仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 豚鼠屈光度和眼轴长度的检测均采用带状光检影和A超对各组豚鼠进行屈光度和眼轴长度的检测。尽量保证豚鼠在检测过程中眼位恒定。至少保证3次及以上的重复测量,并删除误差较大的数值,最后取平均值。分别于遮盖前,遮盖1周、2周、3周、4周后,均由同一熟练视光师进行测量。
1.2.2 实时荧光定量PCR检测各组豚鼠RDH5 mRNA表达遮盖4周后,取不同组别的豚鼠处死并剥离视网膜色素上皮(RPE)细胞,立即加入1 mL Trizol溶液并用力吹打,再放入超声仪中碎成匀浆,按照RNA提取试剂盒说明书提取RNA,再逆转录成cDNA,实时荧光定量PCR检测各组豚鼠RPE细胞中RDH5 mRNA的相对表达量。扩增程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,60 ℃延伸30 s,循环40次。引物序列:RDH5正义链为5’-CTAGAGCACGCACTGACCG-3’,反义链为5’-CTTAGGAAGGAGCCAGGTGA-3’;β-actin正义链为5’-CTGGGTATGGAATCCTGTGG-3’,反义链为5’-GATCTTCATTGTGCTGGGTG-3’;GAPDH正义链为5’-TGAAGGTCGGAGTGAACGG-3’,反义链为5’-TGAAGGTCGGAGTGAACGG-3’。根据2-△△Ct,将空白对照组目的基因的相对表达量设置为1,计算出其他组目的基因校正后的相对含量。
1.2.3 免疫荧光染色法检测各组豚鼠RDH5分布及表达遮盖4周后迅速取出各组豚鼠眼球,并将其放入40 g·L-1多聚甲醛中固定2 h,梯度乙醇、二甲苯脱水,浸蜡包埋,制备视网膜切片;将视网膜切片放入二甲苯、梯度乙醇脱蜡至水,抗原修复,滴加体积分数3%过氧化氢去离子水,37 ℃破膜20 min,再滴加山羊血清封闭液封闭20 min;滴加RDH5抗体(1100),4 ℃孵育过夜;滴加Alexa Fluor®488二抗(1500),37 ℃孵育1 h,DAPI显色反应,用抗荧光淬灭剂封片并在荧光显微镜下观察,固定挑选5个200倍视野进行拍照。采用ImageJ软件对每组内每张切片进行分析并计算荧光强度,最后得到每组的平均荧光强度。
1.2.4 Western blot检测各组豚鼠RPE细胞中RDH5蛋白表达遮盖4周后取不同组别的豚鼠处死并剥离RPE细胞,加入200 μL的RIPA裂解液,超声仪充分裂解成匀浆,5000 r·min-1离心10 min,取出上清,先检测蛋白浓度,再加入蛋白上样缓冲液,100 ℃煮10 min,-20 ℃分装保存。根据RDH5蛋白的相对分子质量,制备80 g·L-1浓缩胶和分离胶,采用SDS-PAGE凝胶电泳法,蛋白上样量为40 μg,恒压280 mV电泳90 min;恒流350 mA转膜100 min;50 g·L-1牛血清白蛋白常温封闭2 h;滴加RDH5抗体(1600),β-actin(15000)4 ℃孵育过夜,TBST洗涤3次;滴加山羊抗兔的二抗(110 000),常温孵育2 h,TBST洗涤3次;再滴加ECL显影剂曝光并拍照。以β-actin为内参,使用Image Lab软件分析各组的蛋白条带灰度值。
1.3 统计学方法使用软件SPSS 26.0和GraphPad Prism 8进行统计分析并作图,所有数据至少为3次平均值,各项数据经Shapiro-Wilk检验呈正态分布,采用均数±标准差表示。两组间比较采用独立样本t检验;双眼RDH5蛋白和转录水平比较采用配对t检验;多组比较采用单因素方差分析,组间的多重比较采用LSD-t检验。检验水准:α=0.05。
2 结果
2.1 各组豚鼠不同遮盖时间的屈光度和眼轴长度比较3周龄豚鼠的初始屈光度均呈中度远视状态,三组间比较屈光度差异无统计学意义(F=0.11,P=0.67),眼轴长度差异无统计学意义(F=0.23,P=0.88);遮盖1周后,FDM组豚鼠的屈光度和眼轴长度变化较小,三组间比较差异均无统计学意义(P=0.43、P=0.10);随着遮盖时间的增加,FDM组豚鼠的屈光度表现出明显的近视化趋势,眼轴长度明显增加,而空白对照组和自身对照组仍保持低度远视状态,遮盖2周、3周、4周后,三组间比较差异均有统计学意义(均为P<0.05)。遮盖2周、3周、4周后,FDM组豚鼠的屈光度和眼轴长度均出现明显变化,与空白对照组和自身对照组之间差异均有统计学意义(均为P<0.05)(表1)。遮盖前到遮盖4周后,空白对照组和自身对照组远视屈光度均降低,眼轴长度均增加,但两组之间比较差异均无统计学意义(均为P>0.05)。
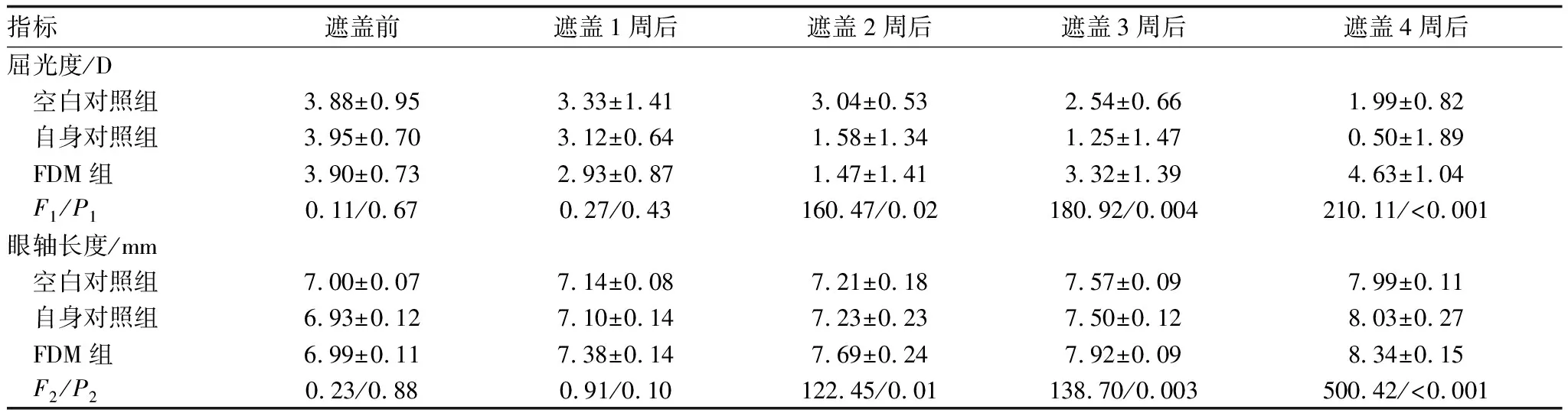
表1 遮盖不同时间三组豚鼠的屈光度和眼轴长度比较
2.2 各组豚鼠RDH5 mRNA相对表达量的比较经GraphPad Prism软件分析得出,遮盖4周后,三组豚鼠RPE细胞中的RDH5 mRNA相对表达量差异有统计学意义(P=0.01,F=9.57)。与空白对照组(1.13±0.02)和自身对照组(1.09±0.01)相比,FDM组豚鼠RPE细胞中RDH5 mRNA相对表达量(0.49±0.03)明显下调,差异均有统计学意义(P=0.01、P=0.03);自身对照组豚鼠的RDH5 mRNA相对表达量与空白对照组差异无统计学意义(P=0.79)。
2.3 各组豚鼠的RDH5蛋白的表达定位免疫荧光染色结果发现,各组豚鼠的RDH5蛋白表达于视网膜外核层(ONL)、光感受器内节和外节(IS/OS)以及RPE层,其中以RPE层为主(图1)。此外,与空白对照组(0.51±0.05)和自身对照组(0.48±0.09)相比,FDM组豚鼠RPE层的RDH5蛋白的荧光强度(0.16±0.02)最低,差异均有统计学意义(P=0.01、P=0.03);而空白对照组和自身对照组豚鼠RPE层的RDH5蛋白表达的荧光强度差异无统计学意义(P=0.82)。
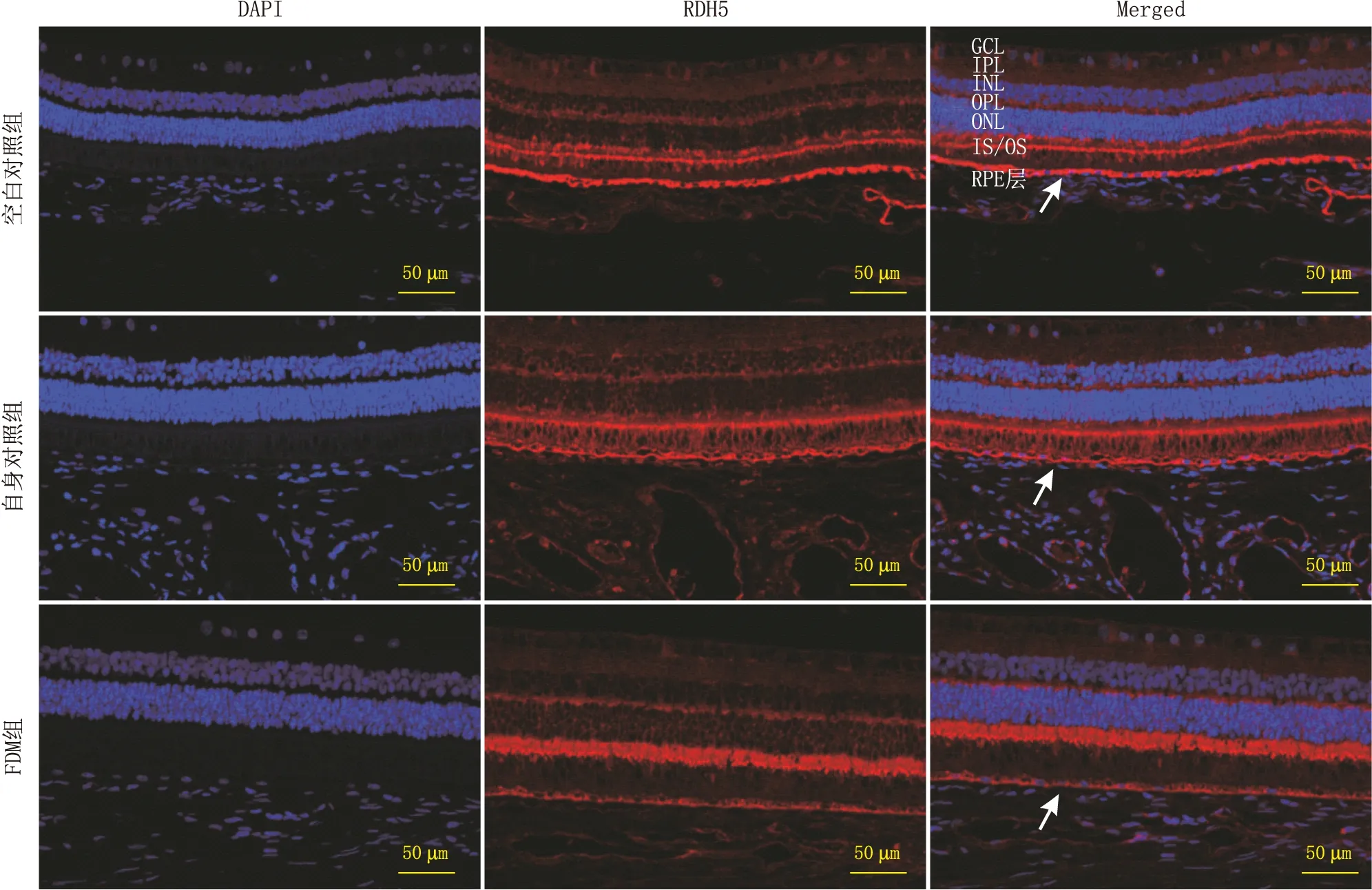
图1 遮盖4周后各组豚鼠RDH5蛋白的表达情况 注:GCL:神经节细胞层,OPL:外丛状层;IPL:内丛状层;白色箭头示RPE细胞。
2.4 各组豚鼠RDH5蛋白相对表达量的比较经GraphPad Prism软件分析结果显示,遮盖4周后,三组豚鼠间RPE细胞中RDH5蛋白相对表达量差异有统计学意义(P=0.02,F=15.24)。FDM组豚鼠RPE细胞中RDH5蛋白相对表达量(0.59±0.03)较空白对照组(1.03±0.05)和自身对照组(1.39±0.02)均明显下降(P=0.02、P=0.03)(图2)。空白对照组和自身对照组豚鼠RPE细胞中RDH5蛋白相对表达量差异无统计学意义(P=0.45)。即在遮盖诱导的豚鼠近视眼中RDH5蛋白的表达减少,而自身对照眼无变化。
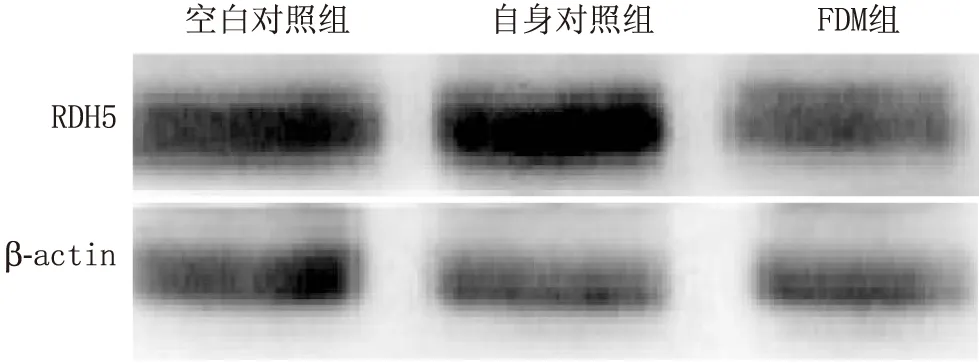
图2 遮盖4周后各组豚鼠RPE细胞中RDH5蛋白表达
3 讨论
本研究通过检测FDM豚鼠模型RPE细胞中RDH5的表达差异,发现在FDM豚鼠RPE细胞中的RDH5蛋白水平和mRNA水平均明显降低,提示RDH5基因在近视的发生发展中扮演了一定角色。RDH5是视觉周期的关键酶之一。Liu等[16]通过对培养人胎儿RPE细胞的遗传学研究和共定位近视候选基因,筛选出RDH5等位基因有助于降低近视。肖丹等[13]发现RDH5基因内含子单核苷酸多态性(SNP)位点rs3138144(G>C)影响了RDH5基因的启动子的转录活性,为研究RDH5分子机制的近视调控位点提供一定的线索。本研究首次在转录和翻译层面证明了RDH5基因与近视的关系,也为近视药物靶点研究提供一个新目标。
RDH5也是合成视黄酸(RA)的关键酶之一。RA作为一个重要的生长信号因子,既往研究显示其与近视的形成和发展密切相关,涉及RA代谢途径等信号通路[17-19]。Smith等[7]发现晶状体通过介导RDH10基因来调控RA含量,进一步促进眼球的生长。此外,RA受体-β(RAR-β)是RA识别目的基因的主要核受体之一,也与近视有着密不可分的关系。Huang等[20]发现在FDM豚鼠视网膜中的RA迅速升高,伴随着RAR-β表达水平增加。Seko等[21]也发现FDM小鸡巩膜中RAR-β mRNA表达上升,外源性RA可诱导RAR-β mRNA的表达。这些包括RDH5基因在内的与合成和识别RA有关的基因,被证明与近视存在一定的相关性。
本研究探讨了合成RA的关键酶RDH5在近视发生发展中的作用。RA参与分化、增殖和凋亡等生理功能,也参与眼球生长的调控[22]。最近发现内源性的RA可以作为一个配体与RA反应元件结合后,特异性地识别RDH10等视黄醇脱氢酶类的顺式作用元件,负反馈地调控RA含量的稳定[23]。这支持了本研究的结论,即视黄醇脱氢酶活性与近视相关分子——RA的合成相关。本研究中,在遮盖4周后,近视豚鼠RPE细胞中RDH5 mRNA和蛋白水平较豚鼠自身对照及空白对照眼均下降,其可能机制是由于在近视发展过程中体内的RA含量增多,呈负反馈地调节RDH5基因的表达。已经有体内研究证明,近视豚鼠眼内的RA含量明显增多;当外界给予RA后,也可促进眼轴的生长[24]。因此,RDH5基因参与近视的调控作用,可能与影响RA合成速率和含量有关。正如以往研究发现,影响合成RA的酶或转录因子,本身也受RA信号的调控[25-26]。
综上所述,本研究首次探索了在FDM豚鼠RPE细胞中RDH5的表达变化,结果显示RDH5基因在mRNA和蛋白水平的表达下调,提示RDH5基因可能与FDM存在一定的因果关系。RDH5可能作为关键信号分子或靶点参与近视的调控过程,但具体调控机制有待进一步探索和研究。

