1株重组猪繁殖与呼吸综合征病毒的分离鉴定及序列分析
董建国 , 饶 丹 , 刘 涛 , 胡 静 , 何书海 , 焦凤超 , 陈 斌 , 黄 立 , 赵攀登
(1. 信阳农林学院牧医工程学院 , 河南 信阳 464000 ; 2. 河南牧业经济学院动物医学院 , 河南 郑州 450046)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是一种对养猪业危害严重的传染病,该病的病原是猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)。PRRSV的基因型分为两类(I型、II型),在欧洲流行的以Lelystad virus (LV)为代表的毒株归为I型 ; 在北美流行的以VR-2332为代表的毒株归为II型,这2种毒株之间全基因组同源性仅为60%,抗原性也有很大差异[1-2]。我国首先分离到的PRRSV毒株为CH-1a[3],2006年高致病性毒株在我国暴发,造成了严重的经济损失[4]。近年来又流行了NADC30-like毒株。由于PRRSV的毒株较多、变异性强等特性,给该病的防控带来严峻的挑战,因此掌握PRRSV的遗传演化规律对防控PRRS十分关键。为了进一步了解广东地区PRRSV流行毒株的遗传特性,本试验在该地区分离到了PRRSV毒株,并对其全基因组进行了测序分析,掌握了该毒株的遗传演化特性,为广东地区PRRSV的防控提供数据支持。
1 材料与方法
1.1 病料与主要试剂 样品采自广东省某疑似暴发PRRS的猪场,采集发病猪的肺部病变组织,置于-80 ℃ 备用。Marc-145 细胞为本试验室保存;病毒DNA/RNA 提取试剂盒、Trans-5α感受态细胞、RT-PCR 相关试剂盒、胶回收试剂盒和DL2 000 DNA marker,均购自宝生物工程(大连)有限公司。
1.2 引物设计与合成 根据GenBank中收录的PRRSV代表毒株全基因组序列,设计出1对扩增GP5基因的鉴定引物(GP5F:5′-GTGTCAGGCATTGTGGCTGTG-3′;GP5R:5′-CATTATTGGCATGTAGGTGATAGAAAA-3′)和13对特异性引物用于扩增全基因组序列,引物由金维智有限公司合成。引物信息见表1。

表1 PRRSV全基因组扩增引物Table 1 Amplification primers of PRRSV whole genome
1.3 病料处理 将采集的病变组织剪碎,混合1 mL 的PBS在4 ℃环境下充分研磨,组织研磨液,10 000 r/min 离心10 min,收集上清液,用0.22 μm微孔滤器过滤除菌,得到的滤液置于-20 ℃保存。
1.4 病毒分离及间接免疫荧光试验 Marc-145传至6孔板培养,每个样品1个重复,待细胞长满后弃去培养液,用PBS清洗3次,随后接种100 μL含病毒的滤液,加入100 μL 不含血清含2%双抗的DMEM培养液,37 ℃培养1 h,弃去上清,加入含5%血清的DMEM维持液2 mL,置于细胞培养箱中培养3~5 d,观察细胞是否出现明显细胞病变效应(CPE),如果有80%细胞出现CPE,就将该细胞液收集置于-80 ℃冰箱保存备用。为了进一步鉴定出现CPE的细胞感染了PRRSV,同时将做的重复孔细胞用无水乙醇固定20 min,PBS洗涤3次,每次3 min; 加入抗PRRSV N蛋白单克隆抗体,室温孵育1 h;PBS洗涤3次,每次3 min;加入FITC标记的二抗,避光,室温孵育1 h;PBS洗涤3次,每次3 min;加入荧光猝灭剂,制作片子并在荧光显微镜下观察。
1.5 全基因组扩增及测序 收取培养至第3代的病毒,根据核酸提取试剂盒说明书操作提取病毒核酸,然后运用反转录试剂对病毒核酸进行反转录。将反转录得到的cDNA作为模板进行基因扩增,反应条件:94 ℃ 2 min;98 ℃ 10 s,62 ℃ 30 s,68 ℃ 2 min, 扩增30个循环;72 ℃ 7 min。取5 μL 的PCR 产物进行1%琼脂糖凝胶电泳鉴定,选取目的片段按照胶回收试剂盒说明书进行回收,得到的样品连接到pEASY-Blunt Simple Cloning Vector 上,转化至感受态细胞,挑菌鉴定后送至生工生物工程(上海)股份有限公司进行测序。
1.6 基因组序列对比分析 利用Lasergene 及Mega 5.0 软件对分离的GDhd毒株进行全基因组序列拼接,将得到的GDhd全基因组与国内外分离毒株进行序列比对并构建进化树,同时构建Nsp2基因和GP5基因的进化树,PRRSV代表毒株的基因序列均下载自GenBank。
2 结果
2.1 病料样品的RT-PCR检测 将病料提取的核酸作为模板,进行扩增,然后用1%琼脂糖凝胶电泳进行鉴定,结果显示,扩增片段大小符合预期结果(833 bp),同时阴性对照的RT-PCR检测结果显示为阴性(图1)。
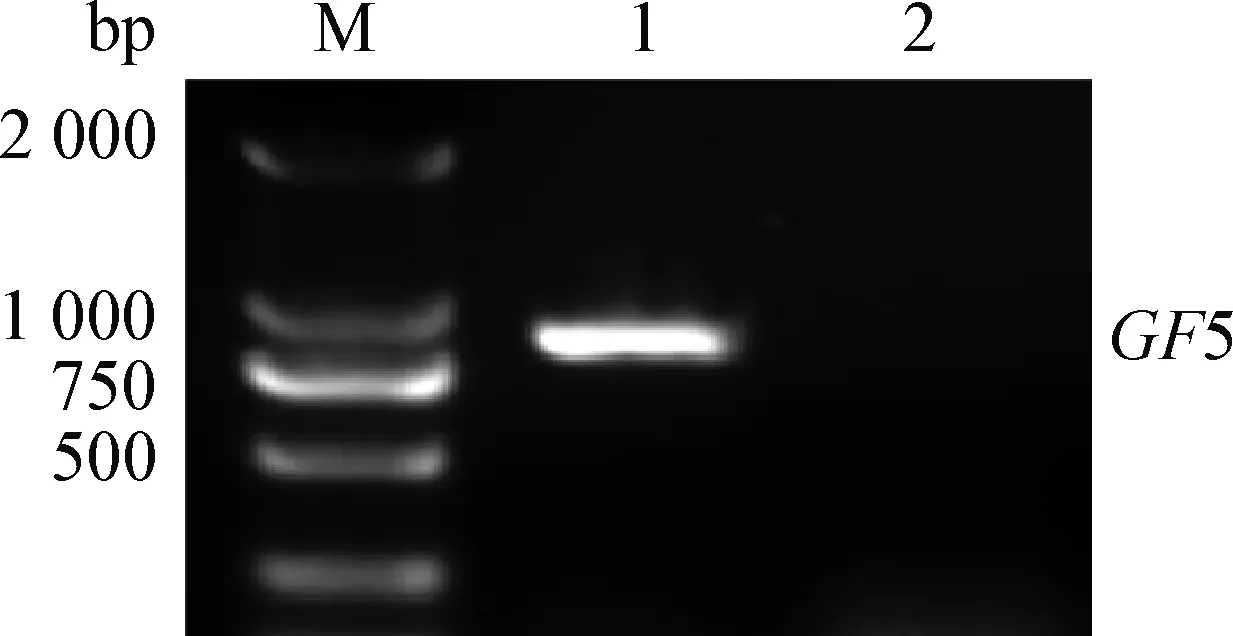
图1 PRRSV GDhd ORF5片段扩增Fig.1 Amplification of PRRSV GDhd ORF5 geneM:DNA分子质量标准 DL2 000; 1:样品; 2:阴性对照M:DNA marker DL2 000; 1:Sample; 2:Negative control
2.2 病毒分离培养及鉴定 病料处理液接种Marc-145细胞后连续培养观察3~5 d,待细胞出现聚集、皱缩并脱落等明显CPE时,进行间接免疫荧光鉴定,结果显示,接种病料组出现特异性的绿色荧光,证明病毒分离成功(图2)。
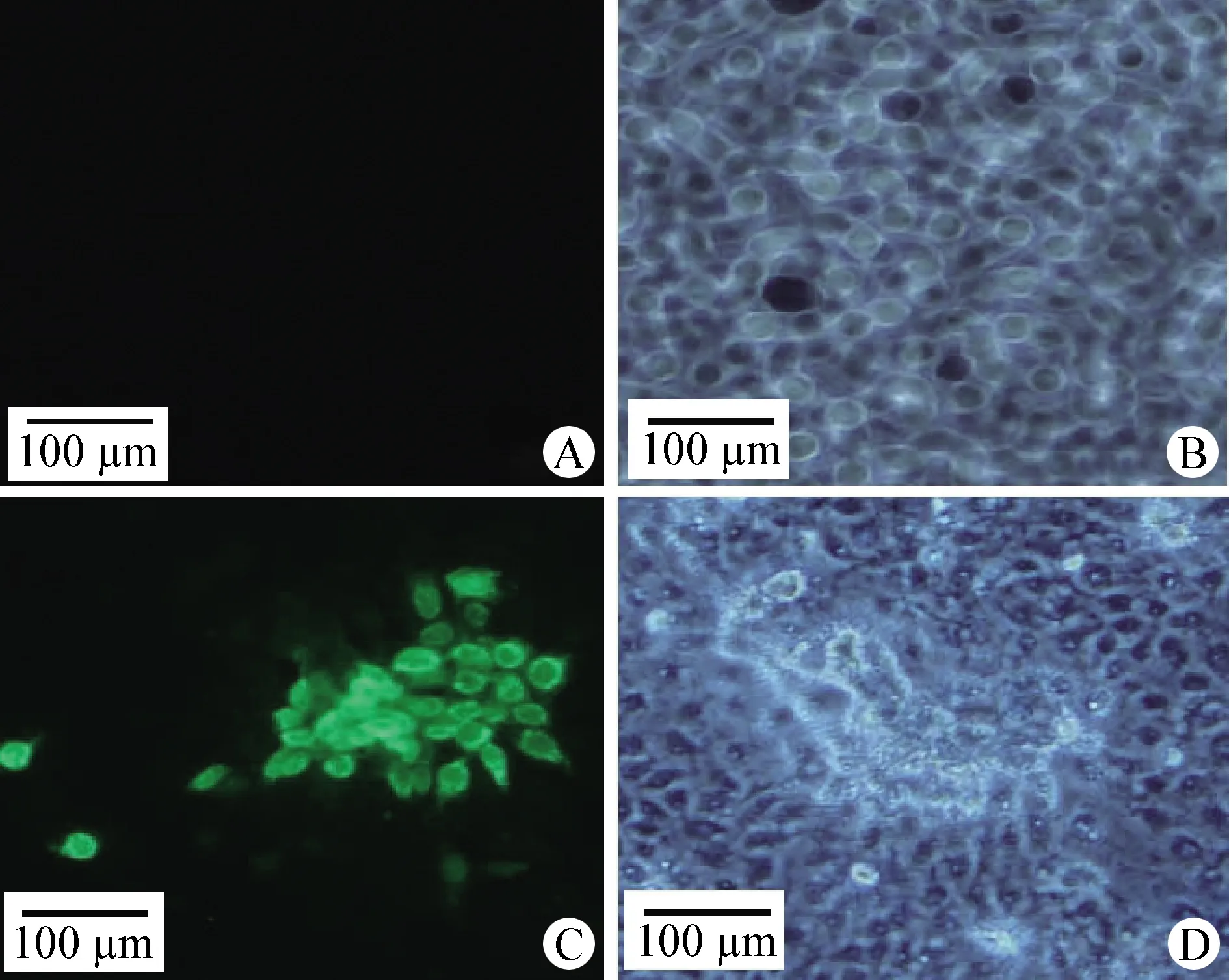
图2 PRRSV GDhd在Marc-145细胞上的病变结果(100×)Fig.2 Cytopathic effect of PRRSV GDhd on Marc-145 cell (100×)A:正常细胞(荧光); B:正常细胞(白光); C:病变细胞(荧光); D:病变细胞(白光)A:Normal cells (Fluorescence); B:Normal cells (White light); C:Pathological cells (Fluorescence); D:Pathological cells (White light)
2.3 全基因组扩增及测定 运用设计的特异性引物,对GDhd基因组不同片段进行特异性扩增,然后用琼脂糖凝胶电泳鉴定,结果显示,成功扩增出13个片段,片段大小符合预期。将扩增出的片段胶回收连接载体测序,结果显示,每个片段均测通,且均是PRRSV序列。对13个序列进行拼接得到全长为15 377 bp 的PRRSV全基因组序列,毒株命名为GDhd(图3)。
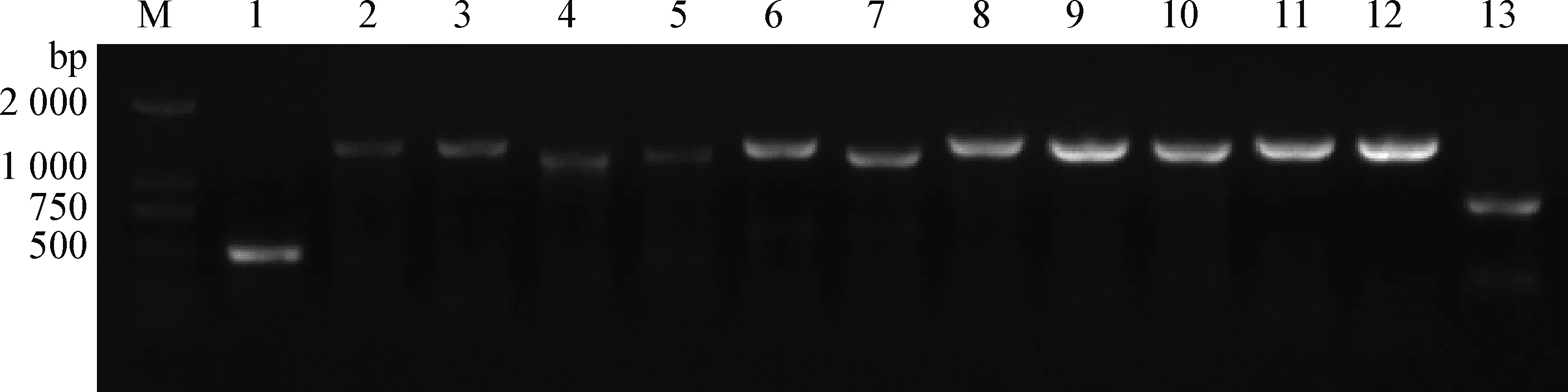
图3 PRRSV GDhd 13个基因片段的RT-PCR扩增结果Fig.3 RT-PCR amplification result of 13 gene fragments from PRRSV GDhd M:DNA marker DL2 000; 1~13:PRRSV GDhd 13个片段的扩增M:DNA marker DL2 000; 1-13:13 fragments amplified from PRRSV GDhd
2.4 GDhd全基因组遗传演化分析 用Mega 5.0 软件将GDhd毒株与GenBank上收录的其他具有代表性的PRRSV毒株构建进化树。结果显示,PRRSV主要分为2个大分支,即以Lelystad virus 为代表的欧洲型和以VR2332 为代表的美洲型,美洲型毒株又可细分出以美国NADC30毒株为代表的分支、以CH-1a为代表的我国低致病毒株分支以及以JXA1、HN4为代表的高致病毒株分支(图4)。结果表明,GDhd株与我国高致病毒株同属一个分支,与JXA1、HuN4、JXwn06等同源性较高。
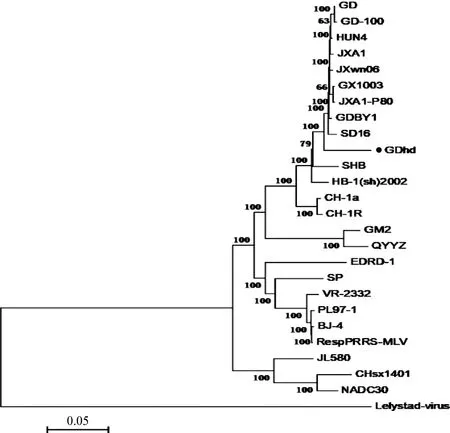
图4 PRRSV GDhd全基因组的进化树分析Fig.4 Phylogenetic tree analysis of PRRSV GDhd whole genome●:本试验分离的毒株●:The strains isolated in this test
2.5 GDhd全基因组同源性分析 用DNASTAR软件将GDhd与其参考毒株的序列对比,结果显示,GDhd与HuN4同源性最高,为95.6%,与其高致病毒株JXA1、JXwn06同源性为95.4%和95.5%,与NADC30 和NADC30-like毒株 JL580、CHsx1401 同源性分别为86.5%、88.9% 和85.4%,与美洲型代表株VR-2332 同源性为88.2%,与欧洲型代表株Lelystad virus 同源性仅为60.1%(图5)。

图5 PRRSV GDhd全基因序列比对Fig.5 Sequence alignment of PRRSV GDhd whole genome
2.6 编码Nsp2和GP5蛋白的基因序列的进化分析 分别用GDhd编码Nsp2和GP5蛋白的基因序列与参考毒株的对应基因序列对比分析构建进化树。结果如图6显示,GDhd和JL580在Nsp2编码区同属一个分支,GDhd和JXA1在GP5编码区处于同一分支。结果表明,GDhd毒株可能是1株重组毒株。

图6 PRRSV GDhd Nsp2和GP5基因遗传进化树分析Fig.6 Phylogenetic tree analysis of PRRSV GDhd Nsp2 and GP5 genesA:PRRSV Nsp2基因进化树分析; B:PRRSV GP5基因进化树分析A:Phylogenetic tree analysis of PRRSV Nsp2 gene; B:Phylogenetic tree analysis of PRRSV GP5 gene●:本试验分离的毒株●:The strains isolated in this test
2.7 GDhd的重组分析 利用生物信息学软件对GDhd毒株进行同源性分析。结果显示,GDhd存在重组现象,重组位点位于全基因组第1 310位点和第3 672位点,2个位点将GDhd分为3个区域,1区和3区与JXA1亲缘关系较近,2区与NADC30亲缘关系较近(图7)。发生重组的2区主要位于PRRSVNsp2编码区,GDhd毒株在Nsp2编码区与NADC30株同源性较高,这些结果表明GDhd是JXA1与NADC30的重组毒株,重组区域发生在Nsp2编码区。

图7 PRRSV GDhd重组分析Fig.7 Recombinant analysis of PRRSV GDhd
3 讨论
我国流行的PRRSV毒株主要是北美VR-2332的演化毒株,首次分离到的CH-1a毒株与VR-2332的全基因组序列差异较大,目前尚没有充足的证据证明其来源,随后分离到的BJ-4毒株与VR-2332同源性较高[5],可能是通过引进种猪传入我国。2006年,高致病性PRRS在我国流行,引起猪高发病率、高死亡率以及妊娠母猪繁殖障碍等,给我国养猪业造成了巨大的经济损失。分离到的毒株主要以JXA1、HuN4为代表,在Nsp2编码区存在30个不连续的氨基酸缺失[6-7]。近年来,我国又流行与美国NADC30相似的毒株,被命名为NADC30-like毒株[8],主要代表毒株有JL580和CHsx1401,与VR-2332毒株相比Nsp2在aa324~434、aa486和aa505~523存在131个不连续的氨基酸缺失。
为了解广东地区PRRSV流行毒株的遗传变异特性,本试验从广东某疑似PRRS发病猪场采集病料,并成功分离到PRRSV毒株,命名为GDhd。随后测定了该毒株的全基因组序列并与其他参考毒株进行比对分析,结果表明,该毒株与HuN4同源性最高,为95.6%,属于高致病性毒株;GDhdNsp2基因进化分析发现,GDhdNsp2和JL580Nsp2 在同一分支。重组分析显示,GDhd毒株在Nsp2编码区与NADC30株同源性较高,其他区域与JXA1同源性较高。这些结果表明,GDhd毒株是一种JXA1与NADC30重组的毒株,重组区域主要位于Nsp2编码区。近些年来,重组的毒株也被越来越多的报道,不同类型之间的毒株存在广泛重组现象,如lineage 1,3,5和8毒株之间重组[9-10],NADC30和疫苗毒株 JXA1-P80的重组[11],并且研究显示,重组产生的新毒株感染宿主后导致低中和抗体水平,致使猪更容易发病[12]。通过对2014—2018年的中国和美国毒株基因组分析显示,PRRSV重组位点主要位于nsp9,GP2和GP3区域[13],研究显示,重组是PRRSV毒株变异的重要原因[14]。本试验结果表明,Nsp2在基因重组中具有重要作用,是否与毒株的致病性有关需要进一步研究。
重组毒株可表现出不同的毒力及免疫原性,市场上的商品化疫苗对这类毒株常常缺乏保护,这也加剧了PRRS的防控难度。重组毒株的出现增加了PRRSV的多样性,对流行毒株遗传特性的研究对于新疫苗的研发十分重要,本试验通过对广东流行毒株GDhd进行分离鉴定及遗传特性分析,为研究重组毒株的重组特性及疫苗的研发提供了参考依据。

